
МИНИСТЕРСТВО НАУКИ И ОБРАЗОВАНИЯ
РОССИЙСКОЙ ФЕДЕРАЦИИ
Новосибирский государственный
архитектурно-строительный университет (Сибстрин)
Кафедра химии
Химическая кинетика
Методические указания по решению задач
для студентов I курса всех специальностей
и форм обучения
НОВОСИБИРСК 2009
Методические указания разработаны
канд. хим. наук, доцентом Н.В. Благининой,
канд. хим. наук, доцентом Т.М. Крутской,
канд. хим. наук, и.о. доцента М.Л. Косиновой
Утверждены на заседании учебно-методической комиссии СТФ
_______________________________
Рецензент: Н.И. Файнер, к.х.н., с.н.с. ИНХ СО РАН
Новосибирский государственный
архитектурно-строительный университет
(Сибстрин, 2009 г)
Т – температура, К;
t – температура, 0C;
р – давление, Па;
m(B) – масса вещества с формульной единицей В, г;
M(B) – молярная масса вещества B, г/моль;
n(B) = m(B)/M(B) – количество вещества, моль;
![]() (В) –
объем газообразного вещества при
нормальных у
(В) –
объем газообразного вещества при
нормальных у![]() словиях,
л;
словиях,
л;
![]() (В) –
молярный объем газообразного вещества
при нормальных условиях, равный 22,4
л/моль;
(В) –
молярный объем газообразного вещества
при нормальных условиях, равный 22,4
л/моль;
с(В) – молярная концентрация вещества В, моль/л;
![]() –
средняя скорость химической реакции,
моль/л∙c;
–
средняя скорость химической реакции,
моль/л∙c;
– истинная скорость химической реакции, моль/л∙с;
– время, с;
Δ = 2 – 1 – время протекания реакции, с;
![]() –
константы
скоростей прямой и обратной реакций,
соответственно;
–
константы
скоростей прямой и обратной реакций,
соответственно;
– температурный коэффициент скорости реакции;
Еa – энергия активации, кДж/моль;
н.у. – нормальные условия, T=273K, р=101,3·103 Па;
с.у. – стандартные условия, T=298K, р=101,3·103 Па;
С.О.(Э) – степень окисления элемента
Кинетика химических реакций
Основные определения
Химическая кинетика – раздел физической химии, изучающий скорости протекания химических реакций, их механизм и факторы, влияющие на скорость реакций. Скорость химической реакции определяется изменением количества одного из реагентов или продуктов реакции в единицу времени в единице реакционного пространства. Отсюда скорость реакции
![]() , (1)
, (1)
где
![]() – изменение количества вещества
– изменение количества вещества
![]() ,
моль, за промежуток времени реакции
,
моль, за промежуток времени реакции
![]() ,
с-1;
,
с-1;
![]() – объем системы, л.
– объем системы, л.
Учитывая, что молярная концентрация вещества
![]() моль/л,
(2)
моль/л,
(2)
то изменение молярной концентрации
![]() ,
моль/л;, (3)
,
моль/л;, (3)
и
,соответственно, получаем среднюю
скорость реакции за промежуток времени
![]() :
:
![]() , (4)
, (4)
где знак (+) относится к изменению концентрации продуктов реакции, знак (-) – к изменению концентрации реагентов.
В уравнении химической реакции:
![]() (5)
(5)
![]() ,
– реагенты – вещества, вступающие в
реакцию;
,
– реагенты – вещества, вступающие в
реакцию;
![]() ,
,
![]() – продукты – вещества, образующиеся в
результате реакции;
– продукты – вещества, образующиеся в
результате реакции;
![]() ,
,
![]() ,
,
![]() ,
,
![]() – стехиометрические коэффициенты,
показывающие, какое количество
соответствующего вещества участвует
в реакции.
– стехиометрические коэффициенты,
показывающие, какое количество
соответствующего вещества участвует
в реакции.
В ходе реакции концентрации веществ все время меняются, поэтому в химической кинетике рассматривают истинную, или мгновенную скорость реакции (в данный момент времени) и выражают ее первой производной концентрации вещества по времени:
![]() (6)
(6)
Скорость химической реакции зависит от многих факторов: от природы реагирующих веществ, концентрации, температуры, присутствия катализаторов, давления (в реакциях с участием газов).
Под природой реагирующих веществ понимают реакционную способность этих веществ, которая, так же как физические и химические свойства веществ, зависит от их состава, строения и внутримолекулярных связей.
Закон действующих масс
Влияние концентрации веществ на скорость реакции определяется законом действующих масс: при постоянной температуре скорость гомогенной химической реакции пропорциональна произведению концентраций реагирующих веществ, возведенных в степени, равные стехиометрическим коэффициентам в уравнении реакции.
Закон действующих масс для прямой гомогенной реакции,
![]() (7)
(7)
протекающей
слева направо в однородной среде (смесь
газов, раствор) (![]() ),
имеет вид:
),
имеет вид:
![]() (8)
(8)
Для гетерогенной реакции, протекающей на границе раздела фаз (твердой и жидкой, твердой и газообразной) концентрации веществ, находящихся в конденсированном состоянии, постоянны и включаются в константу скорости реакции. Тогда для прямой реакции
![]() ,
(9)
,
(9)
если вещество твердое, закон действующих масс запишется:
![]() (10)
(10)
Для обратимых химических реакций, которые могут протекать как в прямом, так и в обратном направлениях, скорости реакции (5) запишутся:
Таблица 1
Вид реакции |
скорость реакции |
|
прямой ( ) |
обратной
( |
|
Гомогенная |
|
|
Гетерогенная: вещества и твердые или жидкие |
|
|
– константы скоростей прямой и обратной реакций, соответственно. Физический смысл константы скорости: при концентрации всех реагирующих веществ, равных 1 моль/л, константа скорости равна скорости реакции.
Константа скорости реакции зависит от природы реагирующих веществ, температуры и присутствия катализатора. Для каждой реакции при постоянной температуре константа скорости величина постоянная.
Используя
закон действующих масс, можно определить,
как будет изменяться скорость реакции
при изменении параметров системы:
![]() ,
,
![]() ,
.
,
.
Пример 1. Для гомогенной газофазной реакции
![]()
определить: а) во сколько раз изменится скорость прямой реакции, если концентрацию азота уменьшить в 2 раза, а концентрацию водорода увеличить в 2 раза; б) давление в системе увеличить в 3 раза.
Решение. а) Согласно закону действующих масс, скорость прямой химической реакции описывается уравнением
![]() .
.
После изменения концентрации реагентов будут равны
![]() ;
;
![]() ,
тогда
,
тогда
![]() ,
или
,
или
![]() .
.
Изменение скорости прямой реакции по отношению к первоначальной:
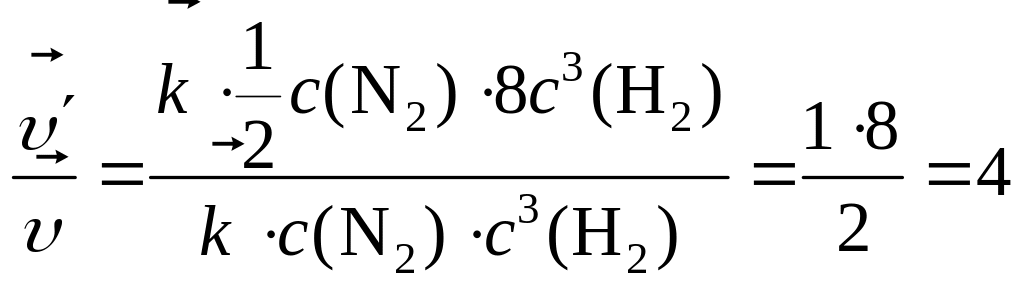 ,
,
т. е. скорость прямой реакции увеличится в 4 раза.
б) Из уравнения состояния газов (уравнение Менделеева-Клапейрона)
![]() (11)
(11)
следует с учетом (2):
![]() , (12)
, (12)
что
(при
![]() )
прямо пропорционально молярной
концентрации газообразных веществ.
)
прямо пропорционально молярной
концентрации газообразных веществ.
Следовательно,
увеличение (или уменьшение) давления в
системе в
![]() раз приводит соответственно к увеличению
(или уменьшению) концентрации всех
газов-участников реакции также в
раз.
раз приводит соответственно к увеличению
(или уменьшению) концентрации всех
газов-участников реакции также в
раз.
Тогда
по условию задачи при увеличении давления
в 3 раза новые концентрации веществ (![]() ):
):
![]() ;
;
![]() ,
,
тогда
![]() или
или
![]() ,
,
откуда:
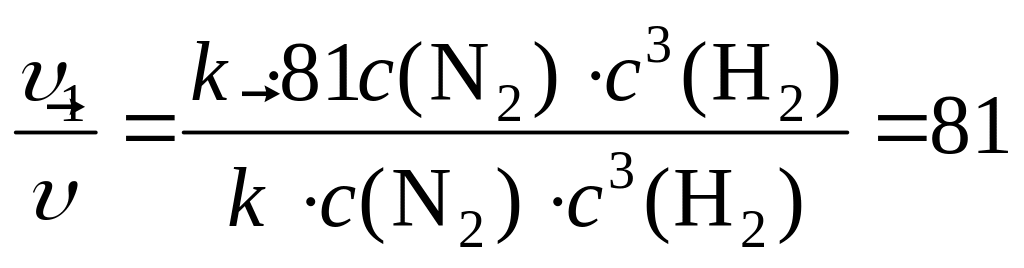 ,
,
т. е. скорость прямой реакции увеличится в 81 раз.
Пример
2. Для реакции
![]() определите: а) как был изменен объем
системы, если скорость прямой реакции
уменьшилась в 4 раза? б) во сколько раз
при этом изменилась скорость обратной
реакции?
определите: а) как был изменен объем
системы, если скорость прямой реакции
уменьшилась в 4 раза? б) во сколько раз
при этом изменилась скорость обратной
реакции?
Решение. а) Прямая реакция гетерогенная, концентрация твердого углерода не входит в выражение скорости реакции, поэтому:
![]() ,
,
или, учитывая:
![]() ,
,
получаем:
![]() .
.
Обозначим
новый объем
![]() ;
так как количество
;
так как количество
![]() в системе не меняется, то
в системе не меняется, то
![]() ,
,
и
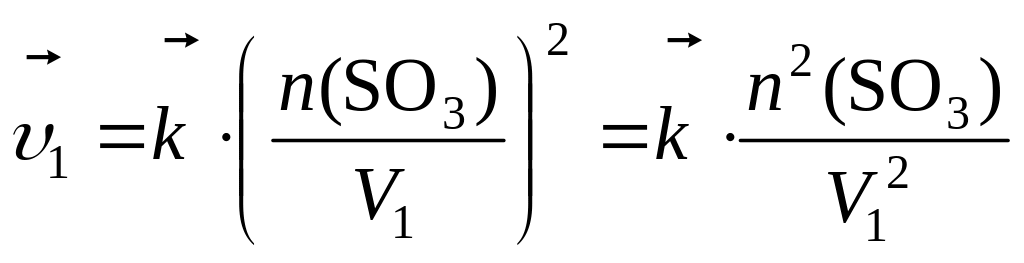
По
условию задачи
![]() ,
откуда
,
откуда
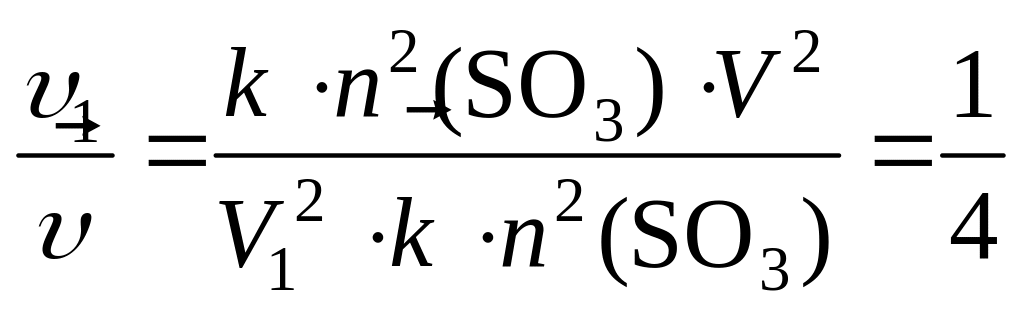 ;
;
![]() или
или
![]() ,
т. е.
,
т. е.
![]() .
.
Следовательно,
объем системы увеличился в 2 раза (![]() ).
).
б) Поскольку молярная концентрация вещества обратно пропорциональна объему системы (уравнение 2), то при увеличении объема в раз концентрации газообразных и растворенных веществ уменьшаются в раз, а при уменьшении объема системы в раз концентрации этих веществ увеличиваются в раз.
Если объем системы увеличился в 2 раза, то для обратной гомогенной реакции закон действующих масс запишется:
до изменения объема:
![]() ;
;
после увеличения объема в 2 раза:
![]()
![]() .
.
И тогда отношение скоростей будет равно:
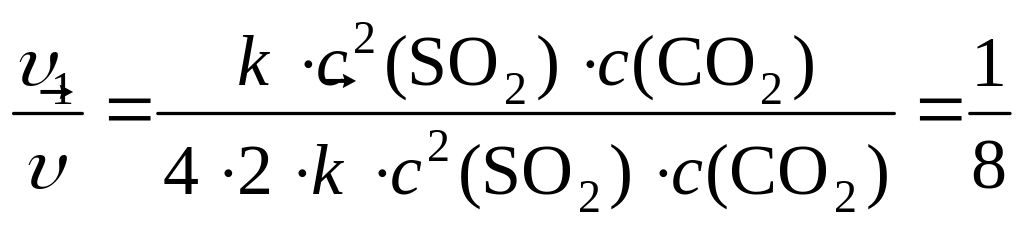
Таким образом, скорость обратной реакции уменьшилась в 8 раз.
