
-
Зависимость скорости реакции от температуры
-
Правило Вант-Гоффа
-
С повышением температуры скорость реакции увеличивается. Зависимость скорости реакции от температуры приближенно описывается эмпирическим правилом Вант-Гоффа: при повышении температуры на каждые 10° скорость реакции увеличивается в 2-4 раза.
Математическое выражение правила Вант-Гоффа:
![]() (16),
(16),
а при условии, что концентрации всех реагирующих веществ равны 1 моль/л:
![]() (17),
(17),
где
![]() ,
,
![]() и
и
![]() ,
,
![]() - соответственно скорости и константы
скоростей реакции при температурах
- соответственно скорости и константы
скоростей реакции при температурах
![]() и
и
![]() .
.
Температура
может быть выражена как в °С, так и в К,
так как изменение температуры не зависит
от единиц измерения (![]() ).
).
![]() - температурный
коэффициент скорости реакции,
который показывает, во сколько раз
возрастает скорость реакции при повышении
температуры на 10 градусов:
- температурный
коэффициент скорости реакции,
который показывает, во сколько раз
возрастает скорость реакции при повышении
температуры на 10 градусов:
![]() (18)
(18)
Поскольку
при концентрациях реагирующих веществ
1 моль/л скорость химической реакции
численно равна константе скорости
![]() ,
то
,
то
![]() (19)
(19)
Учитывая
тот факт, что скорость реакции обратно
пропорциональна времени ее протекания
из уравнения (18), при
![]() получаем
получаем
![]() (20)
(20)
Используя уравнения (16 – 20), можно рассчитать:
-
константу скорости (или скорость) реакции при заданной температуре, если известны значения этих величин при двух других температурах;
-
на сколько градусов надо повысить (или понизить) температуру реакции, чтобы скорость ее увеличилась (или уменьшилась) в N раз;
-
при какой температуре следует проводить реакцию, чтобы она закончилась за определенное время, если известны температурный коэффициент реакции и скорость ее при любой температуре;
-
температурный коэффициент реакции и т. д.
Пример
7. Рассчитайте
константу скорости химической реакции
при
![]() °С,
если константа скорости этой реакции
при температурах 400 °С и 500 °С равна
соответственно 0,03 и 50,3.
°С,
если константа скорости этой реакции
при температурах 400 °С и 500 °С равна
соответственно 0,03 и 50,3.
Решение
а).
Для определения
![]() запишем уравнение Вант-Гоффа (17), используя
запишем уравнение Вант-Гоффа (17), используя
![]() или
или
![]() :
:
![]() или
или
![]()
Учитывая:
![]() ,
,
![]() ,
получаем:
,
получаем:
![]() или
или
![]() (21)
(21)
б).
Температурный коэффициент
![]() рассчитываем из отношения
рассчитываем из отношения
![]() ,
полученного из уравнения (17):
,
полученного из уравнения (17):
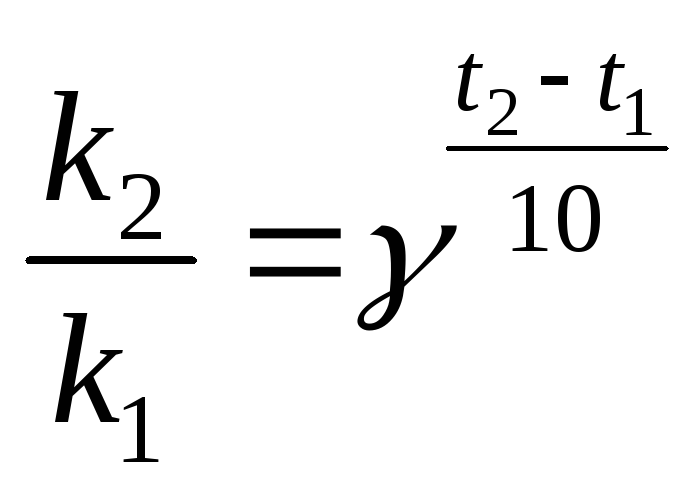
![]()
![]()
![]()
![]()
![]()
![]() .
.
в)![]() рассчитываем, подставляя полученное
значение
рассчитываем, подставляя полученное
значение
![]() в уравнения (21):
в уравнения (21):
![]()
![]()
![]()
или
Ответ:
![]() при
при
![]() °С.
°С.
Пример
8. На сколько
градусов надо повысить температуру
реакции, чтобы скорость ее увеличилась
в 15 раз, если
![]() .
.
Решение. Из математического выражения правила Вант-Гоффа (16) и условия задачи получаем:
![]() ,
откуда
,
откуда
![]() (22)
(22)
Логарифмируя
уравнение (22), получаем формулу для
определения
![]() :
:
![]()
![]() (23)
(23)
Подставляя в (23) условия задачи, получаем:
![]() °
°
Ответ: Температуру реакции надо повысить на 7,78 °.
Примечание:
Если известна температура (![]() ),
при которой проводилась реакция ранее,
то используя полученные данные, можно
рассчитать температуру (
),
при которой проводилась реакция ранее,
то используя полученные данные, можно
рассчитать температуру (![]() ),
при которой следует проводить реакцию,
чтобы скорость ее увеличилась в N
раз:
),
при которой следует проводить реакцию,
чтобы скорость ее увеличилась в N
раз:
![]() .
.
Пример 9.
Сколько времени потребуется для
проведения реакции при температуре 348
°К, если при температуре 298 °К она
заканчивается за 30 минут;
![]() .
.
Решение
-
Из правила Вант-Гоффа (16) следует:
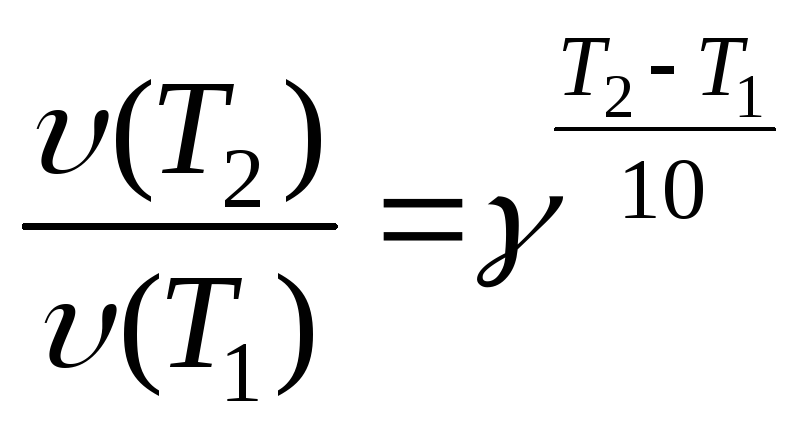 (24)
(24)
-
Поскольку скорость реакции обратно пропорциональна времени (1, 4), то
![]() (25)
(25)
-
Из (24), (25) получаем:
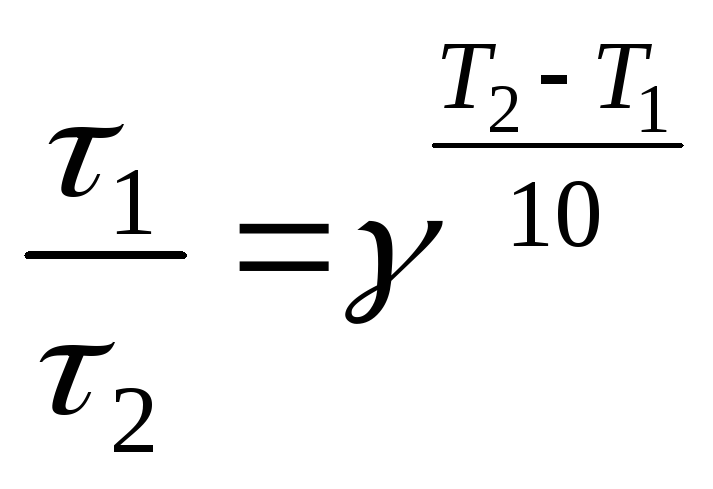 ,
,

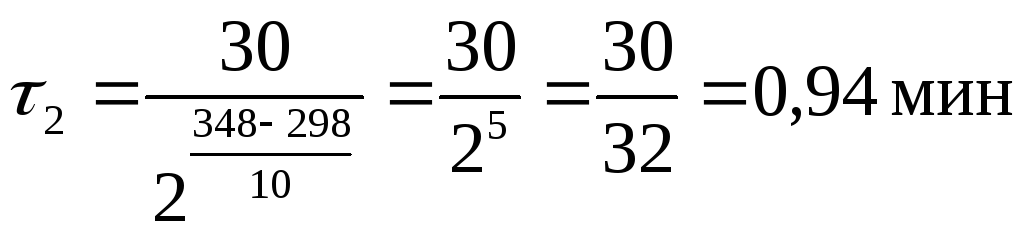
Таким
образом, при
![]() К реакция закончится за 0,94мин.
К реакция закончится за 0,94мин.
-
Уравнение Аррениуса
Более точно зависимость константы скорости реакции от температуры описывается уравнением Аррениуса:
![]() , (26)
, (26)
Если при изменении температуры концентрация реагентов остается постоянной, то зависимость скорости реакции от температуры описывается уравнением:
![]() ,
где (27)
,
где (27)
![]() -
основание натурального логарифма;
-
основание натурального логарифма;
![]() -
энергия активации реакции, Дж/моль;
-
энергия активации реакции, Дж/моль;
![]() -
универсальная газовая постоянная,
-
универсальная газовая постоянная,
![]() Дж/моль·К;
Дж/моль·К;
![]() -
температура, К;
-
температура, К;
![]() -
предэкспоненциальный множитель;
-
предэкспоненциальный множитель;
![]() при
при
![]() .
.
Энергия
активации – это минимальная дополнительная
или избыточная энергия по сравнению со
средней энергией реагирующих частиц,
которой должны обладать соударяющиеся
частицы, чтобы вступить в реакцию.
Частицы, обладающие такой энергией,
называются активными. Энергия активации
процесса зависит от природы реагирующих
веществ. Значения энергии активации
для химических реакций могут составлять
от 40 до 200 кДж/моль. По
гипотезе Аррениуса химическое
взаимодействие осуществляется только
при соударении активных частиц, доля
которых в системе пропорциональна
величине
![]() .
С увеличением температуры доля этих
частиц в системе растет и соответственно
растет скорость реакции.
.
С увеличением температуры доля этих
частиц в системе растет и соответственно
растет скорость реакции.
Используя уравнение Аррениуса можно рассчитать:
-
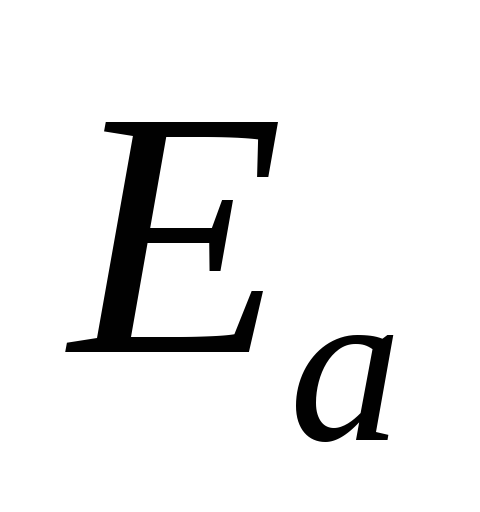 и
и
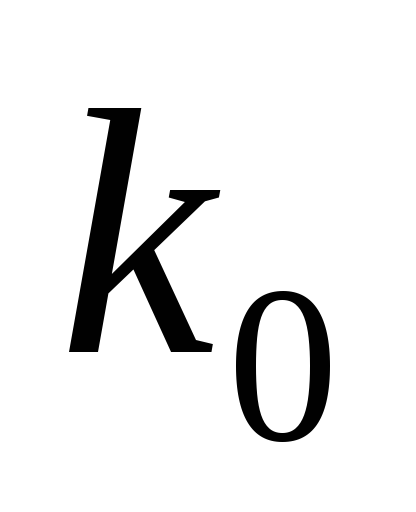 реакции, если известны константы
скорости реакции при двух температурах;
реакции, если известны константы
скорости реакции при двух температурах; -
константу скорости реакции при заданной температуре, если известны энергия активации реакции и константа скорости при какой-либо температуре.
Скорости при нескольких температурах можно рассчитать двумя способами.
Пример 10. Рассчитайте энергию активации процесса, если известно:
|
|
726 |
746 |
766 |
|
|
0,0103 |
0,02447 |
0,05803 |
Решение.
![]() рассчитываем, используя уравнение
Аррениуса (26) для двух температур:
рассчитываем, используя уравнение
Аррениуса (26) для двух температур:
![]() и
и
![]()
Откуда:

Прологарифмировав
последнее уравнение, с учетом того, что
![]() получаем:
получаем:
![]()
и, соответственно:
![]()
Для 726 К и 746 К:
![]() Дж/моль.
Дж/моль.
Для 726 К и 766 К:
![]() Дж/моль.
Дж/моль.
Для 746 К и 766 К:
![]() Дж/моль.
Дж/моль.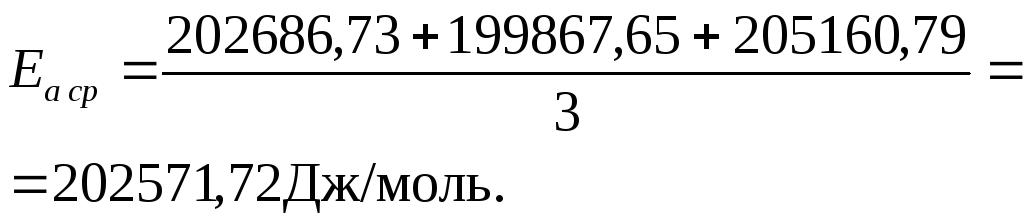
Средняя
энергия активации равна![]()
![]() кДж/моль.
кДж/моль.
Пример
11. Рассчитайте
![]() и
и
![]() процесса, если известны константы
скоростей реакции при различных
температурах.
процесса, если известны константы
скоростей реакции при различных
температурах.
|
|
283 |
303 |
313 |
|
|
2,43 |
10,53 |
21,9 |
Решение.
![]() ,
,
![]() определяем графическим методом, используя
логарифмическую форму уравнения
Аррениуса (26):
определяем графическим методом, используя
логарифмическую форму уравнения
Аррениуса (26):
![]() (28)
(28)
Для этого представим экспериментальные данные в следующем виде:
|
|
3,53 |
3,30 |
3,19 |
|
|
0,38 |
1,02 |
1,34 |
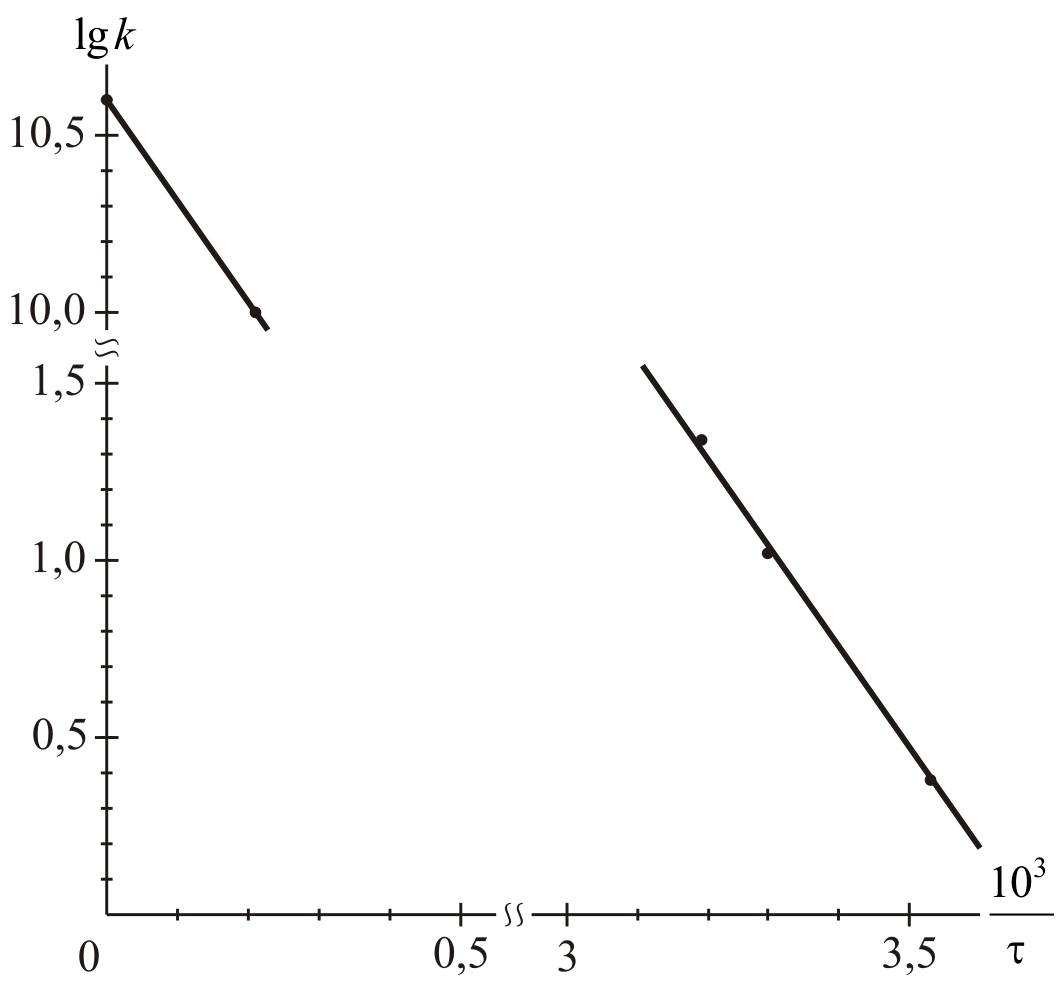
На
их основе строим график зависимости
![]() от
от
![]() (см. рис. 1).
(см. рис. 1).
Из рис.1, согласно уравнению (26)
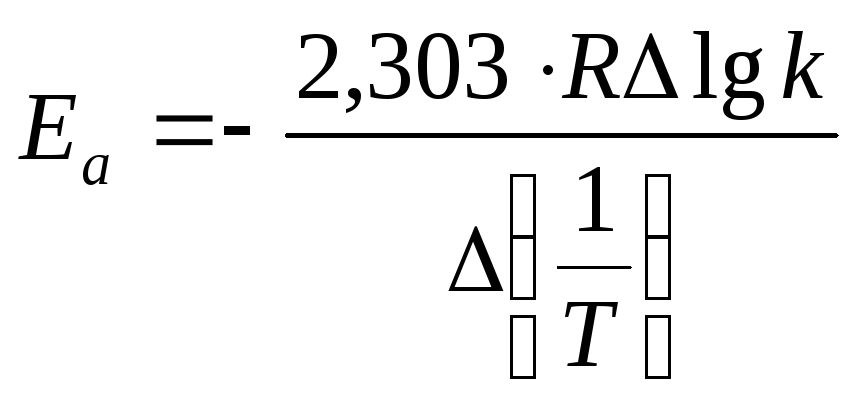
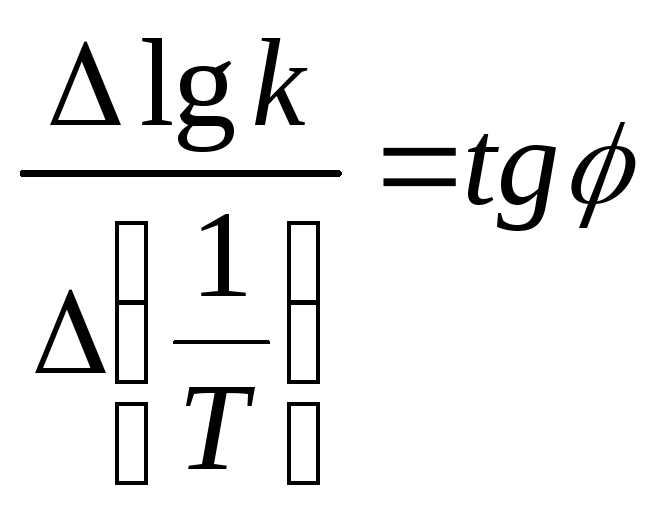 находим
из графика:
находим
из графика:
![]()
![]() Дж/моль.
Дж/моль.
Из уравнения (24) следует:
![]() .
.
![]() .
.
Продлив
график до пересечения с осью
![]() ,
получаем
,
получаем
![]()
![]() .
.
Таким
образом:
![]() Дж/моль,
Дж/моль,
![]() .
.
Приложение 1
|
Федеральное агентство по образованию Новосибирский государственный архитектурно-строительный университет
Кафедра химии
Индивидуальное задание по химии
Работу выполнил студент: ______________________ группа_____ «___»____________2009 г. Работу проверил преподаватель: ________________________ «___»____________2009 г.
Новосибирск 2009
|
