
Кинетика ферментативных реакций
Влияние концентрации фермента на скорость ферментативной реакции.
Влияние концентрации субстрата на скорость ферментативной реакции.
I. Кинетика – наука, изучающая закономерности изменения скорости химических реакций во времени. Кинетической закономерности подчиняются и ферментативные реакции. Особенностью их является образование фермент-субстратного комплекса, насыщение фермента субстратом.
Под скоростью ферментативной реакции понимают активность фермента. Её можно измерить либо по количеству превращаемого субстрата, либо по нарастанию концентрации продукта реакции в единицу времени.
Зависимость скорости ферментативной реакции от концентрации фермента описывается уравнением:
v
= k[E],
где v- скорости ферментативной реакции;k– константа пропорциональности; [E] – концентрация фермента. Величинаkзависит от химической природы фермента и субстрата.
Графически это уравнение представляет собой прямую линию. Однако такая зависимость наблюдается только в начальный период реакции, когда концентрация субстрата [S] находится в избытке по отношению к концентрации фермента [E]: [S] >> [E].
II. Любую ферментативную реакцию можно описать уравнением:
k1
k-1
[E] + [S] [ES] +
P, 

где [S] – концентрация субстрата; [ES] – концентрация фермент-субстратного комплекса;k1– константа скорости образования [ES];k-1 – константа скорости распада [ES]; Р – продукты реакции.
Обозначим: [E0] – общая концентрация фермента; ([E0] – [ES]) – концентрация свободного фермента. Согласно закону действия масс можно записать:
([E0] – [ES]) [S] k1 = [ES] k-1
Разделив обе части на уравнения на k1, обозначим отношенииk-1/k1=ks.ks– константа диссоциации комплексаES; она представляет собой обратную величину химического сродства фермента к субстрату: чем <ks, тем >ES.
([E0] – [ES]) [S] = [ES] ks
[ES] – величина, трудно определяемая экспериментально, от неё необходимо избавиться:
[E0] [S] - [ES] [S] = ks [ES]
[E0] [S] = [ES] (ks + [S])
[E0][S]
[ES] = ---------- (1)
kS + [S]
Следовательно скорость ферментативной реакции в общем случае определяется величиной [ES].
Максимальная скорость реакции (Vmax) будет наблюдаться, когда весь фермент будет участвовать в образовании комплексаES. Следовательно:
Vmax [ES]
v = ---------- (2)
[E0]
подставив в уравнение (2) значение [ES] (1) получим:
Vmax
[S]

v = ----------
KS + [S]
Этоосновноеуравнение кинетики ферментативной реакции - Михаэлиса-Ментен
Данное уравнение имеет несколько решений:
[S] >>KS; тогда величинойKS можно пренебречь иv=Vmax, пока концентрация субстрата велика, скорость реакции близка к максимальной и практически мало изменяется до тех пор, пока уменьшение концентрации субстрата не будет значительным. Реакция будет иметь нулевой порядок (n= 0).
[S] <<KS; тогда практически скорость реакции будет описываться уравнением
Vmax
v = ------ [S],
KS
где VmaxиKS– кинетические константы и данное уравнение – уравнение прямой линии; скорость ферментативной реакции пропорциональна концентрации субстрата. Это реакция первого порядка (n= 1).
Величина [S] – промежуточная; пусть [S] =KS,v= 1/2Vmax. В данном случае порядок реакции будет дробный (0 <n<1).
Графическое решение уравнения
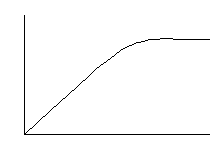
Vmax n = 0
0 < n <1
1/2Vmax
n = 1

n – порядок реакции
[s]
v

Таким образом, в ферментативных реакциях порядок реакции меняется в ходе самой реакции. При n = 0 не наблюдается дальнейшего увеличения скорости ферментативной реакции, т.к. произошло насыщение фермента субстратом. В неферментативных химических реакциях порядок от её начала до конца практически не меняется.
Уравнение Михаэлиса-Ментен справедливо для начала ферментативной реакции, когда в реагирующей смеси мало продуктов реакции. Дж. Бриггс и Дж. Холдейн модифицировали уравнение Михаэлиса-Ментен, они исходили из следующего уравнения ферментативной реакции:
k1 k2
E + S ES
Е + P 


k-1
В этом ранении учитывается распад комплекса ESна Е иP, введя константу распадаk2. Тогда
Vmax [S]
v = ----------
Km+ [S]
Кm= (k-1+k2)/k1– константа Михаэлиса – это концентрация субстрата, при которой скорость реакции составляет половину максимальной. Величина Кmхарактеризует фермента к субстрату. Чем меньше величина Кmтем больше сродство фермента к данному субстрату.
