
- •Дисциплина: Общая и неорганическая химия
- •1 Моль вещества э(эквивалента) - содержит 6,02*1023э(эквивалентов)
- •Объединенный газовый закон
- •Уравнение Клайперона-Менделеева
- •Закон Дальтона
- •3.Окислительно-восстановительные реакции. Степень окисления. Окислители, восстановители. Типы окислительно-восстановительных реакций
- •Основные положения теории о-в процессов:
- •Окислительно-восстановительные свойства элементов
- •Виды окислительно-восстановительных реакций
- •4. Растворы. Насыщенные и ненасыщенные растворы. Способы выражения содержания растворенного вещества в растворе (массовая и мольная доли; молярная, эквивалентная, моляльная концентрации; титр)
- •Способы выражения концентрации растворов
- •Теории растворов
- •5.Гидролиз растворов солей. Степень гидролиза и факторы, влияющие на нее. Типичные случаи гидролиза (показать на примерах).
- •Соль слабого основания и сильной кислоты (nh4no3, ZnCl2, Al2(so4)3)
- •6.Электролиз расплавов и растворов солей. Катодные и анодные процессы. Законы Фарадея.
- •Электролиз расплавов
- •Электролиз водных растворов
- •Законы электролиза
- •Выход по току
- •Координационная теория Вернера (1893 г.)
- •Номенклатура комплексных соединений
- •8. Строение атома. Квантовые числа. Принципы наименьшей энергии. Правило Клечковского, принцип Паули, правило Хунда. Составление электронных формул.
- •Строение атома по Бору (1913):
- •9.Периодический закон и система д.И. Менделеева
- •Структуры периодической системы:
- •Периодическая система и электронная структура атома
- •10. Типы химической связи (ковалентная , ионная, металлическая, водородная)
- •11. Химия элементов и их соединений I группа пс. Водород: особенности электронной структуры, изотопы. Получение и применение водорода и щелочных металлов. Получение и применение меди, серебра, золота.
- •Водород
- •Получение
- •Химические свойства водорода
- •Применение
- •Щелочные металлы
- •Медь, серебро и золото
- •Способы получения металлов d-элементов I группы:
- •Применение
- •12. II группа пс. Амфотерность бериллия и его соединений. Общая характеристика подгруппы d- элементов.
- •Соединения Ве и Mg
- •Щелочноземельные металлы
- •Цинк, кадмий и ртуть
- •13. Жесткость воды и способы ее устранения.
- •16. V группа пс. Особенности химической связи в молекуле азота. Важнейшие соединения азота (аммиак, оксиды азота, азотная и азотистая кислота и их соли). Взаимодействие азотистой кислоты с Ме и неМе.
- •17. Элементы 6 группы пс. Кислород: оксиды, пероксиды. Строение и свойства озона. Сера: оксиды, кислоты, соединения серы с Ме и неМе.
- •18. Свойства серной кислоты. Особенности взаимодействия разбавленной и концентрированной серной кислоты с Ме и неМе.
- •20. Элементы VII группы пс. Химические свойства галогенов: степени окисления, галогенводороды, соединения с кислородом, кислоты, содержащие хлор и их соли.
- •22. VIII группа пс. Подгруппа d- элементов: триоды элементов и их химические свойства. Оксиды, гидроксиды и комплексные соединения этих элементов.
Координационная теория Вернера (1893 г.)
Объясняет строение комплексных соединений.
1.Центральное место в комплексных соединениях занимает комплексообразователь, обычно положительно заряженный ион.
2.Вокруг комплексообразователя расположены лиганды, т.е. ионы противоположенного знака или нейтральные молекулы.
3.Комплексообразователь и лиганды образуют внутреннюю среду комплексных соединений.
4. Ионы не вошедшие во внутреннюю сферу составляют внешнюю сферу комплексных соединений.
K3+ [Fe3+(CN)-6]3-
Fe3+ -комплексообразователь
CN- -лиганды
[Fe(CN)6]3- внутренняя сфера комплексного соединения
K+ - внешняя сфера (ионы калия)
К важнейшим комплексообразователям относятся катионы d и f-элементов (Zn2+, Cd2+, Cu+, Cu2+, Ag+, Au+, Pt2+, Pt4+ и др.)
Важным параметром комплексных соединения является координационное число (КЧ), которое показывает сколько σ-связей между комплексообразователем и лигандами.
Различают лиганды:
|
- монодентантные; |
- бидентантные; |
- полидентантные; |
Лиганды способны занимать, только одно координационное место, т.е. образовывать одну σ-связь с комплексообразователем называются монодентантными.
К ним относятся: а) однозарядные анионы (Сl-, Br-, I-, NO2-, CN-, NO-, SCN-); б) нейтральные молекулы (H20, NH3, R-OH, R-NH2).
Лиганды, которые могут занимать более одного координационного места, называются полидентатными.
К бидентатнымлигандами относятся: а) анионы двухосновных кислот (SO42-,SO32-,S2O32,S2-,C2O42-); б) нейтральные молекулы (NH2CH2CH2NH2– этилендиамин)
Координационное число – определяется как произведение числа лигандов на их дентантность.
K4[Fe(CN)6] КЧ(Fe2+)=6
Координационное число зависит от степени окисления комплексообразователя и его электронной структуры, от природы лигандов, от условия протекания реакции.
Более высоким степеням окисления комплексообразователя отвечают более высокие КЧ.
КЧ изменяются от 2 до 9, причем 95% всех комплексонообразователей имеют КЧ=4 или 6. Величина КЧ для некоторых комплексообразователей постоянна. (Например КЧ [Pt4+,Cr3+]=6 всегда)
Номенклатура комплексных соединений
Название К.С. производят по общему правилу: сначала называют анион в именительном падеже, затем катион в родительном.
1 – Название комплексного катиона составляется следующим образом, сначала указывают числа и названия нейтральных, а затем заряженных лиганд, при указании чисел используют греческие числительные (моно, ди, три, тетра, пента, гексо и т.д.).
Для нейтральных лигандов используют собственные названия кроме: вода-аква; аммиак-амин; СО – карбонил, NO – нитрозил. Отрицательно заряженные лиганды называют с окончанием О.
Последним называют комплексообразователь по-русски с указанием его степени окисления в скобках римскими цифрами.
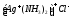 хлорид
диаминсеребра (I)
хлорид
диаминсеребра (I)
2 – Название комплексного аниона составляет аналогично названию катиона, только комлексообразователь называют по латыни с окончанием АТ.
K+4[Fe2+(CN)-6]4- гексоцианоферрат (II) калия
3 – Нейтральная частица называется также как и катионы, но комплексообразователь в именительном падеже, а степень окисления не указывают, т.к. она однозначно определяется электронейтральностью комплекса.
[PtCl2(NH3)2] диаминдихлороплатина



