
- •Дисциплина: Общая и неорганическая химия
- •1 Моль вещества э(эквивалента) - содержит 6,02*1023э(эквивалентов)
- •Объединенный газовый закон
- •Уравнение Клайперона-Менделеева
- •Закон Дальтона
- •3.Окислительно-восстановительные реакции. Степень окисления. Окислители, восстановители. Типы окислительно-восстановительных реакций
- •Основные положения теории о-в процессов:
- •Окислительно-восстановительные свойства элементов
- •Виды окислительно-восстановительных реакций
- •4. Растворы. Насыщенные и ненасыщенные растворы. Способы выражения содержания растворенного вещества в растворе (массовая и мольная доли; молярная, эквивалентная, моляльная концентрации; титр)
- •Способы выражения концентрации растворов
- •Теории растворов
- •5.Гидролиз растворов солей. Степень гидролиза и факторы, влияющие на нее. Типичные случаи гидролиза (показать на примерах).
- •Соль слабого основания и сильной кислоты (nh4no3, ZnCl2, Al2(so4)3)
- •6.Электролиз расплавов и растворов солей. Катодные и анодные процессы. Законы Фарадея.
- •Электролиз расплавов
- •Электролиз водных растворов
- •Законы электролиза
- •Выход по току
- •Координационная теория Вернера (1893 г.)
- •Номенклатура комплексных соединений
- •8. Строение атома. Квантовые числа. Принципы наименьшей энергии. Правило Клечковского, принцип Паули, правило Хунда. Составление электронных формул.
- •Строение атома по Бору (1913):
- •9.Периодический закон и система д.И. Менделеева
- •Структуры периодической системы:
- •Периодическая система и электронная структура атома
- •10. Типы химической связи (ковалентная , ионная, металлическая, водородная)
- •11. Химия элементов и их соединений I группа пс. Водород: особенности электронной структуры, изотопы. Получение и применение водорода и щелочных металлов. Получение и применение меди, серебра, золота.
- •Водород
- •Получение
- •Химические свойства водорода
- •Применение
- •Щелочные металлы
- •Медь, серебро и золото
- •Способы получения металлов d-элементов I группы:
- •Применение
- •12. II группа пс. Амфотерность бериллия и его соединений. Общая характеристика подгруппы d- элементов.
- •Соединения Ве и Mg
- •Щелочноземельные металлы
- •Цинк, кадмий и ртуть
- •13. Жесткость воды и способы ее устранения.
- •16. V группа пс. Особенности химической связи в молекуле азота. Важнейшие соединения азота (аммиак, оксиды азота, азотная и азотистая кислота и их соли). Взаимодействие азотистой кислоты с Ме и неМе.
- •17. Элементы 6 группы пс. Кислород: оксиды, пероксиды. Строение и свойства озона. Сера: оксиды, кислоты, соединения серы с Ме и неМе.
- •18. Свойства серной кислоты. Особенности взаимодействия разбавленной и концентрированной серной кислоты с Ме и неМе.
- •20. Элементы VII группы пс. Химические свойства галогенов: степени окисления, галогенводороды, соединения с кислородом, кислоты, содержащие хлор и их соли.
- •22. VIII группа пс. Подгруппа d- элементов: триоды элементов и их химические свойства. Оксиды, гидроксиды и комплексные соединения этих элементов.
16. V группа пс. Особенности химической связи в молекуле азота. Важнейшие соединения азота (аммиак, оксиды азота, азотная и азотистая кислота и их соли). Взаимодействие азотистой кислоты с Ме и неМе.
Атомы элементов группы VА имеют конфигурацию ns2np3. Имея пять электронов на внешней электронной оболочке, эти элементы характеризуются в целом как неметаллы и проявляют высшую степень окисления +5. Три неспаренных р - электрона участвуют в образовании трех ковалентных связей, при этом элементы проявляют степени окисления +3 и –3. По группе сверху вниз увеличиваются размеры атомов и ионов, уменьшаются энергии ионизации. Этим обусловлено нарастание металлических свойств.
Молекула
N2
образована поэтому
прочна, вследствие этого свободныйN2
инертен
при комнатной температуре, реагирует
только с литием, все остальные реакции
протекают в жестких условиях. С неМе:
поэтому
прочна, вследствие этого свободныйN2
инертен
при комнатной температуре, реагирует
только с литием, все остальные реакции
протекают в жестких условиях. С неМе:

Для водных р-ров аммиака характерны 2 вида равновесия

Аммиак реакционно способное в-во, характерны реакции: присоединении

Замещения
 ;
;
Окисление аммиака – горение в О2, Сl2

Аммиак сильный в-ль
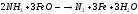
Соли аммония растворимы в воде (гидролиз) и термически неустойчивы, при нагревании разлагаются на аммиак и к-ту:

Исключение нитрат аммония
 ;
;
нитрид аммония
 ;
;
дихромат аммония

Оксиды азота N2O NO N2O3 NO2 (N2O4) N2O5

NO2 ангидрид 2х кислот

В щелочах

При пропускании NO2 через воду в присутствии кислорода образуется только азотная к-та

Азотистая к-та HNO2 – неустойчивая, разлагается при нагревании:


Соли – нитриты и азотистая к-та обладают окислительно-восс-ной двойственностью

Азотная к-та
1) Взаимодействие с Ме:
а) конц. Азотная кислота в обычных условиях не реагирует с Fe Al Cr:

б) с тяжелыми Ме конц. Азотная восстанавливается до NO2, разбавленная до NO :

в) со щелочными и щелочно-земельными Ме конц. Азотная восстанавливается до N2O, разбавленная – до аммиака или NH4NO3 :

2) Взаимодействие с неМе и сложными в-вами( конц. Азотная восстанавливается до NO2, разбавленная до NO):

3) Разложение на свету

Соли нитраты при нагревании разлагаются:


В отличие от азотной к-ты ее соли нитраты проявляют сильные окислительные свойства, только при сплавлении за счет выделяющегося кислорода:

17. Элементы 6 группы пс. Кислород: оксиды, пероксиды. Строение и свойства озона. Сера: оксиды, кислоты, соединения серы с Ме и неМе.
Атомы элементов VI группы характеризуются двумя различными структурами внешнего электронного слоя содержащего либо шесть, либо одного или двух электронов. К первому типу, помимо кислорода, относится сера и элементы подгруппы селена (Se, Te, Po), ко второму — элементы подгруппы хрома (Cr, Mo, W).
Кислород - Сильный окислитель, взаимодействует практически со всеми элементами, образуя оксиды. Образует 4 вида соединений – оксиды(О2-), пероксиды (О22-), надпероксиды (О2-), озониды (О3-). Молекулярные ионы О2- и О3- образуют только активные щелочные Ме. Различие свойств оксидов проявляется при их взаимодействии с водой, а также при взаимодействии оксидов разного типа друг с другом.
CaO + H2O = Ca(OH)2 ; P2O5 + 3H2O = 2H3PO4 ; 3CaO + P2O5 = Ca3(PO4)2
основный основании кислотный кислота соль
Амфотерные оксиды с водой не взаимодействуют, но могут реагировать с кислотами и щелочами. Состав кристаллических оксидов, в особенности d- элементов, часто переменный (нестехиометрический).
С водородом кислород образует два важных соединения – воду и пероксид водорода, который на свету и под действием катализатора (MnO2) легко разлагается: 2 Н2О2 = О2 + 2 Н2О.
Н2О2 в кислой среде и пероксиды металлов в щелочной среде проявляют сильные окислительные и умеренные восстановительные свойства :
H2O2(ок-ль) + 2H+ +2е = 2H2O ; Na2O2 + 2 H2O + 2е = 4OH– + 2 Na+
H2O2(в-ль) – 2е = O2 + 2H+ ; Na2O2 – 2е = O2 + 2 Na+
Аллотропное видоизменение кислорода – озон O3 . Молекула озона диамагнитна, имеет угловую форму, полярна. В технике озон получают в озонаторах действием тлеющего электрического разряда на кислород:
3 O2 = 2 O3 (ΔН0 > 0)
Озон – сильнейший окислитель. Действием озона почти все металлы переводятся в оксиды, сульфиды окисляются им в сульфаты, аммиак – в азотистую и азотную кислоты. В реакциях с участием озона обычно образуется кислород:
2 Ag + O3 = Ag2O + O2 ;
PbS + 2 O3 = PbSO4 + O2
Для количественного определения озона используют реакцию его взаимодействия с раствором KI:
2 KI + O3 + H2O = O2 + I2 + 2 KOH
Сера. Химически активна при нагревании, реагирует с кислородом, водородом, галогенами (кроме йода), фосфором, углем и со всеми Ме кроме золота, платины. Подвергается дисмутации в кипящей воде и кипящих растворах щелочей:

Сульфиты
при избытке серы переходят в тиосульфаты:

Сероводород. Сульфиды.
Получают взаимодействием серы с водородом:

Или действием разбавленных кислот на сульфид железа:

Сероводород горит на воздухе:

Для качественного анализа обнаружения сероводорода, используют пропитанную р-ром Pb(NO2)2 и затем высушенную фильтровальную бумагу в присутствии сероводорода или сульфидов – бумага чернеет из-за образования
PbS:

Р-р сероводорода в воде –слабая 2х основная к-та, диссациирует незначительно


Растворимы лишь соли щелочных и щ/з Ме. Многие сульфиды не растворяются в разбавленных кислотах. Поэтому получают по обменным реакциям:

Сероводород и сульфиды сильные восстановители, сероводород и растворимые сульфиды окисляются обычно до серы или при действии очень сильных окислителей до сульфат иона. Нерастворимые сульфиды окисляются до сульфатов:

Диоксид серы. Получение сернистого газа при сжигании серы или сероводорода

Обжигом сульфидных руд

Диоксид серы хорошо растворяется в воде с образованием кислой среды

SO2 кислотный оксид при взаимодействии его со щелочами образуются соли сульфиты SO32- и гидросульфиты HSO3- Оксиды обладают сильными восстановительными св-ми и слабыми окислительными:

Триоксид серы. SO3 получают каталитическим окислением диоксида серы кислородом воздуха:

SO3 – серный ангидрид разлагается при высоких температурах, взаимодействует с щелочами и галогенводородами, с водой образует серную к-ту:



H2SO4 сильная 2х основная кислота, гигроскопичная. HSO4- Ггидросульфаты, SO42- сульфаты. Катион Ва используется для обнаружения сульфат ионов:

Взаимодействие серной к-ты с Ме протекает по разному в зависимости от концентрации к-ты и активности Ме. Разбавленая к-та взаимодействует только с Ме в ряду активности до Н:

Конц. К-та является сильным окислителем за счет S6+ она окисляет Ме в ряду по Ag, продуктами ее взаимодействия м/б разные в-ва в зависимости от активности Ме и условий реакции:
Конц. холодная к-та не взаимодействует с FeAlCr
С малоактивными Ме к-та восстанавливаеся до SO2

С активными Ме продукты восстановления м/б SO2SH2S

Окислительные св-ва конц. К-ты проявляются и при взаимодействии с другими восстановителями. Она окисляет HBrHI(но не соляную) и их соли до свободных галогенов а также СSH2SР:

Полисерные к-ты H2SO4*nSO3 олеул. Образуется при растворении SO3 в серной к-те. При н=1 образуется H2S2O7 дисерная к-та – окислитель, разлагается при нагревании и при взаимодействии с горячей водой и щелочами:


Ее соли дисульфаты образуются при нагревании гидросульфатов:

Пироксокислоты H2SO5 или H2SO3(O2) пироксосерная к-та.
Пироксосерная
кислота

Пироксодисерная
кислота

К-ту H2S2O8 получают электролизом серной к-ты или гидросульфатов:

К-та H2SO5 образуется при действии 100% пероксида водорода на H2S2O8

Обе к-ты разлагаются при нагревании и сами к-ты и их соли сильные окислители:

Подвергаются гидролизу:

Тиосерная к-та H2S2O3 сильная но неустойчивая:

Структура

Ее соли тиосульфаты образуются при кипячении сульфитов серой:

И к-та и ее соли сильные восстановители:

Политионовые к-ты H2SnO6 – сильные к-ты в свободном виде не выделены. Существуют только в р-ре,, образуются в качестве промежуточных продуктов при взаимодействии сероводорода с полигидратом SO2*nH2O.
При слабом нагревании разлагаются:

Проявляют окислительно-восстановительную двойственность

