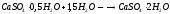- •Дисциплина: Общая и неорганическая химия
- •1 Моль вещества э(эквивалента) - содержит 6,02*1023э(эквивалентов)
- •Объединенный газовый закон
- •Уравнение Клайперона-Менделеева
- •Закон Дальтона
- •3.Окислительно-восстановительные реакции. Степень окисления. Окислители, восстановители. Типы окислительно-восстановительных реакций
- •Основные положения теории о-в процессов:
- •Окислительно-восстановительные свойства элементов
- •Виды окислительно-восстановительных реакций
- •4. Растворы. Насыщенные и ненасыщенные растворы. Способы выражения содержания растворенного вещества в растворе (массовая и мольная доли; молярная, эквивалентная, моляльная концентрации; титр)
- •Способы выражения концентрации растворов
- •Теории растворов
- •5.Гидролиз растворов солей. Степень гидролиза и факторы, влияющие на нее. Типичные случаи гидролиза (показать на примерах).
- •Соль слабого основания и сильной кислоты (nh4no3, ZnCl2, Al2(so4)3)
- •6.Электролиз расплавов и растворов солей. Катодные и анодные процессы. Законы Фарадея.
- •Электролиз расплавов
- •Электролиз водных растворов
- •Законы электролиза
- •Выход по току
- •Координационная теория Вернера (1893 г.)
- •Номенклатура комплексных соединений
- •8. Строение атома. Квантовые числа. Принципы наименьшей энергии. Правило Клечковского, принцип Паули, правило Хунда. Составление электронных формул.
- •Строение атома по Бору (1913):
- •9.Периодический закон и система д.И. Менделеева
- •Структуры периодической системы:
- •Периодическая система и электронная структура атома
- •10. Типы химической связи (ковалентная , ионная, металлическая, водородная)
- •11. Химия элементов и их соединений I группа пс. Водород: особенности электронной структуры, изотопы. Получение и применение водорода и щелочных металлов. Получение и применение меди, серебра, золота.
- •Водород
- •Получение
- •Химические свойства водорода
- •Применение
- •Щелочные металлы
- •Медь, серебро и золото
- •Способы получения металлов d-элементов I группы:
- •Применение
- •12. II группа пс. Амфотерность бериллия и его соединений. Общая характеристика подгруппы d- элементов.
- •Соединения Ве и Mg
- •Щелочноземельные металлы
- •Цинк, кадмий и ртуть
- •13. Жесткость воды и способы ее устранения.
- •16. V группа пс. Особенности химической связи в молекуле азота. Важнейшие соединения азота (аммиак, оксиды азота, азотная и азотистая кислота и их соли). Взаимодействие азотистой кислоты с Ме и неМе.
- •17. Элементы 6 группы пс. Кислород: оксиды, пероксиды. Строение и свойства озона. Сера: оксиды, кислоты, соединения серы с Ме и неМе.
- •18. Свойства серной кислоты. Особенности взаимодействия разбавленной и концентрированной серной кислоты с Ме и неМе.
- •20. Элементы VII группы пс. Химические свойства галогенов: степени окисления, галогенводороды, соединения с кислородом, кислоты, содержащие хлор и их соли.
- •22. VIII группа пс. Подгруппа d- элементов: триоды элементов и их химические свойства. Оксиды, гидроксиды и комплексные соединения этих элементов.
12. II группа пс. Амфотерность бериллия и его соединений. Общая характеристика подгруппы d- элементов.
Ко II группе периодической системы элементов относятся бериллий, щелочноземельные металлы: магний, кальций, стронций, барий и радий (главная подгруппа) и подгруппа цинка: цинк, кадмий, ртуть (побочная подгруппа). Своим названием щелочноземельные металлы обязаны тому, что их оксиды (земли) при растворении в воде образуют щелочные растворы.
На внешнем электронном уровне элементов главной и побочной подгрупп находятся по 2 электрона (s2), которые они отдают, образуя соединения со степенью окисления +2.
Для всех элементов II группы характерны сравнительно низкая температура плавления и высокая летучесть. У щелочноземельных элементов растворимость гидроксидов увеличивается от магния к барию: гидроксид магния почти не растворяется в воде, гидроксид кальция растворяется слабо, а гидроксид бария - хорошо.
Be, Mg, Ca получают электролизом расплавов их хлоридов в смеси с NaCl (Be), KCl (Mg,Ca) и CaF2 (Ca). Применяют также восстановление оксидов и фторидов металлов алюминием, магнием, углеродом, кремнием:
4ЭО
+ 2Al ЭО ∙ Al2O3
+ 3Э (Э – Ca,
Sr,
Ba)
ЭО ∙ Al2O3
+ 3Э (Э – Ca,
Sr,
Ba)
BeF2
+ Mg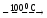 MgF2
+ Be
MgF2
+ Be
MgO
+ C
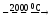 Mg↑ + CO
Mg↑ + CO
2MgO
+ 2CaO + Si
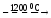 2CaO + SiO2
+ 2Mg↑
2CaO + SiO2
+ 2Mg↑
Металлы группы IIА - сильные восстановители. Они довольно легко реагируют с большинством неметаллов, легко растворяются в кислотах. Ве амфотерен (единственный из s-элементов), поэтому реагирует и с кислотами, и со щелочами, при этом образуются аква- и гидроксокомплексы :
Be + 2H3O+ + 2H2O = [Be(H2O)4]2+ + H2
Be + 2 OH— + 2H2O = [Be(OH−)4]2− + H2
Соединения Ве и Mg
1) Гидриды Ве и Mg - твердые полимерные соединения, разлагающиеся при слабом нагревание на металл и водород, их формулы (ВеН2)n и (MgH2)n .Получают их, из гидрирод других металлов.
BeCl2 + 2 LiH = BeH2 + 2 LiCl
2) Оксиды ВеО, МgО – тугоплавкие белые порошки. С водой образуют гидроксиды, растворяются в кислотах, а ВеО взаимодействует и с основными и с кислотными оксидами.
3) Гидроксиды Ве, Мg – белые амфотерные в-ва мало растворимые в воде. Мg(OH)2 – основание средней силы растворим только в кислотах; Ве(ОН)2 – полимерное соединение, амфотерен.
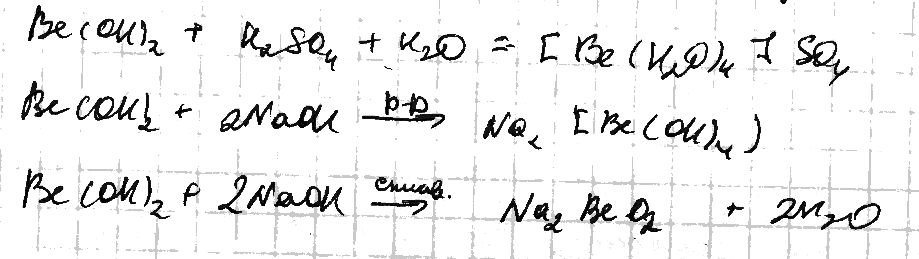
4) Соли Ве подвргаются гидролизу уже при обычных температурах, а соли остальных Ме не гидролизуются. Для Ве характерно образование комплексных солей
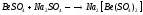
Щелочноземельные металлы
Имеют большие атомные радиусы и низкие значения потенциалов ионизации по сравнению с Ве и Магнием. В растворах образуют ионы Э2+, комплексные ионы неустойчивые.
Получение: Са и Sr электролизом их расплавленных хлоридов. Ва – алюмотермическим методом.
Химически активны, взаимодействуют с О, Н, Н2О и практически со всеми неМе.
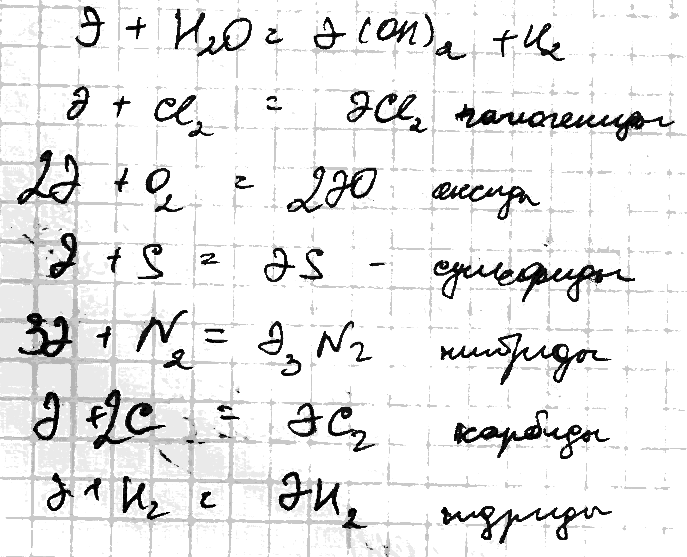
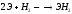 гидриды.
Разлагаются водой и окисляются кислородом
гидриды.
Разлагаются водой и окисляются кислородом
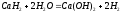
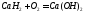
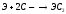 карбид.
Они полностью нейтрализуются водой:
карбид.
Они полностью нейтрализуются водой:
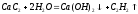
Оксиды ЭО – белые тугоплавкие вещества, получают разложением карбонатов или нитратов, с водой образуют гидроксиды:
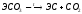 (Э=Ве,
Са, Mg,
Sr)
(Э=Ве,
Са, Mg,
Sr)
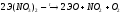
Пероксиды ЭО2 получают взаимодействием оксидов с кислородом при нагревании или взаимодействием оснований с Н2О2
Гидроксиды Э(ОН)2 – сильные основания растворимые в воде. От Са к Ва увеличивается основный характер растворимость и термическая устойчивость. Са(ОН)2 используется в технике как наиболее дешевое сильное основание, в строительстве.

Гидроксид кальция используется в технике, как наиболее дешевое сильное основание, так же в строительстве. Смесь гидроксида кальция, песка и воды называется известковым раствором, который применяется в качестве штукотурки.
Соли СаСО3 – мел, мрамор, известняк; СаSO4*H2O гипс.
Обжигом гипса получают алебастр, который при смешивании с водой затвердевает, снова превращаясь в гипс, на чем основано его применение