
- •Дисциплина: Общая и неорганическая химия
- •1 Моль вещества э(эквивалента) - содержит 6,02*1023э(эквивалентов)
- •Объединенный газовый закон
- •Уравнение Клайперона-Менделеева
- •Закон Дальтона
- •3.Окислительно-восстановительные реакции. Степень окисления. Окислители, восстановители. Типы окислительно-восстановительных реакций
- •Основные положения теории о-в процессов:
- •Окислительно-восстановительные свойства элементов
- •Виды окислительно-восстановительных реакций
- •4. Растворы. Насыщенные и ненасыщенные растворы. Способы выражения содержания растворенного вещества в растворе (массовая и мольная доли; молярная, эквивалентная, моляльная концентрации; титр)
- •Способы выражения концентрации растворов
- •Теории растворов
- •5.Гидролиз растворов солей. Степень гидролиза и факторы, влияющие на нее. Типичные случаи гидролиза (показать на примерах).
- •Соль слабого основания и сильной кислоты (nh4no3, ZnCl2, Al2(so4)3)
- •6.Электролиз расплавов и растворов солей. Катодные и анодные процессы. Законы Фарадея.
- •Электролиз расплавов
- •Электролиз водных растворов
- •Законы электролиза
- •Выход по току
- •Координационная теория Вернера (1893 г.)
- •Номенклатура комплексных соединений
- •8. Строение атома. Квантовые числа. Принципы наименьшей энергии. Правило Клечковского, принцип Паули, правило Хунда. Составление электронных формул.
- •Строение атома по Бору (1913):
- •9.Периодический закон и система д.И. Менделеева
- •Структуры периодической системы:
- •Периодическая система и электронная структура атома
- •10. Типы химической связи (ковалентная , ионная, металлическая, водородная)
- •11. Химия элементов и их соединений I группа пс. Водород: особенности электронной структуры, изотопы. Получение и применение водорода и щелочных металлов. Получение и применение меди, серебра, золота.
- •Водород
- •Получение
- •Химические свойства водорода
- •Применение
- •Щелочные металлы
- •Медь, серебро и золото
- •Способы получения металлов d-элементов I группы:
- •Применение
- •12. II группа пс. Амфотерность бериллия и его соединений. Общая характеристика подгруппы d- элементов.
- •Соединения Ве и Mg
- •Щелочноземельные металлы
- •Цинк, кадмий и ртуть
- •13. Жесткость воды и способы ее устранения.
- •16. V группа пс. Особенности химической связи в молекуле азота. Важнейшие соединения азота (аммиак, оксиды азота, азотная и азотистая кислота и их соли). Взаимодействие азотистой кислоты с Ме и неМе.
- •17. Элементы 6 группы пс. Кислород: оксиды, пероксиды. Строение и свойства озона. Сера: оксиды, кислоты, соединения серы с Ме и неМе.
- •18. Свойства серной кислоты. Особенности взаимодействия разбавленной и концентрированной серной кислоты с Ме и неМе.
- •20. Элементы VII группы пс. Химические свойства галогенов: степени окисления, галогенводороды, соединения с кислородом, кислоты, содержащие хлор и их соли.
- •22. VIII группа пс. Подгруппа d- элементов: триоды элементов и их химические свойства. Оксиды, гидроксиды и комплексные соединения этих элементов.
11. Химия элементов и их соединений I группа пс. Водород: особенности электронной структуры, изотопы. Получение и применение водорода и щелочных металлов. Получение и применение меди, серебра, золота.
Металлы главной подгруппы I группы периодической системы объединены под общим названием «щелочные металлы», т.к. гидроксиды их главных представителей (натрия и калия) известны под названием «щелочи». Атомы этих элементов имеют один валентный электрон. По сравнению с элементами других подгрупп у них низкие потенциалы ионизации, а размеры атомов и ионов большие. С увеличением атомного номера в подгруппе возрастает размер атомов и уменьшается их энергия ионизации, что свидетельствует об усилении в ряду Li – Fr металлических признаков элементов.
Водород
Особенность строения электронной оболочки атома водорода, не позволяет однозначно решить в какой группе ПС он должен находиться.
Н – е- → Н+ восстановитель
Н + е- → Н- окислитель
Поэтому его помещают и в I и в VII группы, но прямым химическим аналогом не щелочных металлов, не галогенов – водород не является.
Водород имеет три изотопа
11Н протий - стабильный
21Н (D) дейтерий - стабильный
31Н (Т) тритий - радиоактивный
Получение
1) в лаборатории
а)взаимодействие металла с кислотой ( в аппарате Киппа)
Zn + 2HCl → ZnCl2 + H2↑
б)электролиз воды
2H2O→ 2H2↑ (катод) + О2 (анод)
2)Промышленный способ
а)электролиз растворов NaCl и KCl
2NaCl + 2H2O → H2↑ + 2NaOH + Cl2
б)конверсионный способ.
Сначала получают водяной газ, пропуская пары воды через раскаленный кокс - t=10000C
H2O(пар) + C(кокс) ⇄ H2 + CO (водный газ)
Далее водный газ с избытком водяных паров пропускают под нагретым катализатором
СО
+ (Н2)
+ Н2О
 CO2
+ (H2)
+ H2
CO2
+ (H2)
+ H2
очистка от СО2
Ca(OH)2 + (Н2) + СО2 → CaCO3↓ + H2O + (H2)↑
Таким способом получают более 50% водорода.
в)конверсией метана с водяным паром –самый дешевый способ, при t=13000C
CH4 + H2O(пар)  CO2 +
4H2
CO2 +
4H2
г)термическое разложение углеводородов
CH4  С +
2H2
С +
2H2
д) железо-паровой способ
2Fe
+ 3H2O(пар) 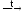 Fe2O3
+ 3H2
Fe2O3
+ 3H2
Химические свойства водорода
W(H)= +1, -1 степень окисления
Молекула водорода образована двумя атомами, связанными прочными ковалентными связями, поэтому химическая активность водорода при обычных температурах невелика.
1. с элементами главных подгрупп I и II групп образуют солеобразные гидриды.
2Na + H2 = 2NaH гидрид натрия
Са + Н2 = СаН2 гидрид кальция
Гидриды легко разлагаются водой и кислотами:
CaH2 + 2H2O → Ca(OH)2 + 2H2↑
NaH + НСl → NaCl + H2
2. с В и Ga, и со всеми элементами главных подгрупп IV – VII групп образует газообразные ковалентные соединения:
С +2Н2 = СН4
S + H2 = H2S
3. Водород горит в кислороде:
О2 + 2Н2 = 2Н2О
гремучий
газ
4.Водород хороший восстановитель, хорошо восстанавливает металлы из их оксидов:
CuO +
Н2  Cu + Н2O
Cu + Н2O
2BCl3 + 3H2 = 2B + 6HCl
Применение
Атомарный водород используется для атомно-водородной сварки.
Химическая промышленность: При производстве аммиака, метанола, мыла и пластмасс.
Пищевая промышленность: При производстве маргарина изжидких растительных масел. Зарегистрирован в качествепищевой добавкиE949. Входит в список пищевых добавок, допустимых к применению в пищевой промышленности РФ в качестве вспомогательного средства для производства пищевой продукции.
Авиационная промышленность: Водород очень лёгок и ввоздухевсегда поднимается вверх. Когда-тодирижаблиивоздушные шарынаполняли водородом. Но в 30-х гг. XX в. произошло несколькокатастроф, в ходе которых дирижабли взрывались и сгорали. В наше время дирижабли наполняют гелием, несмотря на его существенно более высокую стоимость.
Топливо: Водород используют в качестверакетного топлива. Ведутся исследования по применению водорода как топлива длялегковыхигрузовых автомобилей. Водородные двигатели не загрязняют окружающую среду и выделяют тольководяной пар. В водородно-кислородныхтопливных элементахиспользуется водород для непосредственного преобразования энергии химической реакции в электрическую.
