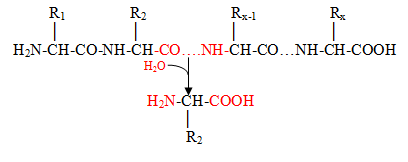
-
Жиры должны быть эмульгированы.
Расщепление триацилглицеролов (жиров) в желудке взрослого человека невелико. Вместе с тем его результаты важны для расщепления жиров в тонкой кишке. В результате гидролиза жиров в желудке при участии липазы, образуются свободные жирные кислоты. Соли жирных кислот являются активным эмульгатором жиров. Химус желудка, в составе которого находятся жирные кислоты, транспортируется в двенадцатиперстную кишку. При прохождении через двенадцатиперстную кишку химус перемешивается с жёлчью и с соком поджелудочной железы, содержащим липазу. В двенадцатиперстной кишке, кислотность химуса, обусловленная содержанием в нем соляной кислоты, нейтрализуется бикарбонатами сока поджелудочной железы и сока собственных желез (бруннеровы железы, duodenal glands, Brunner's glands, Brunner, Johann, 1653-1727, швейцарский анатом). При нейтрализации бикарбонаты разлагаются с образованием пузырьков углекислого газа. Это способствует перемешиванию химуса с пищеварительными соками. Образуется суспензия - разновидность раствора. Поверхность контакта ферментов с субстратом в суспензии увеличивается. Одновременно с нейтрализацией химуса и образованием суспензии происходит эмульгирование жиров. Небольшое количество свободных жирных кислот, образовавшихся в желудке под действием липазы, образуют соли жирных кислот. Они являются активным эмульгатором жиров. Кроме того, жёлчь, поступившая в двенадцатиперстную кишку и перемешанная с химусом, содержит натриевые соли жёлчных кислот. Соли жёлчных кислот, как и соли жирных кислот, растворимы в воде и являются еще более активным детергентом, эмульгатором жиров.
Желчные кислоты являются основным конечным продуктом метаболизма холестерина. В жёлчи человека больше всего содержатся: холевая кислота, дезоксихолевая кислота и хенодезоксихолевая кислота. В меньшем количестве в желчи человека содержатся: литохолевая кислота, а также аллохолевая и уреодезоксихолевая кислоты (стереоизомеры холевой и хенодезоксихолевой кислот). Жёлчные кислоты по большей части конъюгированы либо с глицином, либо с таурином. В первом случае они существуют в виде гликохолевой, гликодезоксихолевой, гликохенодезоксихолевой кислот (~65 ÷ 80% всех жёлчных кислот). Во втором случае они существуют в виде таурохолевой, тауродезоксихолевой и таурохенодезоксихолевойкислот (~20 ÷ 35% всех жёлчных кислот). Поскольку эти соединения состоят из двух компонентов - желчной кислоты и глицина или таурина, их иногда называют парными желчными кислотами. Количественные соотношения между разновидностями конъюгатов могут меняться в зависимости от состава пищи. Если в составе пищи преобладают углеводы, то доля глициновых конъюгатов больше. Если в составе пищи преобладают белки, то больше доля тауриновых конъюгатов.
Наиболее эффективное эмульгирование жиров происходит при комбинированном действии на капельки жира трех веществ: солей желчных кислот, ненасыщенных жирных кислот и моноацилглицеролов. При таком действии поверхностное натяжение частиц жира на разделе фаз жир/вода резко уменьшается. Крупные частицы жира распадаются на мельчайшие капельки. Мелкодисперсная эмульсия, содержащая указанную комбинацию эмульгаторов, очень стабильна, и укрупнения частичек жира не происходит. Совокупная поверхность капелек жира очень велика. Это обеспечивает большую вероятность взаимодействия жира с ферментом липазой и гидролиз жира. Основная масса пищевых жиров (ацилглицеролов) расщепляется в тонкой кишке при участии липазы сока поджелудочной железы. Панкреатическая липаза является гликопротеидом, легче всего расщепляющим эмульгированные триацилгицеролы в щёлочной среде ~рН 8 - 9. Как и все пищеварительные ферменты, панкреатическая липаза выводится в двенадцатиперстную кишку в виде неактивного профермента - пролипазы. Активация пролипазы в активную липазу происходит под действием жёлчных кислот и другого фермента сока поджелудочной железы - колипазы. При комбинации колипазы с пролипазой (в количественном соотношении 2:1) образуется активная липаза, участвующая в гидролизе эфирных связей триацилглицеролов. Продуктами расщепления триацилглицеролов являются диацилглицеролы, моноацилглицеролы, глицерин и жирные кислоты. Все эти продукты могут всасываться в тонкой кишке. Действие липазы на моноацилглицеролы облегчается при участии фермента сока поджелудочной железы моноглицеридной изомеразы. Изомераза модифицирует моноацилглицеролы. Она перемещает в них эфирную связь в положение, наиболее благоприятное для действия липазы, в результате которого образуются глицерол и жирные кислоты. Механизмы всасывания ацилглицеролов разного размера, а также жирных кислот с разной длиной углеродной цепи различны. См. в отдельном окне схему
Переваривание и всасывание липидов.
.
Липолиз – это гидролиз липидов. Липолитические ферменты – гидролазы, катализирующие гидролиз липидов. Липазы расщепляют триацилглицериды (жиры), фосфолипазы – фосфолипиды, холестеразы – эфиры холестерина.
Липолитические ферменты проявляют максимальную активность при рН= 7,8-8,2. В ротовой полости жиры не подвергаются химическим изменениям из-за отсутствия липолитических ферментов.
Воздействие на жиры липаз становится возможным после эмульгирования жиров, т.к. липиды нерастворимы в воде и они подвергаются воздействию липолитических ферментов только на границе разделе фаз и, следовательно, скорость переваривания зависит от площади этой поверхности. Эмульсия – это дисперсная система двух несмешивающихся жидкостей, из которых одна находится в раздробленном состоянии (в виде капелек) в массе другой. При эмульгировании жиров увеличивается их общая поверхность, что улучшает контакт жира с липазой и ускоряет его гидролиз. В организме основными эмульгаторами являются соли желчных кислот.
В желудке содержание липазы крайне низкое, кроме того, рН желудочного сока (1,0-1,5) не соответствует оптимуму рН липазы (5,5-7,5), и в желудке отсутствуют эмульгаторы жира, поэтому желудочная липаза может расщеплять только предварительно эмульгированные жиры (жиры молока или яичного желтка).
Отделом, в котором переваривается основная часть липидов, является тонкий кишечник, где имеется слабощелочная среда, оптимальная для активности липазы. Нейтрализация попавшей с пищей соляной кислоты осуществляется бикарбонатами, содержащимися в панкреатическом и кишечном соках. Поджелудочная железа и клетки слизистой оболочки кишечника секретируют липолитические ферменты. Поступающая в кишечник желчь содержит соли желчных кислот, эмульгирующие жир и повышающие активность липазы в 10-15 раз.
Основная масса липидов пищи представлена триацилглицеролами (жирами). Жиры гидролизуются липазой на 90-97 %, из них 40 % расщепляется на глицерин и жирные кислоты, остальная часть – до b (2)-моноглицеридов.

Панкреатическая липаза катализирует гидролиз эфирных связей только в a(1), a′(3)-положениях. В панкреатическом соке наряду с липазой содержится моноглицеридная изомераза − фермент, катализирующий внутримолекулярный перенос ацила из b(2)-положения моноглицерида в a(1)-положение. В процессе переваривания пищевых жиров при участии этого феремнта примерно треть b(2)-моноглицеридов превращается в a-моноглицериды, которые далее расщепляются под действием панкреатической липазы до глицерина и жирной кислоты. Полный гидролиз триацилглицеридов происходит постадийно.
Фосфолипиды гидролизуются при помощи фосфолипаз А1, А2, С и D, которые последовательно расщепляют молекулы с образованием глицерина, жирных кислот, фосфорной кислоты и азотистого основания.

Специфичность действия фосфолипаз: Х – азотистое основание; стрелки указывают гидролизуемую связь
Эфиры холестерина, поступающие с пищей, расщепляются на холестерин и жирные кислоты особым ферментом панкреатического и кишечного соков – холестеразой.
Липазы
Липазы (синоним стеапсины) — ферменты, отщепляющие от нейтральных жиров (триглицеридов) молекулы жирных кислот с образованием ди-, моноглицеридов и свободного глицерина. Основным источником Л., расщепляющих жиры пищи, является внешний секрет поджелудочной железы. Небольшое количество J1. выделяется также слизистой оболочкой тонкого кишечника. Оптимум рН этих Л. лежит между 7 и 8, т. е. соответствует рН секрета верхних отделов тонкой кишки. Их активность значительно повышается в присутствии катионов Са2 + , Mg2 + , солей желчных кислот и многих других факторов, повышающих степень эмульгирования жиров в кишечнике. В желудке небольшая активность Л. обнаруживается только у грудных детей, причем оптимум действия желудочной Л., в отличие от Л. поджелудочной железы и кишечника, лежит при рН=5. Некоторая активность Л., обнаруживаемая иногда в желудочном соке взрослых людей, по-видимому, обусловлена Л. забрасываемого в желудок кишечного сока. Действие Л. обратимо, и уже в кишечном соке частично происходит ресинтез из продуктов распада жиров моно- и диглицеридов. С большой интенсивностью ресинтез жиров происходит в кишечной стенке, в связи с чем в кровь из кишечника поступает только небольшое количество свободных жирных кислот. Активность Л. различных органов варьирует в значительных пределах и наиболее выражена в печени, легких и жировой ткани. В крови в норме активность Л. невелика, но резко возрастает при острых панкреатитах, при некротических процессах в печени и легких. При острых панкреатитах Л., проникающая из поджелудочной железы в кровь, может обусловить значительное расщепление жиров в жировых тканях и их некроз. Повышенная активность Л. в крови при острых панкреатитах наблюдается в течение довольно продолжительного периода (2—3 недели); поэтому ее определение более надежно подтверждает диагноз острого панкреатита, чем определение диастазы крови. Повышение содержания Л. в крови сопровождается обычно значительным увеличением ее выделения с мочой. См. также Пищеварение, Ферменты.
Несомненно, самым важным ферментом для переваривания триглицеридов является панкреатическая липаза, представленная в большом количестве в соке поджелудочной железы, достаточном для переваривания в течение 1 мин всех поступивших триглицеридов. Стоит добавить, что энтероциты тонкого кишечника тоже содержат немалое количество липазы, известной как кишечная липаза, но обычно она не используется. Конечные продукты переваривания жиров. Большинство триглицеридов пищи расщепляются панкреатической липазой на свободные жирные кислоты и 2-моноглицериды.
Формирование мицелл. Гидролиз триглицеридов — высокообратимый процесс, поэтому накопление моноглицеридов и свободных жирных кислот по соседству с перевариваемым жиром быстро блокирует дальнейшее его переваривание. Но желчные соли играют важную вспомогательную роль в практически моментальном извлечении моноглицеридов и свободных жирных кислот сразу после образования конечных продуктов переваривания. Происходит этот процесс следующим образом.
Желчные соли при их высокой концентрации в воде имеют предрасположенность формировать мицеллы, которые представляют собой сферические цилиндрические глобулы 3-6 нм в диаметре, состоящие из 20-40 молекул желчных солей. Каждая молекула содержит стероидное жирорастворимое ядро и водорастворимую полярную группу. Стероидное ядро включает продукты переваривания жира, формируя маленькую жировую каплю в середине итоговой мицеллы с полярной группой желчных солей, выходящей наружу и закрывающей поверхность мицеллы.
В связи с тем, что эти полярные группы имеют отрицательный заряд, они позволяют целой глобулярной мицелле растворяться в жидкой водорастворимой пищеварительной среде и сохранять стабильность раствора, пока жиры не всосутся в кровь.
Мицеллы желчных солей также выполняют функцию транспортных посредников для переноса моноглицеридов и свободных жирных кислот к щеточной каемке кишечного эпителия, иначе моноглицериды и свободные жирные кислоты будут нерастворимы. Здесь моноглицериды и свободные жирные кислоты всасываются в кровь (как будет изложено далее), а желчные соли высвобождаются обратно в химус, чтобы быть вновь использованными для процесса переноса. МЕТАБОЛИЗМ ЖЕЛЧНЫХ КИСЛОТ
За последние 20 лет получены новые данные, в свете которых необходимо пересмотреть и расширить представления о значении желчи и желчных кислот в организме человека. Совершенствование методов исследования позволило получить новые сведения о желчных кислотах, их метаболизме, кишечно-печеночном кругообороте, содержании в крови, тканях, желчи, способности к образованию комплексных соединений с липидами, белками и пигментами. Установлены новые факты, свидетельствующие о важном значении желчных кислот не только для деятельности желудочно-кишечного тракта, но и для функционирования систем дыхания и кровообращения. Обнаружено выраженное влияние желчных кислот на функциональное состояние различных отделов нервной системы. Выявлена роль желчных кислот как поверхностно-активных веществ внутренней среды организма, оказывающих влияние на мембранные процессы клеток и внутриклеточных структур. Желчные кислоты были открыты Штреккером в 1848 г.
Желчные кислоты представляют собой твердые порошкообразные вещества с высокой температурой плавления (от 134 до 223 °С), обладающие горьким вкусом, плохо растворимые в воде, лучше — в спиртовых и щелочных растворах. По химической структуре они принадлежат к группе стероидов и являются производными холановой кислоты (С24Н40О2). Все желчные кислоты образуются только в гепатоцитах из холестерина.
Среди желчных кислот человека различают первичные (холевая и хенодезоксихолевая, синтезируемые в печени) и вторичные (дезоксихолевая и литохолевая, образующиеся в тонкой кишке из первичных кислот под действием бактериальной микрофлоры кишечника). В желчи человека содержатся также аллохолевая и урсодезоксихолсвая кислоты — стереоизомеры соответственно холевой и хенодезоксихолевой кислот. В печени из холестерина образуются желчные кислоты. Эти стероидные соединения с 24 атомами углерода являются производные холановой кислоты, имеющими от одной до трех α-гидроксильных групп и боковую цепь из 5 атомов углерода с карбоксильной группой на конце цепи. В организме человека наиболее важна холевая кислота. В желчи при слабощелочном рН она присутствует в виде холат-аниона. Кроме холевой кислоты в желчи содержится также хенодезоксихолевая кислота. Она отличается от холевой отсутствием гидроксильной группы при С-12. Оба соединения принято называть первичными желчными кислотами. В количественном отношении это наиболее важные конечные продукты обмена холестерина. Другие две кислоты, дезоксихолевая и литохолевая, называются вторичными желчными кислотами, поскольку они образуются путем дегидроксилирования по С-7 первичных кислот в желудочно-кишечном тракте.
В физиологических условиях в желчи свободные желчные кислоты практически не встречаются, так как все они связаны в парные соединения с глицином или таурином –их так и называют конъюгированные желчные кислоты. Физиологическое значение конъюгатов желчных кислот заключается в том, что их соли являются более полярными, чем соли свободных желчных кислот, легче секретируются и имеют меньшую величину критической концентрации мицеллообразования.
В печени образуются конъюгаты желчных кислот с аминокислотами (глицином или таурином ),связанные пептидной связью. Эти конъюгаты являются более сильными кислотами и присутствуют в желчи в форме солей (холатов и дезоксихолатов Na+ и К+, называемых солями желчных кислот).
В связи с наличием в структуре α-гидроксильных групп желчные кислоты и соли желчных кислот являются амфифильными соединениями и обладают свойствами детергентов. Основные функции желчных кислот состоят в образовании мицелл, эмульгировании жиров и солюбилизации липидов в кишечнике. Это повышает эффективность действия панкреатической липазы и способствует всасыванию липидов.
На рисунке показано, как молекулы желчных кислот фиксируются на мицелле своими неполярными частями, обеспечивая ее растворимость. Липаза агрегирует с желчными кислотами и гидролизует жиры (триацилглицерины), содержащиеся в жировой капле.

Метаболические превращения желчных кислот
Первичные желчные кислоты образуются исключительно в цитоплазме клеток печени. Процесс биосинтеза начинается с гидроксилирования холестерина по С-7 и С-12, и эпимеризации по C-3, затем следует восстановление двойной связи в кольце В и укорачивание боковой цепи на три углеродных атома.
Лимитирующей стадией является гидроксилирование по С-7 с участием 7α-гидроксилазы. Холевая кислота служит ингибитором реакции, поэтому желчные кислоты регулируют скорость деградации холестерина.
Коньюгирование желчных кислот проходит в две стадии. Вначале образуются КоА-эфиры желчных кислот, а затем следует собственно стадия конъюгации с глицином или таурином (2) с образованием, например, гликохолевой и таурохолевой кислот. Желчь дренируется во внутрипеченочные желчные протоки и накапливается в желчном пузыре (3).
Кишечная микрофлора продуцирует ферменты, осуществляющие химическую модификацию желчных кислот (4). Во-первых, пептидная связь гидролизуется (деконьюгирование), и, во-вторых, за счет дегидроксилирования С-7 образуются вторичные желчные кислоты (5). Однако большая часть желчных кислот всасывается кишечным эпителием (6) и после попадания в печень вновь секретируется в составе желчи(энтерогепатическая циркуляция желчных кислот). Поэтому из 15-30 г солей желчных кислот, ежедневно поступающих в организм с желчью, в экскрементах обнаруживается только около 0,5 г. Это примерно соответствует ежесуточному биосинтезу холестерина de novo.
При неблагоприятном составе желчи отдельные компоненты могут кристаллизоваться. Это влечет за собой отложение желчных камней, которые чаще всего состоят из холестерина и кальциевых солей желчных кислот (холестериновые камни), но иногда эти камни включают и желчные пигменты.
Печень — единственный орган, способный превращать холестерин в гидроксилзамещенные холановые кислоты, так как ферменты, участвующие в гидроксилировании и конъюгации желчных кислот, находятся в микросомах и митохондриях гепатоцитов. Конъюгация желчных кислот, осуществляемая ферментным путем, происходит в присутствии ионов магния, АТФ, НАДФ, СоА. Активность этих ферментов изменяется соответственно колебаниям скорости циркуляции и состава пула желчных кислот в печени. Синтез последних контролируется механизмом отрицательной обратной связи, т. с. интенсивность синтеза желчных кислот в печени обратно пропорциональна току вторичных желчных кислот в печень. В нормальных условиях синтез желчных кислот в печени у человека низкий — от 200 до 300 мг в день. Преобразование холестерина в желчные кислоты происходит в результате окисления боковой цепи и кар-боксилирования С24~атома. Далее насыщается двойная связь между С4- и Сб-атомами. Оптическая конфигурация гидроксигруппы при Сз-атоме изменяется: переходит из /?-положения в -положение с введением двух гидроксильных групп. По-видимому, все микросо-мальные реакции гидроксилирования в биосинтезе желчных кислот требуют участия электронно-транспортной цепи, включающей ци-тохром-Р-450- и НАДФ-Н2-цитохром-Р~450-оксидоредуктазу.
Этапы, которые приводят к образованию холевой кислоты, отличаются от этапов образования хенодезоксихолевой кислоты. Фактически эти кислоты не превращаются одна в другую, во всяком случае у людей. Реакция процесса образования холевой и хенодезоксихолевой кислот определяется с помощью влияния на активность трех основных гидроксилаз, катализирующих гидроксилирование в 1а-, Ъх~ и С2б~положениях. Первая реакция на пути биосинтеза желчных кислот — гидроксилирование холестерина в1а-положении — является ступенью, ограничивающей скорость процесса в целом. В 1972 г. было показано существование циклических суточных колебаний активности клеточного ключевого фермента в биосинтезе желчных кислот — холестеринбиосинтезе желчных кислот — холестерин-7а-гидроксилазы, обусловленных изменениями синтеза самого фермента. Оказалось, что изменение скорости синтеза желчных кислот и холестерина в течение суток происходит одновременно с максимумом около полуночи. Время, необходимое для того, чтобы запасы холестерина уравновесились запасами холевой кислоты, равно 3—5 дням, а для дезоксихолевой кислоты — 6—10 дням. Это соответствует тому факту, что холевая кислота — прямой дериват холестерина, а дезоксихолевая кислота — производное холевой кислоты.
Синтезированные в гепатоцитах желчные кислоты экскретируются в желчь конъюгированными с глицином или таурином и по желчевыводящим путям поступают в желчный пузырь, где и накапливаются. В стенках желчного пузыря происходит всасывание незначительного количества желчных кислот — около 1, 3%. Натощак основной пул желчных кислот находится в желчном пузыре, а после стимуляции пищей желудка рефлекторно происходит сокращение желчного пузыря и желчные кислоты поступают в двенадцатиперстную кишку. Желчные кислоты ускоряют липолизис и усиливают солюбилизацию и абсорбцию жирных кислот и моногли-церидов. В кишечнике желчные кислоты под влиянием анаэробов в основной массе деконъюгируются и реабсорбируются, главным образом в дистальном отделе тонкой кишки, где и образуются вторичные желчные кислоты путем бактериального дегидроксили-рования из первичных. Из кишечника желчные кислоты с током портальной крови вновь попадают в печень, которая абсорбирует практически все желчные кислоты (примерно 99%) из портальной крови; совсем небольшое количество (около 1%) попадает в периферическую кровь. Вот почему, если имеется патология печени, ее способность абсорбировать желчные кислоты из портальной крови и экскретировать их в общий желчный проток может быть снижена. Таким образом, уровень желчных кислот в периферической крови будет повышаться. Значимость определения сывороточных желчных кислот заключается в том, что они, являясь индикаторами холестаза, могут быть у части больных показателем заболевания собственно печени — индикатором гепатодепрессии.
Установлено, что активное всасывание желчных кислот происходит в подвздошном отделе тонкой кишки, тогда как пассивная абсорбция идет за счет концентрации желчных кислот в кишечнике, поскольку она всегда выше, чем в портальной крови. При активной абсорбции всасывается основная масса желчных кислот, а на долю пассивной абсорбции выпадает всасывание незначительного количества. Всосавшиеся из кишечника желчные кислоты связываются с альбумином и по воротной вене транспортируются обратно в печень. В гепатоцитах токсичные свободные желчные кислоты, составляющие примерно 15% от всего количества желчных кислот, всосавшихся в кровь, превращаются в конъюгированные. Из печени желчные кислоты вновь поступают в желчь в виде конъюгатов. Подобная энтерогепатическая циркуляция в организме здорового человека совершается 2—6 раз в сутки в зависимости от режима питания; 10—15% от всех поступивших в кишечник желчных кислот после деконъюгации подвергаются более глубокой деградации в нижних отделах тонкой кишки. В результате процессов окисления и восстановления, вызываемых ферментами микрофлоры толстой кишки, происходит разрыв кольцевой структуры желчных кислот, что приводит к образованию ряда веществ, выделяемых с фекалиями во внешнюю среду. У здорового человека около 90% фекальных желчных кислот составляют вторичные, т. е. литохолевая и дезок-сихолевая кислоты. При использовании меченых желчных кислот доказано, что лишь незначительное их количество может быть обнаружено в моче.
Желчные кислоты в организме человека выполняют различные функции, основные из них — участие во всасывании жиров из кишечника, регуляция синтеза холестерина и регуляция желчеобразования и желчевыделения.
Желчные кислоты играют важную роль в переваривании и всасывании липидов. В тонкой кишке конъюгированные желчные кислоты, являясь поверхностно-активными веществами, адсорбируются в присутствии свободных жирных кислот и моноглицеридов на поверхности капелек жира, образуя при этом тончайшую пленку, препятствующую слиянию мельчайших капелек жира в более крупные. При этом происходит резкое снижение поверхностного натяжения на границе двух фаз — воды и жира, что приводит к образованию эмульсии с размерами частиц 300—1000 ммк и мицелярного раствора с размерами частиц 3—30 ммк. Образование мицеллярных растворов облегчает действие панкреатической липазы, которая при воздействии на жиры расщепляет их на глицерин, легко всасывающийся кишечной стенкой, и жирные кислоты, нерастворимые в воде. Желчные кислоты, соединяясь с последними, образуют холеиновые кислоты, хорошо растворимые в воде и поэтому легко всасывающиеся кишечными ворсинками в верхних отделах тонкой кишки. Холеиновые кислоты в виде мицелл всасываются из просвета подвздошной кишки внутрь клеток, сравнительно легко проходя мембраны клеток. Электронно-микроскопические исследования показали, что в клетке связь желчных и жирных кислот распадается: желчные кислоты попадают через портальную вену в кровь и печень, а жирные кислоты, накапливаясь внутри цитоплазмы клеток в виде гроздьев мельчайших капель, являются конечными продуктами всасывания липидов.
Вторая существенная роль желчных кислот — регуляция синтеза холестерина и его деградации. Скорость синтеза холестерина в тонкой кишке зависит от концентрации желчных кислот в просвете кишки. Основная часть холестерина в организме человека образуется путем синтеза, а незначительная часть поступает с пищей. Таким образом, влияние желчных кислот на обмен холестерина заключается в поддержании его баланса в организме. Желчные кислоты сводят к минимуму нарастание или недостаток холестерина в организме.
Разрушение и выброс части желчных кислот представляют важнейший путь экскреции конечных продуктов холестерина. Холевые кислоты служат регулятором метаболизма не только холестерина, но и других стероидов, в частности гормонов.
Физиологической функцией желчных кислот является участие в регуляции экскреторной функции печени. Желчегонное свойство желчных кислот, подтвержденное многими авторами, используется
для введения их в состав желчегонных средств (дехолин, аллохол и др.). Желчные соли действуют как физиологические слабительные, усиливая перистальтику кишечника. Этим действием холатов объясняются внезапные поносы при поступлении в кишечник больших количеств концентрированной желчи, например при гипомоторной дискинезии желчных путей. При забрасывании желчи в желудок может развиваться гастрит.
В настоящее время широко используется метод радиоиммунного исследования конъюгированных желчных кислот в сыворотке крови человека. Этот метод стал применяться для количественного определения тотально циркулирующего в сыворотке крови человека холилглицина и сульфолитохолилглицина. Содержание желчных кислот в сыворотке крови является очень чувствительным показателем дисфункции гепатоцитов. Желчные кислоты являются основными маркерами холестаза у больных с патологией гепатобилиарного тракта.
Определение концентраций желчных кислот в сыворотке крови больных в условиях терапевтического стационара является важным диагностическим критерием в оценке активности и тяжести патологического процесса в паренхиме печени и позволяет в наиболее ранние сроки начать необходимую терапию.
Состав печеночной и пузырной желчи у человека (по А. Фишеру)
|
Наименование |
Печеночная желчь, г/л |
Пузырная желчь, Г/Л |
|
Сухое вещество |
23-33 |
180 |
|
Азот |
0,8 |
4,9 |
|
Холин |
0,4-0,9 |
5,5 |
|
Желчные кислоты |
7-14 |
115 |
|
Жирные кислоты |
1,6-3,4 |
24 |
|
Лецитин |
1,0-5,8 |
35 |
|
Холестерин |
0,8—2,1 |
4,3 |
|
Белок |
1,4-2,7 |
4,5 |
|
Билирубин |
0,3—0,6 |
1,4 |
Сокращение желчного пузыря обусловлено раздражением парасимпатических веточек, они же вызывают расслабление сфинктера Одди. Симпатический нерв вызывает сокращение сфинктера Одди и расслабление пузырной мускулатуры. Следовательно, он обеспечивает депонирующую функцию желчного пузыря в то время, как парасимпатический нерв — эвакуаторную. Кроме того, определенное значение в опорожнении желчного пузыря, по-видимому, играет холецистокинин — фермент двенадцатиперстной кишки. Регуляция желчеобразования и желчевыведения. Желчеобразование в печени происходит непрерывно. Под влиянием условных и безусловных раздражителей во время приема пищи образование желчи усиливается. Продолжительность латентного периода секретного рефлекса варьирует от 3 до 12 мин. После приема пищи темпы желчеобразования возрастают и достигают максимума при переваривании углеводистой пищи через 2—3 ч, белковой — через 3 ч, жирной — через 5—7 ч. Это зависит от продолжительности пребывания пищевых веществ в желудке, кислотности порций желудочного содержимого, поступающего в двенадцатиперстную кишку, образования эндокринными клетками слизистой оболочки желудка и кишки гастроинтестинальных гормонов (гастрина, секретина, холецистокинина-панкреозимина, глюкагона), которые стимулируют желчеобразование. Рефлекторные стимулирующие влияния на желчеобразование реализуются через блуждающий нерв в ответ на раздражение рецепторов всех отделов пищеварительного тракта, а тормозные — через симпатические нервы. При отсутствии процесса пищеварения (натощак) желчь поступает в желчный пузырь, потому что сфинктеры Мирицци (препятствующий поступлению желчи из общего желчного протока в проток желчного пузыря) и Люткинса (в шейке желчного пузыря) находятся в расслабленном состоянии, а сфинктер Одди — в сокращенном. Емкость желчного пузыря у взрослого человека равна 50—60 мл, но за счет сгущения желчи резервируется ее объем, выделенный печенью за 12—14 ч. Начинается желчевыведение в ответ на комплекс условных и безусловных раздражителей, связанных с приемом пищи. Реализуется этот рефлекс через эфферентные волокна блуждающего нерва, возбуждение которых стимулирует моторику желчного пузыря и общего желчного протока, но расслабляет сфинктер Одди. Продолжается желчевыведение от 3 до 6 ч. Оно обусловлено не только раздражением рецепторов желудка и двенадцатиперстной кишки химусом, но и влиянием на мускулатуру желчевыводящего аппарата гастроинтестинальных гормонов (гастрина, секретина, холецистокинина-панкреозимина, бомбезина), вырабатываемых эндокринными клетками желудка и двенадцатиперстной кишки под влиянием химуса. Наибольший сокогонный эффект наблюдается после приема молока, яичных желтков, жиров и мяса. Раздражение симпатических нервов вызывает расслабление мышц желчного пузыря, общего желчного протока и сокращение сфинктера Одди, что приводит к уменьшению и прекращению выделения желчи в двенадцатиперстную кишку. Торможение желчевыведения наблюдается также под влиянием ВИП, глюкагона и кальцитонина.
Вода и щелочи вызывают расслабление желчного пузыря. Процесс еды, а также жиры, продукты переваривания белков стимулируют сократительную функцию желчного пузыря. Уровень желчеобразования контролируется симпатической и парасимпатической нервной системой (хотя данные по этому поводу противоречивы) и, по всей вероятности, гормональными влияниями с двенадцатиперстной кишки. Желчеобразование стимулирует также сама желчь, которая, всасываясь
Состав желчи. Свойства желчи. Печеночная желчь. Пузырная желчь. За сутки у человека образуется 0,6—1,5 л желчи. Печеночная желчь, заполняющая желчные протоки, поступая в желчный пузырь, изменяется по своему составу. Эпителиальные клетки слизистой оболочки желчного пузыря осуществляют активную реабилитацию Na+ из его содержимого, что является причиной реабсорбции анионов Сl, HCO3 и воды. Это приводит к сгущению пузырной желчи и уменьшению ее рН (с 7,3—8,0 до 6,5). Печеночная и пузырная желчь, Регуляция желчеобразования. Регуляция желчевыведения. Желчеобразование в печени происходит непрерывно. Под влиянием условных и безусловных раздражителей во время приема пищи образование желчи усиливается. Продолжительность латентного периода секретного рефлекса варьирует от 3 до 12 мин. После приема пищи темпы желчеобразования возрастают и достигают максимума при переваривании углеводистой пищи через 2—3 ч, белковой — через 3 ч, жирной — через 5—7 ч. Это зависит от продолжительности пребывания пищевых веществ в желудке, кислотности порций желудочного содержимого, поступающего в двенадцатиперстную кишку, образования эндокринными клетками слизистой оболочки желудка и кишки гастроинтестинальных гормонов (гастрина, секретина, холецистокинина-панкреозимина, глюкагона), которые стимулируют желчеобразование. Рефлекторные стимулирующие влияния на желчеобразование реализуются через блуждающий нерв в ответ на раздражение рецепторов всех отделов пищеварительного тракта, а тормозные — через симпатические нервы. При отсутствии процесса пищеварения (натощак) желчь поступает в желчный пузырь, потому что сфинктеры Мирицци (препятствующий поступлению желчи из общего желчного протока в проток желчного пузыря) и Люткинса (в шейке желчного пузыря) находятся в расслабленном состоянии, а сфинктер Одди — в сокращенном. Емкость желчного пузыря у взрослого человека равна 50—60 мл, но за счет сгущения желчи резервируется ее объем, выделенный печенью за 12—14 ч. Начинается желчевыведение в ответ на комплекс условных и безусловных раздражителей, связанных с приемом пищи. Реализуется этот рефлекс через эфферентные волокна блуждающего нерва, возбуждение которых стимулирует моторику желчного пузыря и общего желчного протока, но расслабляет сфинктер Одди. Продолжается желчевыведение от 3 до 6 ч. Оно обусловлено не только раздражением рецепторов желудка и двенадцатиперстной кишки химусом, но и влиянием на мускулатуру желчевыводящего аппарата гастроинтестинальных гормонов (гастрина, секретина, холецистокинина-панкреозимина, бомбезина), вырабатываемых эндокринными клетками желудка и двенадцатиперстной кишки под влиянием химуса. Наибольший сокогонный эффект наблюдается после приема молока, яичных желтков, жиров и мяса. Раздражение симпатических нервов вызывает расслабление мышц желчного пузыря, общего желчного протока и сокращение сфинктера Одди, что приводит к уменьшению и прекращению выделения желчи в двенадцатиперстную кишку. Торможение желчевыведения наблюдается также под влиянием ВИП, глюкагона и кальцитонина.
поступив в двенадцатиперстную кишку, принимает участие в пищеварении. Это выражается в следующем. Снижая кислотность поступившего в кишку желудочного содержимого, желчь прекращает действие пепсинов и создает среду для проявления активности ферментов поджелудочного сока. За счет солей желчных кислот происходит эмульгирование жиров, крупные капли которых распадаются на мелкие капельки, резко увеличивающие площадь соприкосновения с липазой панкреатического сока и эффективность гидролиза жиров. Около 7—20 % желчных кислот выводится из организма с калом, большая часть всасывается в подвздошной кишке в кровь воротной вены, откуда гепатоциты повторно извлекают желчные кислоты. Желчные кислоты способствуют всасыванию жирных кислот и жирорастворимых витаминов (D, Е, К). Желчь является возбудителем моторики кишечника и кишечных ворсинок, стимулирует пролиферацию энтероцитов, угнетает развитие кишечной микрофлоры и предотвращает гнилостные процессы в толстом кишечнике.
Источник: http://meduniver.com/Medical/Physiology/136.html MedUniver
Жёлчь
(bilis) — биологическая жидкость, вырабатываемая печенью
.
За сутки в норме выделяется 500—1400 мл желчи. Цвет жёлчи варьирует от золотисто-желтого до темно-оливкового (пузырная желчь). Она прозрачная, слегка вязкой (за счет примеси слизистого секрета эпителия желчных путей) консистенции; пузырная жёлчь более вязкая. Относительная плотность колеблется в различных порциях от 1007 до 1034. Горький вкус жёлчи обусловлен наличием в ней солей желчных кислот. Пузырная жёлчь имеет более кислую реакцию (рН = 6,5—7,3), чем печеночная (рН = 7,5—8,2), при воспалительных процессах в желчном пузыре рН желчи снижается до 4,0—4,5.
Желчь представляет собой водный раствор различных ингредиентов, обладающий свойствами коллоидного раствора. Основными компонентами желчи являются желчные кислоты (холевая и в небольшом количестве дезоксихолевая), фосфолипиды, желчные пигменты, холестерин; в ее состав входят также жирные кислоты, белок, бикарбонаты, натрий, калий, кальций, хлор, магний, йод, незначительное количество марганца, а также витамины, гормоны, мочевина, мочевая кислота, ряд ферментов и др. В пузырной жёлчи концентрация многих компонентов в 5—10 раз выше, чем в печеночной. Так, концентрация холестерина настолько велика, что только благодаря присутствию желчных кислот он не выпадает в осадок. Однако концентрация ряда компонентов, например натрия, хлора, бикарбонатов, в связи с их всасыванием в желчном пузыре значительно ниже; альбумин, присутствующий в печеночной желчи, в пузырной вовсе не обнаруживается.
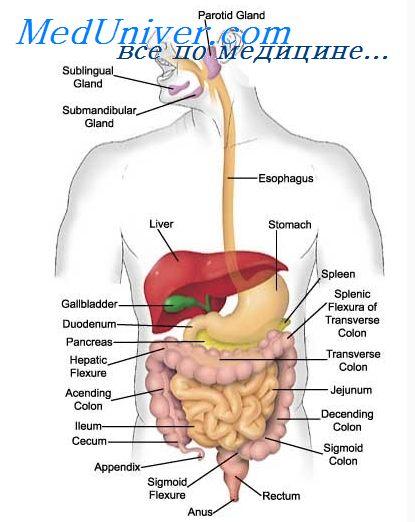
Желчь образуется в гепатоцитах. В гепатоците различают два полюса: васкулярный, осуществляющий с помощью микроворсинок захват веществ извне и введение их в клетку, и билиарный, где происходит выделение веществ из клетки. Микроворсинки билиарного полюса гепатоцита образуют истоки желчных канальцев (капилляров), стенки которых образованы мембранами двух и более смежных гепатоцитов. Желчные канальцы, сливаясь друг с другом на периферии печеночной дольки, формируют более крупные желчные ходы — перилобулярные желчные проточки, выстланные эпителием и гепатоцитами. Перилобулярные желчные проточки впадают в междольковые желчные протоки, выстланные кубическим эпителием. Анастомозируя между собой и увеличиваясь в размерах, они образуют крупные септальные протоки, окруженные фиброзной тканью портальных трактов и сливающиеся в долевые левый и правый печеночный протоки. На нижней поверхности печени в области поперечной борозды левый и правый печеночный протоки соединяются и формируют общий печеночный проток. Последний, сливаясь с пузырным протоком, впадает в общий желчный проток, открывающийся в просвет двенадцатиперстной кишки в области большого сосочка двенадцатиперстной кишки, или фатерова соска.
Образование желчи начинается с секреции гепатоцитами воды, билирубина, желчных кислот, холестерина, фосфолипидов, электролитов и других компонентов. Секретирующий аппарат гепатоцита представлен лизосомами, пластинчатым комплексом, микроворсинками и желчными канальцами. Секреция осуществляется в зоне микроворсинок. Билирубин, желчные кислоты, холестерин и фосфолипиды, главным образом лецитин, выделяются в виде специфического макромолекулярного комплекса — желчной мицеллы. Соотношение этих четырех основных компонентов, достаточно постоянное в норме, обеспечивает растворимость комплекса. Кроме того, малая растворимость холестерина значительно увеличивается в присутствии солей желчных кислот и лецитина. Нарушение определенного соотношения основных компонентов жёлчи , необходимого для достаточной их растворимости, может стать причиной патологического процесса в желчном пузыре и желчных путях; холестерин, выпадая в осадок, способствует образованию камней.
В механизме желчеобразования имеют значение явления диффузии (при прохождении по желчным ходам образовавшейся в гепатоците так называемой первичной желчи между ней и плазмой крови устанавливается равновесие электролитов), а также активный и пассивный транспорт из крови глюкозы, электролитов, креатинина, витаминов, гормонов и др. и обратное всасывание в кровь из желчных протоков и желчного пузыря воды и некоторых веществ. Энергия, необходимая для секреции желчи , образуется за счет тканевого дыхания клеток печени и связанного с ним окислительного фосфорилирования.
Несмотря на то, что выработка жёлчи происходит непрерывно, интенсивность желчеобразования в течение суток колеблется. Усилению желчеобразования способствуют некоторые виды пищи (например, жиры), соляная кислота желудочного сока, гастрин, секретин, холецистокинин-панкреозимин, а также возбуждение блуждающего нерва. Ослабление желчеобразования отмечается при голодании, перегревании или переохлаждении организма. Регулятором секреции жёлчи является также печеночно-кишечная циркуляция ее компонентов. Чем больше желчных кислот поступает из тонкой кишки в кровь воротной вены, тем меньше их синтезируется гепатоцитами, и, наоборот, при уменьшении поступления желчных кислот в кровь усиливается их синтез в печени.
Поступление желчи в двенадцатиперстную кишку происходит периодически. Движение жёлчи обусловлено неодинаковым давлением в разных отделах желчевыделительной системы и двенадцатиперстной кишке. Уровень давления в желчных путях зависит от степени заполнения их желчью, сокращения гладких мышц желчных протоков и желчного пузыря, а также от тонуса мышц сфинктеров — физиологического сфинктера, соответствующего области слияния пузырного и общего желчного протоков, сфинктера, расположенного в шейке желчного пузыря и сфинктера концевого отдела общего желчного протока (сфинктера Одди). Сокращение мышц регулируется нервными и гуморальными механизмами. Давление в общем желчном протоке и в желчном пузыре вне пищеварения равно соответственно -1—300 мм вод. ст. и 6—185 мм вод. ст., поступление желчи в двенадцатиперстную кишку вне пищеварения ограничено. Во время пищеварения за счет сокращения желчного пузыря давление поднимается до 200—300 мм вод. ст., обеспечивая выход желчи. Первой в двенадцатиперстную кишку поступает желчь, находившаяся в общем желчном протоке, затем пузырная желчь, далее желчь из печеночных протоков и печени. Поступление жёлчи в кишечник происходит при перистальтических движениях гладких мышц желчных протоков, сокращении желчного пузыря, расслаблении сфинктера Одди. Тонус мышц и перистальтика желчных путей и желчного пузыря регулируются блуждающим и симпатическими нервами. Желчевыделение осуществляется также благодаря условным и безусловным рефлексам с участием многочисленных рефлексогенных зон, в т. ч. рецепторов полости рта, желудка и двенадцатиперстной кишки. Сильное стимулирующее действие на желчевыделение оказывают яичные желтки, молоко, мясо, жиры, некоторые лекарственные средства. Регуляция желчевыделения осуществляется также гуморальным путем. Так, гастрин кроме своей основной функции — стимулирования выделения соляной кислоты в желудке снижает тонус мышц сфинктера Одди; холецистокининпанкреозимин вызывает сокращение желчного пузыря; секретин усиливает его сокращение.
Физиологическая роль жёлчи связана главным образом с процессом пищеварения. Наиболее важное значение для пищеварения имеют желчные кислоты, стимулирующие секрецию поджелудочной железы и обладающие эмульгирующим действием на жиры, что необходимо для их переваривания панкреатической липазой. Жёлчь нейтрализует кислое содержимое желудка, поступающее в двенадцатиперстную кишку; белки жёлчи способны связывать пепсин. С желчью экскретируются и чужеродные вещества, например некоторые лекарственные средства (алкалоиды, салицилаты, сульфаниламиды и др.). Выделение с жёлчью йодистых соединений используется в рентгенологической диагностике заболеваний желчного пузыря и желчных путей.
Изменение химического состава жёлчи , нарушение желчеобразования или желчевыделения могут быть связаны с разными патологическими процессами. При инфекционных и токсических повреждениях печени нарушаются процессы связывания билирубина с глюкуроновой кислотой и выделения его в желчь, что приводит к развитию желтухи. При холестазе, даже в случае ненарушенной функции печеночных клеток, билирубинглюкуронид не может экскретироваться в кишечник, что также приводит к попаданию его из желчи в кровь и развитию желтухи. Секреция жёлчи и образование желчной мицеллы могут быть нарушены в результате нарушения гормональной регуляции холестерине- и фосфолипидогенеза, что наблюдается при беременности, в менопаузе, приеме некоторых гормональных препаратов и др. При воспалительном процессе в желчном пузыре и изменении рН снижаются защитные свойства коллоидных структур, изменяются физико-химические свойства желчи (так называемое предкаменное состояние), что в последующем приводит к образованию первичных центров кристаллизации и формированию камней.
Значительное увеличение количества выделяемой жёлчи наблюдается при гипомоторной дискинезии желчных путей, атонии желчного пузыря. Уменьшение выделения жёлчи вплоть до полного его прекращения характерно для закупорки желчных путей, уменьшение количества пузырной желчи отмечается при гипермоторной дискинезии желчных путей (см. Желчнокаменная болезнь).
Исследование желчи (определение ее количества, физико-химических свойств, микроскопию и др.) проводят с помощью дуоденального зондирования. ЖЁЛЧЬ, жидкий секрет, непрерывно вырабатываемый железистыми клетками печени позвоночных. Различают печёночную желчь, выделяющуюся непосредственно в кишечник независимо от пищеварения (слегка вязкая золотисто-жёлтая), и пузырную желчь, скапливающуюся в жёлчном пузыре (вязкая жёлто-бурая или зелёная) и попадающую в кишечник по мере поступления туда пищи. Основные составные части желчи вода, соли жёлчных кислот, жёлчные пигменты, холестерин, неорганические соли. Из ферментов в желчи обнаружены фосфатазы, из гормонов — тироксин. Печёночная и пузырная желчи несколько различаются (например, у человека рН соответственно 8—8,6 и 7—7,6). В кишечнике желчь способствует расщеплению, омылению, эмульгированию и всасыванию жиров, усиливает перистальтику. Поступление пузырной желчи в кишечник регулируется также гормонами (секретином, холецистокинином); кроме того, жировые вещества стимулируют сокращение жёлчного пузыря и его опорожнение. Печень взрослого человека выделяет за сутки 1,5—2 л желчи. Препараты из желчи применяют в медицине.
Желчь (лат. bilis, ) — жёлтая, коричневая или зеленоватая, горькая на вкус, имеющая специфический запах, выделяемая печенью, накапливаемая в жёлчном пузыре жидкость.
Секреция жёлчи производится гепатоцитами — клетками печени. Жёлчь собирается в жёлчных протоках печени, а оттуда, через общий жёлчный проток поступает в жёлчный пузырь и в двенадцатиперстную кишку, где участвует в процессах пищеварения.
Жёлчный пузырь выполняет роль резервуара, использование которого позволяет снабжать двенадцатиперстную кишку максимальным количеством жёлчи во время активной пищеварительной фазы, когда кишка наполняется частично переваренной в желудке пищей. Жёлчь, выделяемая печенью (часть её направляется непосредственно в двенадцатиперстную кишку), называют «печёночной» (или «молодой»), а выделяемую жёлчным пузырём — «пузырной» (или «зрелой»).
У человека за сутки образуется 1000-1800 мл желчи (около 15 мл на 1 кг массы тела). Процесс образования желчи — желчеотделение (холерез) — осуществляется непрерывно, а поступление желчи в двенадцатиперстную кишку -желчевыделение (холекинез) - периодически, в основном в связи с приемом пищи. Натощак в кишечник желчь почти не поступает, она направляется в желчный пузырь, где при депонировании концентрируется и несколько изменяет свой состав, поэтому принято говорить о двух видах желчи — печеночной и пузырной
Состав желчи (г/л) 500-1000л
|
Составная часть |
Печеночная желчь |
Пузырная желчь |
|
Азот |
0,8 |
4,9 |
|
Холин |
0,4—0,9 |
5,5 |
|
Суточное количество |
7—14 |
115 |
|
Лецитин |
1,0—5,8 |
35 |
|
Холестерин |
0,8—2,1 |
4,3 |
|
Белок |
1,4—2,7 |
4,5 |
|
Билирубин |
0,3—0,6 |
1,4 |
|
?—Амилаза |
6—16 г крахмала/(мл•ч) |
1,67—4,45 мг/(л.с) |
|
|
|
|
|
|
|
|
|
|
|
|
В настоящее время пищевой и биологической полноценности продуктов, в том числе животного происхождения, уделяется значительное внимание со стороны их производителей, а также потребителей готовой продукции. Учитывая, что на данном этапе, в нашей стране велик процент импортного мяса используемого при производстве различных мясных изделий, его оценка с точки зрения биохимической ценности, в том числе в сравнительном аспекте с отечественным сырьем, является чрезвычайно интересной.
Было исследовано по 10 образцов импортного и отечественного мяса, каждого из видов (табл. 1). Полученные сведения указывают на следующие тенденции. Так, в случае с говядиной образцы отечественного мяса содержали больше аминокислот в отличие от импортных аналогов в диапазоне от 40%
Мясо и мясопродукты должны составлять значительную долю в рационе питания человека. Это связано с тем, что именно они являются основными источниками биологически полноценных белков, жиров, углеводов, а также целого комплекса минеральных веществ, витаминов и экстрактивных веществ, необходимых для успешного функционирования организма.
В настоящее время пищевой и биологической полноценности продуктов, в том числе животного происхождения, уделяется значительное внимание со стороны их производителей, а также потребителей готовой продукции. Учитывая, что на данном этапе, в нашей стране велик процент импортного мяса используемого при производстве различных мясных изделий, его оценка с точки зрения биохимической ценности, в том числе в сравнительном аспекте с отечественным сырьем, является чрезвычайно интересной.
Основываясь на этом нами, в условиях Воронежской областной ветеринарной лаборатории была проведена работа по определению аминокислотного состава мяса говядина и свинина, отечественных и импортных поставщиков. Исследования проводились с использованием автоматического аминокислотного анализатора ААА - 400 (Ingos). Условия хроматографического разделения и детектирования были следующие:
1) хроматографическая колонка - сорбент Ostion Ingos
2) подвижная фаза - комбинация 4 цитратных буферов с рН 2,7 - 8,0;
3) регенерация колонки с рН 14,0;
4) постколоночная дериватизация аминокислот нингидрином в реакторе с образованием хромофорных комплексных соединений, обладающих максимумом светопоглощения в видимой области электромагнитного спектра;
5) 2-х канальное фотометрическое детектирование при 570 нм;
6) автоматическое управление многостадийным хроматографическим анализом проводилось с использованием программного пакета Chromulan 0,82 Ingos;
7) чувствительность метода 5-10-11 моль при соотношении сигнал/шум 5.
Было исследовано по 10 образцов импортного и отечественного мяса, каждого из видов (табл. 1). Полученные сведения указывают на следующие тенденции. Так, в случае с говядиной образцы отечественного мяса содержали больше аминокислот в отличие от импортных аналогов в диапазоне от 40%
Таблица 1
|
Показатель, г/100 г мяса |
Говядина |
Свинина |
||
|
Импорт |
Российская |
Импорт |
Российская |
|
|
Аспарагин |
1,6 |
1,7 |
1,8 |
2,0 |
|
Треонин |
0,6 |
1,0 |
1,3 |
1,3 |
|
Серин |
0,6 |
0,4 |
0,5 |
0,8 |
|
Глутамин |
2,3 |
2,5 |
2,8 |
3,2 |
|
Пролин |
0,6 |
0,9 |
0,7 |
0,7 |
|
Глицин |
1,1 |
1,8 |
1,0 |
0,9 |
|
Аланин |
1,0 |
1,2 |
1,1 |
1,2 |
|
Валин |
0,8 |
0,8 |
0,9 |
1,1 |
|
Метионин |
0,3 |
0,3 |
0,4 |
0,4 |
|
Изолейцин |
0,7 |
0,7 |
0,8 |
1,0 |
|
Лейцин |
1,0 |
1,2 |
1,5 |
1,8 |
|
Тирозин |
0,4 |
0,4 |
0,5 |
0,6 |
|
Фенилаланин |
0,6 |
0,6 |
0,7 |
0,9 |
|
Гистидин |
0,5 |
0,7 |
0,6 |
1,0 |
|
Лизин |
1,3 |
1,4 |
1,6 |
2,0 |
|
Аргинин |
1,3 |
1,3 |
1,4 |
1,6 |
|
Цистин |
0,2 |
0,2 |
0,2 |
0,2 |
|
Триптофан |
0,2 |
0,3 |
0,2 |
0,3 |
Аминокислотный состав мяса

Аминокислотный состав пищи
Белки пищевых продуктов по своему составу весьма разнообразны и их пищевая ценность зависит от количества и соотношений входящих в их состав аминокислот. В организме человека, в его пищеварительном (желудочно-кишечном) тракте белки пищевых продуктов расщепляются на свои составные части — аминокислоты. Аминокислоты поступают в кровь, разносятся ею по всем тканям и используются для синтеза белка данного организма. Известен ряд аминокислот, которые относятся к числу так называемых незаменимых. Их назвали так в связи с тем, что они не синтезируются в организме и обязательно должны доставляться с пищей.
В настоящее время к жизненно необходимым (незаменимым) аминокислотам относятся лизин, гистидин, триптофан, фенилаланин, лейцин, изолейцин, метионин, треонин, валин и аргинин. Каждая из этих аминокислот играет в организме определенную роль. Аргинин, например, участвует в процессе образования мочевины. Лизин и триптофан необходимы для роста и развития молодых организмов; триптофан играет также существенную роль в синтезе гемоглобина крови. Цистин и метионин необходимы организму для синтеза белков кожных покровов, некоторых гормонов и витаминов. Метионин, кроме того, участвует в процессах обмена жиров и, следовательно, относится к числу так называемых липотропных факторов, которые предупреждают жировое перерождение тканей печени, а в случае его появления оказывают лечебное действие, устраняют этот процесс. Метионин в большом количестве содержится в твороге; это и обусловливает широкое применение творога в лечебном питании при заболевании печени. Необходимо отметить, что не все продукты содержат в достаточном количестве незаменимые аминокислоты и, следовательно, не все белки обладают высокой биологической ценностью. Белки продуктов животного происхождения — мяса, рыбы, молока, яиц и т. д. — обладают высокой биологической ценностью, в то время как некоторые белки растительного происхождения, например пшена, кукурузы, ржаного хлеба, не содержат ряда незаменимых аминокислот и в связи с этим имеют более низкую биологическую ценность. Чем разнообразнее питание, тем более полно обеспечивается организм необходимыми ему аминокислотами. Рекомендуется, чтобы в рационе питания около 50% потребных человеку белков обеспечивалось за счет продуктов животного происхождения. Однако и белки продуктов животного происхождения обладают неодинаковой ценностью. Например белки дичи, телятины и большинства субпродуктов содержат значительное количество триптофана. Кроме того, в белках телятины и ветчины имеется много лизина. Белки мышечной ткани некоторых рыб—судака, трески, килек, лососины, осетрины,сома— более богаты метионином, чем рыбы других пород. По сравнению с мясом белки рыбы содержат больше триптофана (особенно соленые сельди), лизина и цистина, но меньше гистидина. Наиболее полноценный аминокислотный состав имеют белки куриного яйца (желтка) и молока (творог, сыр). Высокой биологической ценностью обладают также белки многих продуктов растительного происхождения— картофеля, капусты, риса и особенно сои. Меньшую питательную ценность представляют белки гороха и некоторых круп. При построении рационов питания необходимо правильно подбирать пищевые продукты, учитывая их аминокислотный состав. Продукты растительного происхождения надо комбинировать с продуктами животного происхождения. Например, гречневую кашу следует употреблять с молоком; пшено — одновременно с мясом и другими продуктами. Большое значение имеет также правильное соотношение между белками и другими пищевыми веществами. Если в рационе питания содержится недостаточное количество жиров и углеводов, то поступающие с пищей белки будут использоваться организмом для покрытия энергетических затрат. В связи с этим рекомендуется, чтобы за счет белков обеспечивалось примерно 14% общей калорийности суточного рациона. Для более полного усвоения организмом белков необходимо также, чтобы в пище содержались витамины и минеральные соли. Значительно лучше перевариваются и усваиваются организмом белки животного происхождения; белки растительного происхождения, особенно белки крупы, усваиваются хуже, так как содержащаяся в них клетчатка мешает действию пищеварительных ферментов. Наличие молока, молочных продуктов и овощей в питании способствует лучшему усвоению всех пищевых веществ.
Аминокислоты
Во всех живых системах первоочередное значение имеют белки, они же протеины. Все химические и биохимические процессы, поддерживающие жизнь клетки и организма, выполняют исключительно ферменты, молекулы белковой природы. Белки также выполняют строительную функцию, как на уровне клеток, так и на уровне организма в целом. Функциональное разнообразие протеинов обусловлено их пространственной структурой, расположением, но прежде всего их химическим составом.
С химической точки зрения белки являются полимерами, состоящими изаминокислот. Данное название отражает структуру этих веществ, содержащих, по меньшей мере, одну аминогруппу -NH2 и одну карбоксильную группу -COOH. Различаются они только по строению своего радикала, который, собственно, и определяет их индивидуальные физико-химические свойства.
Природные протеиногенные аминокислоты
Общее число аминокислот в природе составляет около 300, в организме человека – более 60. Однако число аминокислот, из которых происходит синтез белка, всего около 20 (иногда насчитывают 21-22), и их называют протеиногенными аминокислотами, или природными. Из них в процессе синтеза белка и формирования его структуры образуются другие аминокислоты. Эти природные 20 аминокислот запрограммированы в генетическом коде любого организма, от вируса до человека, и именно их последовательность в белковой молекуле-цепочке определяет уникальность всех форм жизни на Земле.
В органах и тканях человека основная роль этих соединений - – участие в белковом синтезе, на это уходит подавляющая часть всех поступивших или образовавшихся аминокислот. Но есть и отдельные аминокислоты, которые обладают самостоятельными функциями. Так, тирозин является ответственным за окраску волос, кожи, глаз, придает темный цвет пищевым продуктам, например, ржаному хлебу, так как с его участием синтезируются темноокрашенные пигменты - – меланины. Ряд представителей данного класса играет роль медиаторов - – веществ, ответственных за передачу нервных импульсов от одной нервной клетки к другой (ацетилхолин, глутаминовая и аспарагиновая кислота, глицин, ГАМК, гистамин, серотонин, норадреналин). Аминокислота глутамин обеспечивает перенос продуктов азотистого обмена в крови человека.
Помимо протеинов, из аминокислот состоят более короткие молекулы, играющие важную роль в организме: олигопептиды. Среди них есть и не очень короткие цепочки аминокислотных остатков, например, гормон инсулин, и совсем короткие, вплоть до дипептидов (или бипептидов), которые состоят всего из двух аминокислотных остатков (для сравнения: белки насчитывают сотни аминокислотных остатков). Важнейшими дипептидами являются карнитин и карнозин, сильнейший природный антиоксидант.
Заменимые и незаменимые аминокислоты
Источником аминокислот в пищевых продуктах являются белки. Все белки пищевых продуктов различаются по своему аминокислотному составу. Это имеет большое значение в подборе полноценных рационов в связи с тем, что ряд аминокислот являются незаменимыми (эссенциальными) - они могут быть получены только с пищевыми продуктами. К незаменимым протеиногенным аминокислотам относятся валин, изолейцин, лейцин, треонин, метионин, лизин, фенилаланин, триптофан. В отличие от них, заменимые аминокислоты могут быть синтезированы в организме человека из предшественников. Это глицин, аланин, пролин, серин, цистеин, аспартат, аспарагин, глутамат, глутамин, тирозин. К частично заменимым относят аргинин и гистидин, так как в организме они синтезируются довольно медленно.
Дефицит или полное отсутствие в рационе даже одной незаменимой аминокислоты приводит к отрицательному азотистому балансу, что в свою очередь со временем вызывает тяжелые клинические последствия типа авитаминоза: нарушение деятельности центральной нервной системы, остановку роста и т.д.
Крайне важно отметить, что если в дефиците какая-то одна незаменимая аминокислота, то это приводит к неполному усвоению других. Данная закономерность подчиняется закону Либиха, по которому развитие живых организмов определяется тем незаменимым веществом, которое присутствует в наименьшем количестве.
В каких же продуктах питания содержатся незаменимые аминокислоты? Это все пищевые ингредиенты, богатые белком.
Продукты питания как источники незаменимых аминокислот
Оцените свой пищевой рацион! - бесплатный сервис
Крайне редко аминокислоты представлены в свободном виде. Последнее встречается в специальных пищевых продуктах, например, спортивном питании, куда их непосредственно добавляют в свободном состоянии для более быстрого и полного усвоения. В основном же они поступают в организм в составе белков и затем высвобождаются в ходе гидролиза последних. Высвободившиеся в результате гидролиза аминокислоты или небольшие пептиды уже могут всасываться в кишечнике.
Наиболее важными источниками незаменимых аминокислот в необходимом соотношении являются следующие продукты питания, где содержатся легкоусвояемые протеины: молоко, молочные продукты, яйца, мясо и мясопродукты, рыба, морепродукты, соя, бобовые (горох, чечевица, фасоль, соя), крупы, хлеб,картофель и др.
Наряду с аминокислотным составом, биологическая ценность протеинов определяется и степенью их усвоения после переваривания. Степень переваривания, в свою очередь, зависит, с одной стороны, от состояния организма (активности ферментов, глубины гидролиза в желудочно-кишечном тракте), и с другой стороны, от вида предварительной обработки белков в процессах приготовления пищи (тепловой, гидротермической, СВЧ и проч.). Тепловая обработка, разваривание, протирание и измельчение ускоряют переваривание белка, особенно растительного, тогда как нагревание до очень высоких температур свыше 100° С его затрудняет.
Белки и аминокислоты
Главной составной частью пищи являются белки. Основное назначение их - построение клеток и тканей, необходимых для роста, развития и осуществления жизненных функций организма. Белки входят в состав иммунных тел, гормонов, ферментов.
Иммунные тела (антитела) нужны организму для защиты его от различных заболеваний. Гормоны принимают участие в обмене веществ. Ферменты - биологические катализаторы, которые ускоряют в десятки и сотни тысяч раз биохимические реакции, происходящие в организме.
В желудочно-кишечном тракте белки пищи под влиянием пищеварительных соков, содержащих ферменты, постепенно расщепляются до более простых соединений - альбумоз к пептонов, а затем до аминокислот. Последние участвуют в образовании новых белков, свойственных организму человека.
В тканях одновременно с процессами образования новых белков происходит разрушение старых, которые выводятся из организма в виде конечных продуктов обмена: мочевины, аммиака, креатннина и других азотосодержащих соединений. У здоровых людей при рациональном питании количество поступающего с пищей азота (в составе белков) должно быть больше, чем количество выводимого (положительный баланс азота). Азот в организме используется для образования белка, развития и роста тканей. При отрицательном балансе азота и даже при азотистом равновесии в организме начинается распад собственных белков, что постепенно приводит к истощению.
Питательная ценность белков зависит от их аминокислотного состава. Из 20 аминокислот, содержащихся в пищевых белках, 8 являются незаменимыми. Это триптофан, лизин, метионин, валин, треонин, лейцин, изолейцин, фенилаланин.
Незаменимые аминокислоты участвуют в синтезе тканевых белков, оказывают влияние на прирост массы тела. Кроме того, каждая из них выполняет еще и свои специфические функции. Лизин, триптофан необходимы для роста. Лизин и гистидин связаны с функцией кроветворения, лейцин и изолейцин - щитовидной железы, фенилаланин - щитовидной железы и надпочечников. Метионин оказывает существенное влияние на обмен жиров и фосфатидов, обеспечивает антитоксичную функцию печени, играет большую роль в деятельности нервной системы.
Белки животного происхождения лучше усваиваются организмом, поскольку в них содержатся все аминокислоты, необходимые организму. Растительные белки являются менее ценными. В состав круп, хлеба, овощей и фруктов входят белки с неполным набором незаменимых аминокислот. Некоторые из них содержатся в незначительных количествах. Наибольшее количество полноценных белков в сое, горохе, фасоли, гречихе, ржи, рисе, картофеле. Биологическая ценность белка в пищевом рационе значительно увеличится, если правильно сочетать различные продукты животного и растительного происхождения. Так, богатый лизином молочный белок, дополняя аминокислотный состав муки, бедной лизином, повышает питательную ценность и усвояемость хлеба.
Изделия из муки целесообразно сочетать также с рыбой или мясом, белки которых богаты лизином и метионином. В равной мере оправдано приготовление блюд, в которых молоко сочетается с крупами. Белковая ценность яйца увеличивается при употреблении его с картофелем.
В каждом из приемов пищи должно содержаться достаточное количество незаменимых аминокислот в оптимальном их соотношении, иначе нарушается основное правило утилизации аминокислот организмом: для нормального течения процессов синтеза белка необходимо поступление незаменимых аминокислот в оптимальные сроки, а также в оптимальных концентрации и соотношении.
В рационах питания чаще всего встречается недостаток трех аминокислот: триптофана, лизина и метионина. Поэтому оценивают пищевые продукты, входящие в рацион, в первую очередь по содержанию этих незаменимых аминокислот.
Триптофан. Основные источники триптофана - мясо, рыба, творог, сыр, яйца. В различных частях мясной туши содержится неодинаковое количество триптофана. Например, белки соединительной ткани (голяшка, пашина, шея) почти лишены его. Наиболее ценными по содержанию триптофана являются такие части туши, как вырезка, тонкий и толстый края, мякоть задней ноги.
Важные дополнительные источники триптофана - продукты растительного происхождения: горох, фасоль и, особенно, соя.
Лизин. Основной источник лизина - молоко. 500-600 г его покрывает потребность в лизине примерно на 40-45 % суточной нормы. Много лизина в мясе, рыбе, бобовых, а также в твороге и сыре, в желтке яиц (в одном желтке - 186 мг лизина).
Метионин. Потребность в метионине удовлетворяется в значительной степени (на 40-45 %) белкамимолока и молочных продуктов. Наряду с молочными продуктами источниками метионина являются мясо, рыба, яйца, а из растительных продуктов - бобовые, гречневая крупа.
Содержание метионина в некоторых видах рыб (мг в 100 г) следующее: ставрида - 700, судак, щука - 534, скумбрия, минтай - 600, треска, морской окунь, карп - 500.
В мясе 2-й категории метионина больше, чем в мясе 1-й категории (515 и 445 мг в 100 г мякоти соответственно).
Из трех указанных незаменимых аминокислот труднее всего обеспечить организм метионином.
Объективным показателем оптимальной сбалансированности продукта или рациона по содержанию метионина является коэффициент отношения метионина к триптофану, принятому за 1. Чем выше коэффициент отношения метионин: триптофан в продукте, тем выгоднее включать такой продукт в рацион питания для улучшения сбалансированности его аминокислотного состава.
Из всех содержащих белок продуктов по соотношению метионин:триптофан первое место занимает рыба, за ней - творог нежирный, мясо, яйца.
При синтезе белков для каждого вида тканей организма требуется строго специфичный набор аминокислот. Например, в составе тканевого белка валин, аргинин и триптофан содержатся в равных количествах (1:1:1), но если в пищевом рационе их соотношение составляет 1:1:0,5, то усвоение всех указанных аминокислот устанавливается по аминокислоте, содержащейся в минимальном количестве. Поэтому соотношение 1:1:0,5 приведет к потере белка. Некоторые неусвоенные аминокислоты при накоплении в крови в повышенных дозах могут оказать токсическое действие. Как видим, рациональный подбор белков из разных продуктов с учетом их взаимного дополнения очень важен при составлении меню.
Таблица 2. Содержание незаменимых аминокислот в животных и растительных продуктах питания *
|
Продукт |
Белок, % |
Аминокислоты (мг на 100 г продукта нетто) |
||||||||
|
|
Трипто-фан |
Лизин |
Мети-онин |
Валин |
Треонин |
Лейцин |
Изо-лейцин |
Фени-лаланин |
Гистидин |
|
|
Яйцо куриное |
12,7 |
204 |
903 |
424 |
772 |
610 |
1081 |
597 |
652 |
340 |
|
Молоко коровье |
3,2 |
50 |
261 |
87 |
191 |
153 |
324 |
189 |
171 |
90 |
|
|
|
|
|
|
|
|
|
|
|
|
|
Мясо |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
говядина 1-й категории |
18,6 |
210 |
1589 |
445 |
1035 |
803 |
1478 |
782 |
795 |
710 |
|
|
|
|
|
|
|
|
|
|
|
|
|
говядина 2-й категории |
20,0 |
228 |
1672 |
515 |
1100 |
859 |
1657 |
862 |
803 |
718 |
|
|
|
|
|
|
|
|
|
|
|
|
|
телятина 1-й категории |
19,7 |
245 |
1683 |
414 |
1156 |
855 |
1484 |
998 |
791 |
739 |
|
|
|
|
|
|
|
|
|
|
|
|
|
телятина 2-й категории |
20,4 |
260 |
1755 |
453 |
1177 |
892 |
1566 |
1050 |
828 |
740 |
|
|
|
|
|
|
|
|
|
|
|
|
|
свинина мясная |
14,3 |
191 |
1239 |
342 |
831 |
654 |
1074 |
708 |
580 |
575 |
|
|
|
|
|
|
|
|
|
|
|
|
|
кролики |
21,1 |
327 |
2199 |
499 |
1064 |
913 |
1734 |
864 |
512 |
626 |
|
|
|
|
|
|
|
|
|
|
|
|
|
куры 1-й категории |
18,2 |
293 |
1588 |
471 |
877 |
885 |
1412 |
653 |
744 |
486 |
|
|
|
|
|
|
|
|
|
|
|
|
|
куры 2-й категории |
20,8 |
330 |
1699 |
574 |
899 |
951 |
1824 |
828 |
896 |
379 |
|
|
|
|
|
|
|
|
|
|
|
|
|
индейки 1-й категории |
19,5 |
329 |
1636 |
417 |
930 |
875 |
1587 |
963 |
803 |
540 |
|
|
|
|
|
|
|
|
|
|
|
|
|
индейки 2-й категории |
21,6 |
354 |
1931 |
518 |
1017 |
961 |
1819 |
1028 |
851 |
436 |
|
|
|
|
|
|
|
|
|
|
|
|
|
печень говяжья |
17,9 |
238 |
1433 |
438 |
1247 |
812 |
1594 |
926 |
928 |
847 |
|
|
|
|
|
|
|
|
|
|
|
|
|
почки говяжьи |
15,2 |
214 |
1154 |
326 |
857 |
638 |
1240 |
714 |
677 |
687 |
|
|
|
|
|
|
|
|
|
|
|
|
|
язык говяжий |
16,9 |
176 |
1373 |
345 |
845 |
708 |
1215 |
766 |
696 |
616 |
|
|
|
|
|
|
|
|
|
|
|
|
|
Колбаса |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
докторская |
12,8 |
151 |
945 |
177 |
672 |
529 |
913 |
547 |
508 |
318 |
|
|
|
|
|
|
|
|
|
|
|
|
|
сосиски молочные |
11,4 |
203 |
839 |
111 |
630 |
357 |
757 |
313 |
369 |
302 |
|
|
|
|
|
|
|
|
|
|
|
|
|
Рыба |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
треска |
16,0 |
210 |
1500 |
500 |
900 |
900 |
1300 |
1500 |
800 |
450 |
|
|
|
|
|
|
|
|
|
|
|
|
|
минтай |
15,9 |
200 |
1800 |
600 |
900 |
900 |
1300 |
1100 |
700 |
400 |
|
|
|
|
|
|
|
|
|
|
|
|
|
морской окунь |
18,2 |
170 |
1700 |
500 |
1000 |
900 |
1600 |
1100 |
700 |
400 |
|
|
|
|
|
|
|
|
|
|
|
|
|
карп |
16,0 |
180 |
1900 |
500 |
1100 |
900 |
1800 |
800 |
800 |
300 |
|
|
|
|
|
|
|
|
|
|
|
|
|
судак |
18,4 |
184 |
1619 |
534 |
975 |
791 |
1398 |
938 |
681 |
400 |
|
|
|
|
|
|
|
|
|
|
|
|
|
сельдь атлантическая |
19,0 |
250 |
1800 |
350 |
1000 |
900 |
1600 |
900 |
700 |
500 |
|
|
|
|
|
|
|
|
|
|
|
|
|
кальмары |
18,0 |
324 |
2005 |
521 |
500 |
648 |
2070 |
432 |
216 |
324 |
|
|
|
|
|
|
|
|
|
|
|
|
|
Творог |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
нежирный |
18,0 |
180 |
1450 |
480 |
990 |
800 |
1850 |
1000 |
930 |
560 |
|
|
|
|
|
|
|
|
|
|
|
|
|
жирный |
14,0 |
212 |
1008 |
384 |
838 |
649 |
1282 |
690 |
762 |
447 |
|
|
|
|
|
|
|
|
|
|
|
|
|
Сыр твердый |
26,8 |
788 |
1747 |
865 |
1414 |
1067 |
1780 |
1146 |
1280 |
1508 |
|
|
|
|
|
|
|
|
|
|
|
|
|
Соя |
34,9 |
450 |
2090 |
560 |
2090 |
1390 |
2670 |
1810 |
1610 |
620 |
|
|
|
|
|
|
|
|
|
|
|
|
|
Горох |
23,0 |
260 |
1660 |
250 |
1100 |
930 |
1650 |
1330 |
1110 |
600 |
|
|
|
|
|
|
|
|
|
|
|
|
|
Фасоль |
22,3 |
260 |
1590 |
280 |
1120 |
870 |
1740 |
1030 |
1130 |
630 |
|
|
|
|
|
|
|
|
|
|
|
|
|
Крупа |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
гречневая |
12,6 |
180 |
630 |
260 |
590 |
500 |
680 |
520 |
540 |
300 |
|
|
|
|
|
|
|
|
|
|
|
|
|
овсяная |
11,9 |
160 |
420 |
140 |
580 |
350 |
780 |
500 |
550 |
220 |
|
|
|
|
|
|
|
|
|
|
|
|
|
рисовая |
7,0 |
80 |
260 |
130 |
420 |
240 |
620 |
330 |
350 |
160 |
|
|
|
|
|
|
|
|
|
|
|
|
|
полтавская |
12,7 |
90 |
280 |
140 |
380 |
300 |
680 |
330 |
580 |
250 |
|
|
|
|
|
|
|
|
|
|
|
|
|
перловая |
10,4 |
100 |
300 |
120 |
490 |
320 |
490 |
460 |
460 |
190 |
|
|
|
|
|
|
|
|
|
|
|
|
|
ячневая |
9,3 |
120 |
320 |
160 |
450 |
210 |
510 |
560 |
490 |
230 |
|
|
|
|
|
|
|
|
|
|
|
|
|
пшено |
12,1 |
180 |
360 |
270 |
620 |
440 |
1620 |
590 |
580 |
290 |
|
|
|
|
|
|
|
|
|
|
|
|
|
макаронные изделия |
12,3 |
125 |
249 |
189 |
518 |
331 |
866 |
470 |
626 |
261 |
|
|
|
|
|
|
|
|
|
|
|
|
|
Мука пшеничная 1-го сорта |
10,6 |
120 |
290 |
160 |
510 |
330 |
880 |
530 |
580 |
240 |
|
|
|
|
|
|
|
|
|
|
|
|
|
Мучные изделия |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
хлеб ржаной |
5,5 |
67 |
186 |
62 |
268 |
175 |
356 |
207 |
309 |
103 |
|
|
|
|
|
|
|
|
|
|
|
|
|
хлеб пшеничный из муки 2-го сорта |
8,4 |
97 |
229 |
138 |
384 |
274 |
538 |
303 |
391 |
172 |
|
|
|
|
|
|
|
|
|
|
|
|
|
батоны нарезные из муки 1-го сорта |
7,4 |
83 |
165 |
117 |
330 |
213 |
553 |
295 |
395 |
166 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Картофель |
2,0 |
28 |
135 |
26 |
122 |
97 |
128 |
86 |
98 |
23 |
О молоке и его возможном влиянии на спортивные показатели в силовых видах спорта разговоры ведутся довольно давно. При этом одни утверждают о буквально сногсшибательном результате приема молока, другие, напротив, продолжают говорить, что роль молока сильно преувеличена. Попробуем выяснить реальные возможные последствия регулярного приема молока.
Начать стоит с того, что молоко, которое доходит до своего потребителя, проходит довольно длинный этап транспортировки и переработки. Попытки производителей всеми возможными способами увеличить срок годности готового продукта также приводят к ощутимой потере питательных свойств молока, добытого испод коровы. Процесс пастеризации молока и дополнительного обогащения его сухим молоком – последнее характерно в зимний период – приводит к гибели микрофлоры, присутствующей изначально в парном молоке, и части полезных витаминов. В итоге на прилавки магазинов попадает совсем не то молоко, о котором было принято рассказывать, скажем, пятьдесят или сто лет назад. Поэтому ожидать обещанного эффекта от магазинного молока по большому счету не стоит. По крайней мере в том виде, как это часто преподносится агитационно-рекламной шумихой.
В связи с этим встает закономерный вопрос: а стоит ли тогда употреблять в пищу этот продукт, и если да, то преследуя какие цели? Для конкретики определимся, что дальше речь пойдет о молоке, пусть и прошедшем технологические этапы своей переработки, но никак не о его "магазинном" брате-близнеце молочном напитке, получаемом исключительно композитным способом из сухой субстанции. Итак, молоко в своем составе содержит порядка 28 грамм белка на килограмм живого веса, 48 грамм углеводов и 15-35 грамм жира соответственно. Как видно, один килограмм молока (не путать с литрами) довольно калорийный, а потому молоко – действительно питательный продукт, ко всему прочему богатый белком животного происхождения, имеющим полный набор аминокислот, включая и незаменимые, то есть те, что в организме человека самостоятельно не синтезируются. Так что молоко уже по этим показателям можно смело занести в список разрешенных для культуриста продуктов.
Молоко часто рекомендуют употреблять и в качестве источника кальция, причем источника удобного для пищеварительной системы человека. По этой причине молоко входит в меню детских садов и школьных заведений, где требуется адекватное росту молодого организма питание. Это обстоятельство также стоит взять на заметку активно тренирующимся бодибилдерам, испытывающим не меньшую потребность в различных микроэлементах и витаминах. Заметим, что и тех и других больше сохраняется в пастеризованном молоке, имеющем срок годности в несколько дней, в отличие от стерилизованного, которое может храниться до полугода и даже более.
Время от времени в печати появляются сведения, что люди, принимающие на протяжении долгого периода времени молоко и его производные, меньше подвержены сердечно-сосудистым заболеваниям, они имеют более сильный иммунитет и среди них реже обнаруживают рак толстого кишечника. Хочется верить, что это действительно так. Если не брать во внимание известное состояние отечественной молочной промышленности, превращающей парное коровье молоко в некий напиток с обличающей надписью на упаковке.
Ко всему прочему пессимизма добавляет и то молоко, что под видом деревенского продается сегодня на рынках. Уже давно никого не удивляет, что и это молоко, по заявления самих продавцов ничем не обработанное, отказывается скисать помногу дней к ряду. Потребительское подозрение в этом случае падает на антибиотики, бесконтрольный прием которых еще никому здоровья не прибавил. Что уж там говорить о росте новых мышечных килограммов? Так что, если и пить молоко, то, пожалуй, пастеризованное – оно по крайней мере лишено патогенной микрофлоры и антибиотиков. Также известно, что пастеризации нисколько не влияет на белковый состав молока, что, конечно, добавляет плюсов и молоку и его кисломолочным собратьям: кефиру, ряженки, варенцу, натуральному йогурту.
Возможно, серьезным поводом к разговорам о полезности молока в плане набора мышечного веса и увеличения силовых показателей стали так называемые цитокины, входящие в состав парного, еще термически не обработанного молока и, к сожалению, при кипячении разрушающиеся в большом количестве. По некоторым исследовательским данным, цитокины способны оказывать влияние на преобразование стволовых клеток организма непосредственно в мышечные. Что, конечно же, представляет ощутимый интерес для представителей бодибилдинга. Но чтобы ожидаемое воздействие состоялось, предпочтение, по-видимому, нужно отдавать исключительно парному молоку, часто рискуя подхватить привычную для необработанного молока кишечную инфекцию.
Может молоко вредно?
Что из себя представляет молоко? В первую очередь это пищевой состав, остановимся на ключевых его составляющих.
Белки
Считаются самым ценным компонентом молока и состоят из казеина (80%), альбумина (13%) и глобулина (7%). Белок молока имеет полноценный аминокислотный состав. Именно эти факторы диктуют его основную ценность молока.
Но не все с белками гладко, идеальность молока сильно подпорчивает казеин (усваивается на 75%), это достаточно сложный белок, который по пищевой ценности значительно уступает альбумину (считается эталоном животного белка, усваивается на 100%), который преобладает в яйцах и семенах растений.
На заметку - женское молоко содержит преимущественно альбуминовые белки.
Те, кто пьют молоко литрами, и их масса растет, пускай попробуют пить (лучше есть) в таких же количествах яичный белок, и их просто «разорвет»!
Жиры
Молочные жиры (усваиваются на 95%) многими воспринимаются как критерий диетичности продукта, а напрасно. Жир является основным компонентом, который формирует пищевую ценность и стоимость напитка, содержит ценные витамины А, Е, D, К В и минералы. На этом преимущества заканчиваются, так как главным компонентом молочного жира являются триглицериды, которые содержат всего 3-5% биологически важных полиненасыщенных жирных кислот (линолевая, линоленовая, арахидоновая). Это небольшое достижение! Холестерин находится в свободном состоянии.
Углеводы
В молоке углеводы содержатся в виде лактозы (молочный сахар). В организме лактоза должна распадаться на глюкозу и галактозу.
В углеводах молока нет ничего особенного, кроме возможностей организма её усваивать. В детском возрасте лактоза достаточно хорошо усваивается, но со временем организм человека прекращает вырабатывать фермент перерабатывающий молочные углеводы – лактазу, в результате при приеме молока могут наблюдаться серьезнее нарушения пищеварения.
Это не надуманная проблема. Диапазон непереносимости лактозы жителями России и Украины колеблется в границах 5-35%, согласитесь не мало! Китайцы и жители США в 95-100% не переносят молоко (именно из-за непереносимости молока американцами в сети полно переводов статей о вреде такого продукта). С перевариванием лактозы повезло только Голландцам и Шведам, у них таких проблем нет.
Чем еще богато молоко? Конечно кальцием
Абсолютно все, за исключением редких случаем, посчитают это весомым плюсом в пользу любых молочных продуктов, но есть и другое мнение.
Не так давно, академиком (не уверен какой именно академии, но где-то в Одессе) Николаем Друзьякбыла сделана попытка доказать крайне негативное воздействие кальция на организм, будь он в воде, молоке или в таблетках. Если говорить предельно кратко и просто, кальций (его в молоке 1,4 г/литр), попадая в кровь человека, снижает её кислотность, делает её более щелочной, что в полной мере подтверждается химическими реакциями. Далее академик заявляет, что обменные процессы между кровью и клетками организма при повышенной щелочности проходят на много медленнее, что затормаживает деятельность всего организма, провоцирует болезни. Друзьяк считает, что кальций нужен в большом количестве лишь на стадии активного роста ребенка - до 2-х лет.
Если уже коснулись кислотности крови, то нужно заметить, что не один Николай Друзьяк считает пониженную кислотность крови (щелочность) основным врагом нашего здоровья. Подобного мнения придерживается Валерий Миргородский (доктор биологических наук, руководитель института бионической медицины - Акутон), он делает акцент на важности содержания нужной концентрации углекислоты в крови. Про роль кальция в формировании кислотности крови Миргородский не упоминает.
Подобные мысли в своих работах так же излагал врач Юрий Буланов, но к молочным продуктам относился очень положительно.
Вред коровьего молока :
- основной белок коровьей сыворотки, коровий бета-лактоглобулин, не имеет аналогов среди белков человеческого молока, хотя он может попасть в состав грудного молока женщин, которые употребляют в питание коровье молоко, и вызвать антигенную реакцию у подверженных аллергии детей;
- дети, вскармливаемые сыворотко- или казеинпреобладающими составами, имеют повышенные уровни мочевины и аминокислот в крови и испытывают более высокие нагрузки на почки;
- коровье молоко отличается более высоким содержанием коротко- и среднецепочковых жирных кислот, что в сочетании с повышенным содержанием казеина приводит к образованию нерастворимых щелочей, в результате чего возникала непроходимость молочных шариков и прободение кишечника у детей;
- жвачным животным требуется другая кишечная флора и среда, поэтому у искусственно вскармливаемых детей развиваются преимущественно кишечные и гнилостные бактерии;
- более высокое содержание фосфора в коровьем молоке служит причиной недостаточности кальция у детей;
- в восприимчивых семьях раннее введение в пищу белков молока коровы может увеличить риск развития инсулин зависимого диабета у младенцев и детей;
- повышение чувствительности и развитие иммунной памяти к белку молока коровы - начальный шаг в этиологии инсулин зависимого диабета.
Ввиду всех этих факторов ВОЗ и Минздрав РФ (организационно-методическое письмо от 10.2003) рекомендуют исключительно грудное вскармливание в течение первых 6 месяцев жизни ребенка и введение в его рацион продуктов из свежего коровьего молока не ранее года; при наличии в семье аллергии продукты из коровьего молока не рекомендуются и матери во время лактации.
Так ли полезно козье молоко?
Отношения к козьему молоку существуют полярные: одни им брезгуют, а другие считают наилучшим лечебным средством - "панацеей" против всех болезней и идеальным заменителем женского молока для грудных детей. Это личное дело каждого взрослого человека - выбирать свою точку зрения в личном лечении (учитывая, конечно, рекомендации и мнения врачей). Но когда козье молоко начинают рекомендовать как наилучший продукт для вскармливания грудных детей, здесь уже нужно остановиться и прислушаться к мнению официальной педиатрии.
Во-первых, нужно напомнить, что женское молоко - это "золотой стандарт" во вскармливании детей раннего возраста. Кроме того, состав и соотношение белков, жиров и углеводов грудного молока идеально подходят к потребностям организма ребенка и функциональным возможностям его пищеварительной системы. Само грудное молоко стерильно и постоянной температуры. Оно содержит целый ряд ферментов, которые помогают пищеварению, неспецифические и специфические факторы иммунной защиты, и не имеет антигенных свойств, то есть таких, которые аллергизируют организм.
Заменить эти, а также другие преимущества грудного молока при искусственном вскармливании молоком домашних животных практически невозможно. Но бывают, и достаточно часто, случаи, когда по целому ряду причин придется переводить ребенка на искусственное вскармливание. Если родители пренебрегают адаптированными смесями и стремятся кормить ребенка молоком домашнего скота, они должны знать эту информацию.
Все молоко домашних животных по характеру белков разделяется на две больших группы: казеиновое (коровье, козье) и альбуминовое (кобылье, ослиное). Женское молоко относится к группе альбуминовых, то есть большинство его белков это альбумины (мелкодисперсные белки). В желудке ребенка под действием желудочного сока из альбуминового молока формируются нежные, мягкие хлопья, которые достаточно легко перевариваются. Казеиновое же молоко образует сгусток, который несовершенная пищеварительная система малыша не может качественно переварить.
По составу основных белков козье молоко является казеиновым, и казеина в его составе больше, чем в коровьем молоке. Сгусток при свертывании козьего молока твердый, трудно переваривается желудочно-кишечным трактом грудных детей. Жира в козьем молоке больше, чем в женском и коровьем. Это хорошо как пищевой продукт для старших детей, но не для малышей первого года жизни. Хотя этот жир находится в виде мелких жировых шариков, усвоение его затруднено, так как ферментов для переваривания жиров у младенцев еще недостаточно. В женском молоке для помощи перевариванию жиров (хотя их меньше) есть фермент - липаза, а в козьем молоке этого фермента нет.
По составу к женскому молоку ближе всего находиться ослиное молоко, которое также является альбуминовым, и по основным ингредиентам и количеству минеральных остатков, подобное женскому. Кстати, именно это молоко в прошлых веках в странах Западной Европы использовали для искусственного вскармливания грудных детей. Например, ослиным молоком вскармливали одного из детей Чарльза Дарвина.
Преимуществом и главным показателем для сторонников вскармливания детей козьим молоком является высокое содержание в нем определенных микроэлементов и витаминов. Считают, что оно имеет в несколько раз больше, чем коровье, витаминов А, С, D, РР, необходимых организму, который растет, а также железа. Есть в нем в значительном количестве и витамин В12 - кроветворный фактор.
Но не стоит забывать, что: качество заменителя женского молока для грудных детей оценивается не по низкому или высокому содержанию определенных веществ, а по максимальному приближению к женскому (материнскому) молоку.
Козье молоко, в сравнении с женским, является более концентрированным минеральными веществами. Но нагружать организм ребенка минеральными солями в большой концентрации, когда системы обезвреживания и мочеотделения работают еще несовершенно, просто глупо. Если развести козье молоко до "концентрации определенного уровня", то есть до уровня концентрации минеральных солей в женском молоке, а именно в четыре раза, то, что же мы за пищевой продукт получим? Все преимущества, за которые хвалят козье молоко, при таком разведении исчезают.
Теперь что касается витаминного состава. Все познается в сравнении. Фантастически высокого содержания витаминов в козьем молоке нет, как утверждают его сторонники. Женское молоко попадает к ребенку в неизмененном виде, а молоко животных подлежит термической обработке (кипячению или пастеризации), которая разрушает большинство витаминов.
Особенное внимание нужно уделить фолиевой кислоте, содержание которой незначительно в козьем молоке. Она необходима для кроветворения, и если ребенок вскармливается козьим молоком, то у него развивается фолиеводефицитная анемия, течение которой значительно тяжелее, чем железодефицитной анемии.
По мнению болгарских ученых, появление этой анемии обусловлено не только дефицитом фолиевой кислоты, но и токсическим действием капроновой, каприловой и капроловой кислот, которые содержатся в козьем молоке в большом количестве.
В литературе 50-х годов есть положительные отзывы о вскармливании козьим молоком детей возрастом от семи месяцев до трех лет, но эти дети употребляли его в количестве 200-400 мл в день, и получали, кроме этого, блюда из овощей, круп и фруктов. Конечно, что при таком рационе негативных сторон козьего молока просто не будет.
В питании детей крайне важно поддерживать определенное соотношение между кальцием и фосфором. Нарушение соотношения между этими минеральными веществами, особенно за счет увеличения кальция, приводит к нарушению их всасывания, что является основой возникновения патологических состояний. Наиболее оптимальны соотношения кальция к фосфору в рационе грудных детей 2:1. В козьем молоке это соотношение 1,2-1,3:1, в коровьем - 1,6:1.
Несмотря на то, что грудное молоко содержит железа меньше 1 мг/л, биодоступность этого железа настолько высока, что ребенок получает адекватное количество его до тех пор, пока находится на естественном вскармливании. Из грудного молока абсорбируется 49% железа, что значительно выше, чем из любой другой еды. Содержание железа в козьем молоке зависит в основном от питания животного. В целом, уровень железа в нем приблизительно такой же, как в женском, но его биодоступность, как и коровьего молока вообще, значительно более низкая - до 13%.
Когда можно применять козье молоко?
Козье молоко рекомендуют пить детям дошкольного возраста и старше. Тогда можно не волноваться за возникновение негативных последствий, ведь дефицит определенных веществ будет компенсирован многообразием меню ваших детей.
Что касается лечения, то можно напомнить тот факт, что молоко как официальное лечебное средство применяли в России еще в ХIХ веке, а в народной медицине даже в XVI-ХVIII веках его рекомендовали для лечения "брюшных болезней", как слабительное и мочегонное средство, против ленточных глистов, при лечении грудного катара, туберкулеза легких и т.п. Более научно к этому методу лечения подошел российский врач Ф.И.Иноземцев. Он использовал сырое молоко, кстати - коровье, и только в редких случаях - ослиное и козье. Молоко назначалось в тех ситуациях, когда болезнь сопровождалась "раздражением нервно-узловатого характера" - при пневмонии, плеврите, гемипарезах сосудистого характера, туберкулезе легких, дизентерии, сердечной и бронхиальной астме, стенокардии, геморрое и др. В основе данного подхода к лечению лежала так называемая теория невризма.
Интересно, что параллельно с молоколечением Ф.И.Иноземцев назначал обтирание холодной водой. Большое значение предоставлял пребыванию на чистом воздухе, постельному режиму, полному покою, солнечным ваннам.
Выдающийся терапевт С.П.Боткин также рекомендовал употреблять молоко не только в комплексе диеты, но и как лечебное средство. Особенно блестяще он применял его при органических пороках сердца в период декомпенсации, а также при сердечных неврозах, стенокардии, базедовой болезни. С точки зрения Боткина, молоко регулирующе действует на нервную систему и через нее - на эпителий разных органов.
Следовательно, молоко (и не только козье) можно употреблять и как диетически лечебное средство, как это делали в прошлом веке. Но если раньше особого выбора не было в лечебных средствах, то терапией выбора, конечно, могло быть и молоко. В наше время, при максимальном выборе разнообразных препаратов, которые есть в арсенале врачей, молоко занимает место только как диета. И необходимо помнить, что при отсутствии или уменьшении количества ферментов, которые принимают участие в переваривании молока, оно может только навредить: метеоризм и бродильные процессы в кишечнике в результате несварения могут привести к ухудшению состояния больного. А если ваш организм хорошо усваивает молоко, то пребывание на свежем сельском воздухе (потому что кто же будет лечиться молоком козы, которая пасется в городе, среди машин и заводов), покой, тишина, 1-2 стакана свежего молока (козьего или коровьего), и, главное, вера в его целебные свойства могут вылечить многих. Конечно, нужно помнить об элементарных правилах гигиены.
Если вы хотите пить сырое козье молоко, будьте уверены в том, что коза и ее хозяйка здоровы (ведь многие возбудители инфекционных заболеваний передаются через молоко и молокопродукты), что животное пасется на пастбище, которое на несколько километров удалено от шоссе, от полей, которые обрабатываются химическими удобрениями или пестицидами.
Критерием того, что хозяйка козы является аккуратной женщиной, должно быть отсутствие специфического запаха козьего молока. Запах этот обусловлен тем, что молоко вбирает в себя летучие жирные кислоты из накожного жира вымени животного. Если хозяйка перед доением хорошо моет вымя, запаха не будет.
И так, смотрите реально на жизнь. К сожалению, "панацеи" не существует. Питайтесь козьим молоком, угощайте им своих детей, если они уже выросли из пеленок и самостоятельно бегают, можете лечиться им, если верите в него как в лекарство, но не забывайте и о других лечебных средствах. А в случае проблемы с естественным вскармливанием грудного ребенка, лучше вспомните об адаптированных смесях, которыми в наше время так богаты магазины, и которые лучше, полезнее для вашего малыша, чем знаменитое козье молоко.
татья размещена в номере 95 за май 2004 года
Функция ненасыщенных жирных кислот в организме
В. К. Казимирко, д. м. н.; В. И. Мальцев, д. м. н, профессор; Киевская медицинская академия последипломного образования им. П. Л. Шупика
Ненасыщенные жирные кислоты (НЖК) по числу двойных связей разделяются на моно-, ди-, три-, тетра-, пента-, гексаеновые. НЖК с одной или несколькими двойными связями являются структурными элементами фосфолипидов мембран и имеются в организме человека в значительных количествах (незаменимые жирные кислоты — линолевая, линоленовая, арахидоновая — поступают в организм с пищей). Самой распространенной из ненасыщенных жирных кислот является олеиновая (Е. А. Строев, 1986).
В фосфолипидах животных тканей очень мало содержится линолевой кислоты (0,05-0,4%), так как она превращается в линоленовую и арахидоновую. Линоленовая НЖК содержится в значительных количествах — 4-24%, содержание арахидоновой кислоты в фосфолипидах тканей составляет 0,2-22% (табл. 1). Биологическое значение ненасыщенных жирных кислот в метаболизме окончательно не выяснено, механизмы катаболизма НЖК в клетках животных также досконально не изучены. В молекулах НЖК две двойные связи, расположенные следующим образом: -СН=СН-СН=СН–, называются сопряженными (конъюгированными) (Л. Уайт и соавт., 1981).
Двойные связи определяют существование двух разных жирных кислот с 18-20 углеродными атомами, имеющими различное положение в пространстве: трансизомер имеет прямую форму, а углеродная цепь цисизомера всегда изогнута в месте двойной связи. Ненасыщенные жирные кислоты являются только цисизомерами, т.е. они все изогнуты. Жирные кислоты в свободном состоянии редко встречаются в составе мембран. Они являются важным фактором регулирования проницаемости мембран (влияют на поверхностные свойства фосфолипидов, белок-липидные и липид-липидные взаимодействия), функционирования мембранно-связанных ферментов (П. Г. Богач и соавт., 1981). В мембранах располагаются ферменты, активность которых зависит от липидного окружения. В этом окружении ферменты имеют определенную конформацию. Изменение липидного окружения (делипидирование, использование липолитических ферментов, липидообменивающих белков) ведет к изменению конформации белков (ферментов), изменению их каталитической активности (Н. Е. Кучеренко, А. Н. Васильев, 1985). Активность ферментов в мембранах связана с вязкостью липидной фазы мембран, составом липидов (П. Г. Богач и соавт., 1981; Н. Е. Кучеренко, А. Н. Васильев, 1985). Метаболическая активность липидзависимых ферментов определяется изменениями в липидном микроокружении и в первую очередь это касается фосфолипидов: от их состава и метаболизма зависят ферментативные процессы. Это подтверждено для микросомальной монооксигеназной системы. Липидные молекулы являются матриксом, оптимальным для функционирования мембранно-связанных ферментов. НЖК в мембранах придают им такое качество, как жидкостность (текучесть). Увеличение в мембранах содержания холестерина, насыщенность жирнокислотных радикалов в фосфолипидах снижают жидкостность мембран. Подвижность липидов изменяет конформацию полярных головок. Регулирующее влияние на мембранно-связанные ферменты оказывают гликофосфолипиды (стабилизируя мембраны). При модификации липидного состава теряется чувствительность к гормонам, фосфолипиды влияют на функционирование рецепторов, могут регулировать их число (Н. Е. Кучеренко, А. В. Васильев, 1985), взаимодействовать с токсинами. Интенсивность обновления фосфолипидов зависит от скорости синтеза ДНК в клетке. Имеется связь синтеза ДНК с составом липидов, перераспределением фракций фосфолипидов, степенью ненасыщенности жирнокислотных радикалов (насыщенные жирные кислоты тормозят синтез ДНК). Такие фракции фосфолипидов, как фосфатидилэтаноламины, кардиолипины дестабилизируют молекулы ДНК путем усиления активности ДНК-полимеразы. Фосфолипиды влияют на прочность ДНК (стабилизацию структуры). Все эти данные (Н. Е. Кучеренко, А. Н. Васильев, 1985) свидетельствуют о важной регуляторной роли фосфолипидов мембран, составной частью которых являются ненасыщенные жирные кислоты.
Окисление ненасыщенных жирных кислот
Мембраны клетки являются неполярной средой, в которой кислород растворяется в 7-8 раз лучше, чем в полярной (А. Хорст, 1982). Поэтому, по мнению автора, именно в мембранах чаще наблюдается окислительное превращение полиненасыщенных жирных кислот. Реакции окисления протекают в тех местах, где имеются ненасыщенные липиды (фосфолипиды): в мембранах митохондрий, эндоплазматического ретикулума, лизосом, плазматических мембранах. Окисление ненасыщенных жирных кислот протекает по схеме: RH + O2 –> ROOH.
К продуктам перекисного окисления ненасыщенных жирных кислот относят гидроперекиси липидов, альдегиды, малоновый диальдегид, другие диальдегиды, кетоны, спирты, эпоксиды. Физиологической функцией перекисного окисления является регуляция обновления, распада ненасыщенных структурных липидов, проницаемости липидов биологических мембран (Е. А. Строев, 1985). По мнению автора, активатором перекисного окисления липидов служат свободнорадикальные формы кислорода, образующиеся при одноэлектронном восстановлении его по схеме:
К ислородные
радикалы (супероксидный, гидроксильный,
пероксидный), обладая высокой реакционной
способностью, ускоряют процесс перекисного
окисления ненасыщенных жирных кислот.
Активные атомы водорода ненасыщенных
жирных кислот для вступления в реакцию,
по мнению А. Хорста, нуждаются лишь в
минимальных количествах энергии. Это
окисление активирует радикальные формы
кислорода, ионы металлов и, наоборот,
тормозит витамин Е (токоферол), связывая
пероксид и ОН-радикал. В присутствии
оксидантов (даже небольшого количества)
водород переходит к окислителю, что
вызывает цепочку реакций, изменяющих
структуру и функцию мембран. У насыщенных
жирных кислот энергия разрыва С-Н-связи
составляет около 381,3 кДж/моль, у
ненасыщенных жирных кислот по месту
двойной связи она равна 364,9 кДж/моль,
т.е. значительно меньше (П. Г. Богач
и соавт., 1981). Наименьшую энергию связи
имеет водород, который находится в
a-положении по отношению к двойной
связи, — 315,7 кДж/моль. Активные
формы кислорода способны отнимать
водород из групп — СН2 — ненасыщенной
жирной кислоты, превращая их в
свободнорадикальные группы
НС– (А. Я. Николаев, 1989). Радикал
жирной кислоты легко присоединяет
молекулу кислорода и превращается в
перекисный радикал жирной кислоты:
HC•+O2 –> HC–O–O–. Перекисный радикал
может отнимать водород от другой молекулы
жирной кислоты и восстанавливаться в
гидроперекись (за счет окисления этой
другой молекулы жирной кислоты в
свободный радикал): HC–O-O•+CH2 –>
HC–O–OH+HC•.
ислородные
радикалы (супероксидный, гидроксильный,
пероксидный), обладая высокой реакционной
способностью, ускоряют процесс перекисного
окисления ненасыщенных жирных кислот.
Активные атомы водорода ненасыщенных
жирных кислот для вступления в реакцию,
по мнению А. Хорста, нуждаются лишь в
минимальных количествах энергии. Это
окисление активирует радикальные формы
кислорода, ионы металлов и, наоборот,
тормозит витамин Е (токоферол), связывая
пероксид и ОН-радикал. В присутствии
оксидантов (даже небольшого количества)
водород переходит к окислителю, что
вызывает цепочку реакций, изменяющих
структуру и функцию мембран. У насыщенных
жирных кислот энергия разрыва С-Н-связи
составляет около 381,3 кДж/моль, у
ненасыщенных жирных кислот по месту
двойной связи она равна 364,9 кДж/моль,
т.е. значительно меньше (П. Г. Богач
и соавт., 1981). Наименьшую энергию связи
имеет водород, который находится в
a-положении по отношению к двойной
связи, — 315,7 кДж/моль. Активные
формы кислорода способны отнимать
водород из групп — СН2 — ненасыщенной
жирной кислоты, превращая их в
свободнорадикальные группы
НС– (А. Я. Николаев, 1989). Радикал
жирной кислоты легко присоединяет
молекулу кислорода и превращается в
перекисный радикал жирной кислоты:
HC•+O2 –> HC–O–O–. Перекисный радикал
может отнимать водород от другой молекулы
жирной кислоты и восстанавливаться в
гидроперекись (за счет окисления этой
другой молекулы жирной кислоты в
свободный радикал): HC–O-O•+CH2 –>
HC–O–OH+HC•.
Образовавшийся второй радикал аналогично вступает в реакцию и возникает цепная химическая реакция, которая продолжается уже без инициирующих веществ. Катализировать окислительный процесс может двухвалентное железо: Fe2+ + O2 + H+ –> Fe3+ + HO2–. Затем радикал НО2– вступает в реакцию с жирной кислотой: RH + НО2– Н2О2 + R–, в дальнейшем образовавшийся радикал соединяется с молекулой кислорода О2 и образуется перекисный радикал RO2–. Он также может взаимодействовать с нейтральными молекулами жирных кислот и т.д. Перекиси (пероксиды) нестабильны и распадаются с образованием альдегидов в результате разрывов в жирной кислоте углерод-углеродной связи, которая соседствует с перекисной группой. Подобным образом могут окисляться не только ненасыщенные жирные кислоты в фосфолипидах мембран, но и свободные ненасыщенные жирные кислоты, остатки ненасыщенных жирных кислот. В тканях животных основное количество перекисей липидов составляют продукты, полученные из полиненасыщенных β-ацильных остатков эндогенных мембранных фосфатидилэтаноламинов и фосфатидилхолинов.
Однако имеются и иные взгляды на проблему окисления ненасыщенных жирных кислот. Л. С. Страйер (1984) считает, что образованный ковалентными связями скелет биомолекул стабилен в отсутствие ферментов или притока энергии. Для диссоциации углерод-углеродной связи (С-С) необходимо 83 ккал/моль, в то время как содержание энергии, запасенной в молекулах АТФ, составляет лишь 12 ккал/моль. Разрыв С-С связей под действием радикалов кислорода in vivo представляется маловероятным. А. Ленинджер считает, что самоокисление липидов в организме полностью заторможено благодаря наличию витамина Е, различных ферментов и аскорбиновой кислоты.
Ненасыщенные жирные кислоты, как и насыщенные, подвергаются β-окислению (А. Ленинджер,1985). Положение и число двойных связей в молекулах ненасыщенных жирных кислот определяют особенности их окисления. НЖК окисляются как насыщенные до места двойной связи. Если двойная связь имеет трансконфигурацию и расположение, как в еноил-КоА, образующемся при окислении насыщенных жирных кислот, то дальше окисление идет обычным путем (Е. А. Строев, 1986). При отсутствии этого условия вступает в действие дополнительный фермент, перемещающий двойную связь и меняющий цис- в трансконфигурацию. Двойная связь может восстанавливаться НАДФ•Н2 (Я. Кольман, К. Г. Рем, 2000). Е. А. Строев (1986) отмечает, что скорость окисления ненасыщенных жирных кислот очень высока: олеиновой кислоты в 11 раз, линолевой — в 114, линоленовой — в 170, арахидоновой — в 200 раз выше, чем стеариновой. В исследованиях с олеиновой кислотой, меченной дейтерием, было установлено, что она может редуцироваться, превращаясь в стеариновую, а последняя подвергается β-окислению (И. В. Савицкий, 1973,1982). Такой путь допускали и для других ненасыщенных жирных кислот. Однако, по мнению И. В. Савицкого (1973, 1982), их окисление происходит иначе. На первом этапе под действием липоксигеназы происходит дегидрирование (отщепление) одного атома водорода и жирная кислота превращается на свободный радикал. Липоксигеназы широко представлены в тканях животных и обнаружены в микросомальной фракции гомогенатов клеток. Они катализируют реакции переокисления жирных кислот, которые различаются расположением окисляемого кислородом атома углерода. (В микросомальных мембранах образование перекисей катализирует диоксигеназа фосфолипидов, зависящая от НАДФ-Н2. Для образования перекисей липидов необходимо участие негеминового железа, которое в дальнейшем восстанавливается в микросомальной электронно-транспортной цепи). Образование под влиянием липоксигеназы свободного радикала обусловливает перестройку всей молекулы жирной кислоты. В результате этого превращения двойные связи из изолированных становятся сопряженными (приближаются одна к одной), а кислота с сопряженными двойными связями при наличии кислорода, по мнению автора, окисляется с образованием гидроперекиси и цикличной перекиси. Перекиси и гидроперекиси разлагаются до отдельных фрагментов — жирного альдегида (к примеру, капронового), малонового диальдегида, полуальдегида дикарбоновой кислоты (И. В. Савицкий ). При этом имеется прямая зависимость количества образовавшегося малонового диальдегида от количества двойных связей в молекуле ненасыщенной жирной кислоты: линолевая образует одну молекулу малонового диальдегида, линоленовая — две, арахидоновая — три, клупанодоновая — четыре. В качестве примера можно привести окисление линолевой кислоты: она последовательно превращается в свободный радикал линолевой кислоты, затем в ненасыщенную кислоту с двойными сопряженными связями, дальше в гидроперекись и циклическую перекись линолевой кислоты, которые разлагаются на капроновый альдегид, малоновый диальдегид и полуальдегид азелаиновой кислоты. Последние три продукта расщепления претерпевают дальнейшее окисление: образуются капроновая, азелаиновая и малоновая кислоты. Капроновая кислота после превращения в капронилкоэнзим А подвергается β-окислению. Азелаиновая кислота также включается в β-окисление, а малоновая после декарбоксилирования превращается в уксусную кислоту. Таким образом, линолевая кислота превращается в остатки уксусной кислоты, которые затем в цикле Кребса окисляются до СО2 и Н2О. Аналогичным образом (но с другими промежуточными продуктами) окисляются и другие ненасыщенные жирные кислоты: при окислении линоленовой кислоты образуется пропионовая, азелаиновая и две молекулы малоновой кислоты, при окислении арахидоновой — капроновая, глютаровая и три молекулы малоновой кислоты. Путем многостадийного процесса линолевая кислота может сначала превратиться в арахидоновую, которая затем подвергается окислению. Таким образом, в данном случае ненасыщенные жирные кислоты подвергаются β-окислению, но это наступает на более поздних этапах после их предварительной фрагментации и образования альдегидов с короткой углеродной цепью. Однако следует напомнить, что приведенная выше в качестве примера окисления линолевая кислота используется для синтеза арахидоновой кислоты и в фосфолипидах тканей содержится лишь в следовых количествах. Продукты превращения линолевой и линоленовой кислот представлены в таблице 2.
Омега-3 жирные кислоты эйкозапентаеновая и докозагексаеновая оказывают выраженное антиатеросклеротическое, вазодилататорное, антитромботическое действие, улучшают реологию крови. Арахидоновая кислота (эйкозатетраеновая), входящая в состав фосфолипидов плазматических мембран, является предшественником эйкозаноидов — медиаторов (локальных гормонов), сигнальных веществ, которые образуются почти во всех клетках организма и имеют небольшую дальность действия (Я. Кольман, К. Г. Рем, 2000). К эйкозаноидам относят первичные (классические) простагландины, простациклины, тромбоксаны, лейкотриены, метаболиты простагландинов, гидроперекиси (рис.). Наиболее изучены производные арахидоновой кислоты. В результате ее превращения образуются простагландины Е2, F22, простациклин I2, тромбоксан А2. Эйкозаноиды образуются и из других ненасыщенных жирных кислот — эйкозатриеновой, эйкозапентаеновой (т.е. из С20 — полиеновых жирных кислот). Продукты превращения различных жирных кислот отличаются своими свойствами. Биосинтез эйкозаноидов начинается с гидролиза фосфолипидов плазматической мембраны под действием фосфолипазы А2, активность которой контролируется гормонами, другими биорегуляторами, сопряженными с G-белками (активность фосфолипазы А2 повышается и под воздействием липоперекисей). Авторы отмечают два главных пути биосинтеза эйкозаноидов. Инициатором первого пути является простагландин-синтаза (имеет свойства циклооксигеназы и пероксидазы), катализирующая превращение арахидоновой кислоты в циклические эндоперекиси. В результате последующих реакций, катализируемых другими ферментами, образуются простагландины, простациклины и тромбоксаны. Этот путь (циклооксигеназный) блокируют ацетилсалициловая кислота и нестероидные противовоспалительные препараты (в настоящее время различают циклооксигеназы-1 и 2). Их антитромбогенный эффект обусловлен торможением образования тромбоксана и агрегации тромбоцитов. Инициатором второго пути биосинтеза эйкозаноидов является упоминавшаяся выше липоксигеназа (блокирующее действие оказывают витамин Е, рутин). При участии липоксигеназы все полиеновые (полиненасыщенные) жирные кислоты окисляются с образованием гидроперокси- и гидроксипроизводных жирных кислот. В дальнейшем за счет дегидратации, различных реакций переноса из них образуются лейкотриены. Детальные механизмы биосинтеза эйкозаноидов и пути их окисления до конечных продуктов не выяснены. Как отмечают Я. Кольман и К. Г. Рем (2000), эйкозаноиды служат вторичными мессенджерами гидрофильных гормонов, контролируют сокращение гладкомышечных тканей сосудов, бронхов, матки, принимают участие в высвобождении продуктов внутриклеточного синтеза (гормонов, соляной кислоты, мукоидов), влияют на метаболизм костной ткани, периферическую нервную систему, иммунную систему, передвижение и агрегацию лейкоцитов и тромбоцитов (свертывание крови), являются эффективными лигандами болевых рецепторов. Эйкозаноиды быстро разрушаются (инактивируются в течение нескольких секунд в результате восстановления двойных связей и окисления гидроксигрупп), поэтому действуют как локальные биорегуляторы путем связывания с близко расположенными мембранными рецепторами своей клетки (аутокринное действие) или соседних клеток (паракринное действие). Их действие может быть опосредовано через цАМФ и цГМФ. Особое внимание исследователи уделяют в настоящее время метаболизму арахидоновой кислоты в тромбоцитах и эндотелии. Под действием циклооксигеназы в тромбоцитах образуются циклические эндоперекиси, простагландины, которые под действием тромбоксансинтетазы (содержится в микросомальной фракции тромбоцитов) превращаются в тромбоксан А2 (ТхА2) с периодом полураспада 30 секунд (А. Хорст, 1982). Тромбоксан А2 вызывает агрегацию тромбоцитов, тромбообразование, сужение сосудов, боль, отек. Находящаяся в эндотелии сосудов простациклинсинтетаза превращает эндоперекиси в простациклин ПГI2, который обладает противоположными по отношению к тромбоксану А2 свойствами: подавляет агрегацию тромбоцитов, расширяет сосуды. При повреждении эндотелия выработка в нем простациклинсинтетазы нарушается и преимущественно образуется тромбоксан А2, вызывающий изменения, необходимые для восстановления эндотелия: агрегацию тромбоцитов, тромбоз, спазм сосудов. В данном случае выбор пути метаболизма, очевидно, связан с состоянием эндотелия сосудов. Как отмечает А. Хорст (1982), при метаболизме эндоперекисей образуются свободные радикалы. Освобождаемые при ферментном окислении арахидоновой кислоты свободные радикалы гидрокси-типа, по его мнению, могут быть дополнительными факторами воспаления. В частности, гидроперокси — PGE2 — образуют свободные радикалы с центральным атомом кислорода.
Имеется функциональная связь между обменом незаменимых полиненасыщенных жирных кислот (линолевой, линоленовой и арахидоновой) и функционированием костной ткани. При отсутствии незаменимых жирных кислот в пищевом рационе экспериментальных животных замедляется их рост, нарушается работа почек. Образующиеся из НЖК простагландины оказывают влияние на метаболизм костной ткани, воспаление, кровообращение, транспорт ионов через мембраны. Простагландины принимают участие в ремоделировании костной ткани. Так ПГЕ2 влияет на формирование и активность остеокластов, процессы резорбции костной ткани. В частности усиление костной резорбции при иммобилизации, воспалении, злокачественных процессах объясняют действием простагландинов. Влияние ПГЕ2 на костное формирование зависит от концентрации: в концентрации 10–9-10–7 ммоль/л он увеличивает синтез коллагена остеобластами, при концентрации 10–6 ммоль/л — замедляет. ПГЕ1 ускоряет выход кальция из кости (А. Уайт и соавт., 1981). Как и паратгормон, ПГЕ1 стимулирует высвобождение из клеток костной ткани лизосомальных ферментов. Ацетилсалициловая кислота, ингибируя биосинтез простагландинов, снимает эти эффекты. Усилению костной резорбции способствуют, образующиеся в процессе окисления липидов, свободные радикалы: они участвуют в активации остеокластов.
Выделяют и третий путь метаболизма арахидоновой кислоты (В. Г. Денисюк и соавт., 1992). Под действием фосфолипазы А2 от молекулы арахидоновой кислоты отщепляется плазменилхолин и образуется предшественник фактора агрегации тромбоцитов (ФАТ) лизоплазменилхолин (лизо-ФАТ, лизофосфатидилхолин). Лизоплазменилхолин подвергается ацетилированию под влиянием ацетилтрансферазы и образуется ФАТ, вызывающий вазоконстрикцию, индуцирующий агрегацию тромбоцитов. Одновременно с увеличением содержания в крови ФАТ активизируется липоксигеназный путь метаболизма арахидоновой кислоты (увеличивается концентрация 5-НЕТЕ–5-гидроокись эйкозапентаеновой кислоты) и синтез лейкотриенов.
Продукты переокисления ненасыщенных жирных кислот легко обнаруживаются in vitro (Н. Е. Кучеренко, А. Н. Васильев, 1985). По мнению авторов in vivo их обнаружить сложно из-за незначительной концентрации, а также нейтрализации антиоксидантами. Кроме того, они включаются в β-окисление, цикл Кребса, а также из них образуются чрезвычайно не стабильные эйкозаноиды. Промежуточные гидроперекиси очень не стабильны и in vitro (Н. А. Тюкавкина, Ю. И. Бауков, 1991) и уже при комнатной температуре распадаются с образованием альдегидов, которые окисляются в конечные продукты реакции — кислоты (образуется четыре моно- и дикарбоновые кислоты с короткими углеродными цепями).
Как отмечает А. Лабори (1970), на липидные молекулы окисление действует своеобразно: размещение в пространстве длинных молекул жирных кислот тесно связано с восстановленным или окисленным состоянием связей между различными атомами углерода, с изгибами по месту двойных связей. И окисление молекулы жирной кислоты не ограничивается потерей молекулы водорода, а сопровождается пространственной перестройкой молекулы. Так как молекула находится в мембране, изменяется ее проницаемость.
Резюмируя изложенную информацию, следует отметить, что имеется несколько путей окисления ненасыщенных жирных кислот. К ним относятся следующие.
β-Окисление, при этом вклад ненасыщенных жирных кислот в энергетические процессы незначителен.
Перекисное окисление, инициированное активными формами кислорода, (АФК) металлами с переменной валентностью, т.е. неферментативное. Параметры этого процесса не установлены. А. Ленинджер указывает на возможность повреждения молекул ненасыщенных жирных кислот активными формами кислорода, однако в его работах, как и монографиях других всемирно известных биохимиков, отсутствуют данные о перекисном окислении липидов, инициированном АФК, как системном биологическом явлении, о механизмах перекисного окисления липидов. С другой стороны, наличие нормального (фонового) уровня в организме продуктов окисления ненасыщенных жирных кислот (гидроперекисей, диеновых конъюгатов, малонового диальдегида) показывает, что перекисное окисление липидов не может быть случайным, цепным, хаотичным патологическим процессом (тогда он не может и не должен характеризоваться нормой). Если процесс представлен нормой, то возникает вопрос о его физиологической роли в организме. Следует отметить также, что показатель малонового диальдегида не может характеризовать выраженность перекисного окисления липидов, инициированного АФК, ионами металлов с переменной валентностью, так как он образуется и в результате ферментативного перекисного окисления липидов инициированного липоксигеназами (И. В. Савицкий, 1973, 1982).
Метаболический путь продуктов переокисления липидов не прослежен. Накопление продуктов переокисления липидов обнаруживается in vitro. In vivo продукты расщепления ненасыщенных жирных кислот включаются в конечном итоге в энергетические процессы, как это было показано И.В. Савицким, из них образуются «короткоживущие» эйкозаноиды.
Ферментативное перекисное окисление липидов, осуществляемое с участием липооксигеназ (диоксигеназ — в микросомальной сети) при наличии кислорода. Оно описано И.В Савицким (1973, 1982) и достаточно детально представлено выше.
Окисление арахидоной (эйкозатетраеновой), дигомо-гамма-линолевой (эйкозатриеновой), эйкозапентаеновой кислот (т.е. С20-полиеновых жирных кислот) под влиянием циклооксигеназ, липооксигеназ с образованием эйкозаноидов. Линолевая, линоленовая, арахидоновые кислоты при участии липооксигеназ окисляются до гидроперекисей и гидроксипроизводных жирных кислот, из которых образуются лейкотриены.
Физиологическая роль перекисного окисления НЖК
Представленная выше информация позволяет сделать ряд важных выводов. Прежде всего, необходимо подчеркнуть, что переокисление ненасыщеных жирных кислот в мембранах, благодаря включению продуктов их распада в процесс β-окисления, сопряжено с окислительным фосфорилированием, энергетическими клеточными процессами: продукты распада НЖК в конечном итоге окисляются в цикле Кребса до СО2 и воды. Хотя в целом, как мы отметили выше, вклад ненасыщенных жирных кислот в энергетические процессы незначительный. Окисление ненасыщеных жирных кислот контролируется ферментами. Тот факт, что в организме имеется нормальный физиологический уровень (фоновый) малонового диальдегида (МДА), диеновых конъюгатов (ДК), других продуктов перекисного окисления липидов, свидетельствует о существовании строгого контроля за окислением липидов со стороны всей иерархической системы регуляции и в первую очередь ДНК. Последняя осуществляет контроль за метаболизмом посредством синтеза ферментов и клеточных белков, поэтому утверждение о существовании в клетках неконтролируемых свободнорадикальных реакций в больших масштабах не обосновано. Повреждение активными формами кислорода молекул ненасыщенных жирных кислот фосфолипидов мембран, по мнению А. Ленинджера и других исследователей, возможно, но имеет ограниченное место, т.к. АФК нейтрализуются ферментами, биоантиоксидантами (прежде всего витамином Е и С). Следует отметить, что лишь незначительная часть кислорода (1-3%) используется в свободнорадикальных реакциях, т.е. параметры этого процесса весьма ограничены. Образование перекисей липидов в различных тканях животных является нормальным процессом и осуществляется под контролем ферментов. Специфическое окисление ненасыщенных жирных кислот происходит в липоксигеназной реакции, в эндоплазматической сети его катализирует НАДФ•Н2-зависимая диоксигеназа. Образованные перекиси также подвергаются ферментативной деградации. При участии липоксигеназы все полиеновые кислоты (линолевая, линоленовая, арахидоновая) окисляются до гидроперекисей, гидроксипроизводных жирных кислот, из которых в результате последовательных реакций образуются лейкотриены. Арахидоновая кислота при участии простагландинсинтазы (циклооксигеназа + пероксидаза) превращается в ее метаболиты — простагландины, простациклины, тромбоксаны, лейкотриены, т.е. локальные гормоны, обладающие чрезвычайно важной разносторонней физиологической активностью.
Ткани интактных животных имеют определенный, разный для каждого органа, физиологический уровень содержания перекисей липидов (Ю. П. Козлов, 1985; Н. Е. Кучеренко, А. Н. Васильев, 1985). При этом уровень содержания перекисей липидов выше в тканях с высокой метаболической активностью. При различных физиологических состояниях содержание перекисных продуктов в фосфолипидах изменяется. Приведенные П. Г. Богач и соавт. (1981) данные свидетельствуют об увеличении интенсивности переокисления липидов в различных органах животных при дыхании кислородом, физической нагрузке (плавании), раздражении нервов, сокращении мышц. Таким образом, процессы окисления липидов (с образованием перекисей) являются важными для нормального функционирования биологических мембран и организма в целом. Физиологическая роль этих реакций состоит в регуляции обновления и проницаемости липидов биологических мембран, образовании эйкозаноидов — медиаторов (локальных гормонов) или сигнальных веществ, играющих важную биологическую роль в организме. Такие важнейшие мембранные процессы, как перенос электронов в дыхательной цепи, окислительное фосфорилирование, метилирование и гидроксилирование ряда субстратов эндогенного и экзогенного происхождения ферментными системами эндоплазматической сети и даже деление клеток, сопровождаются изменениями интенсивности течения процессов переокисления липидов (П. Г. Богач и соавт., 1981). Липоперекиси являются нормальными и необходимыми продуктами не только при биосинтезе простагландинов, простациклинов, тромбоксанов, но и прогестерона, они участвуют в гидроксилировании стирольного кольца холестерина. Свободные радикалы участвуют во многих биохимических процессах, без их образования в нейтрофилах и макрофагах организм погибает в результате нарушения обезвреживания микробов.
Регуляция процессов перекисного окисления НЖК
Выделяют (Н. Е. Кучеренко, А. Н. Васильев, 1985) целый ряд механизмов регуляции перекисного окисления липидов:
Строгую структурную организацию липидных компонентов мембран: она влияет на количество промежуточных продуктов, скорость перекисного окисления липидов («разрыхление» мембран ведет к его усилению). Состав фосфолипидов мембран определяет количество, качество образующихся перекисей, перекисных радикалов.
Нормальное функционирование ферментов, обеспечивающих инактивацию активных форм кислорода, свободных радикалов, и ферментов обмена фосфолипидов мембран. Процесс переокисления липидов зависит от степени ненасыщенности ацильных остатков жирных кислот: она оказывает определяющее влияние на количество гидроперекисей, их устойчивость к действию ферментов метаболизирующих гидроперекиси — глутатионлипопероксидазы, пероксидазы, каталазы.
Достаточное содержание биоантиоксидантов в клетке, организме.
Для уровня течения перекисного окисления НЖК большое значение имеют концентрация кислорода в тканях (при его низком уровне интенсивность переокисления снижается, как и других окислительных процессов, высоком — усиливается), ферментные и неферментные системы, восстанавливающие перекиси (глутатионпероксидаза, глутатионредуктаза, супероксиддисмутаза, каталаза, пероксидаза, др.). Несколько механизмов регуляции действуют одновременно. С продуктами переокисления в клетке реагируют биоантиоксиданты: токоферолы, убихиноны, витамин К, аскорбиновая кислота. Они снижают активность перекисного окисления липидов. Антиоксидантными свойствами обладают восстановленные фенольные формы этих соединений: их свободные гидроксильные группы взаимодействуют с перекисными радикалами.
На наш взгляд, при анализе механизмов регуляции перекисного окисления ненасыщенных жирных кислот следует учитывать его взаимосвязь с энергетическими внутриклеточными процессами, а также функционированием пентозного цикла. Как это показал И.В. Савицкий, остатки (фрагменты) ненасыщенных жирных кислот, образующихся в процессе переокисления, включаются в конечном итоге в цикл Кребса и «сгорают» до СО2 и воды. Таким образом, их количество в клетке напрямую зависит от функционирования гликолиза, цикла Кребса, окислительно-восстановительной цепи. Имеется сопряженность между энергетическими процессами (окислительным фосфорилированием) в клетке и окислением ненасыщеных жирных кислот. Например, изменение концентрации свободных радикалов при злокачественном перерождении фибробластов в условиях воздействия аденовирусов коррелирует с активностью гликолитической цепи (Н. И. Кучеренко, А. Н. Васильев, 1985). В случае снижения интенсивности процессов окислительного фосфорилирования следует ожидать некоторое уменьшение активности процессов перекисного окисления липидов: уменьшение движения потока электронов по окислительно-восстановительной цепи митохондрий приведет к уменьшению образования активных форм кислорода, а затем к снижению интенсивности процесса переокисления. С другой стороны чрезвычайно важное регулирующее значение для уровня перекисного окисления липидов имеет функционирование пентозного цикла, в котором происходит восстановление НАДФ и окисленного глутатиона. Эти две молекулы, по мнению А. Лабори (1970), являются клеточным запасом водорода, необходимым для восстановления перекисей липидов, ликвидации свободных радикалов. Сульфгидрильные соединения (глутатион, цистеин, метионин, белки, содержащие сульфгидрильные группы), связывая радикалы и разлагая перекиси, снижают количество радикалов в организме. Защитное действие метиленового синего, цистамина, окисленного глутатиона при повышенном давлении О2, ионизирующем влиянии, по мнению А. Лабори, не связано с восстанавливающим действием. Наоборот, метиленовый синий, витамины Е, К могут окислять НАД•Н2, принимая электрон. Окисление, лимитированное НАДФ•Н2, направляет Г-6-Ф в сторону пентозного пути, а последний ведет к восстановлению НАДФ и вторично окисленного глутатиона. Физиологическим восстановителем НАДФ и окисленного глутатиона также является аскорбиновая кислота. Таким образом, в защите против агентов, образующих свободные радикалы и перекиси липидов, важнейшее значение имеет активность пентозного цикла. Ткани, в которых имеется активный пентозный цикл (слизистая оболочка, мышцы тонкого кишечника, яички), высокое содержание НАДФ, окисленного глутатиона, содержат очень мало перекисей.
И, наконец, перекисное окисление НЖК контролируется ДНК путем синтеза ферментов (липоксигеназы, диоксигеназы, глутатионпероксидазы, глутатионредуктазы, пероксидазы, каталазы, супероксиддисмутазы), клеточных белков (глутатиона). Таким образом, процесс перекисного окисления липидов (ненасыщенных жирных кислот) в организме не хаотичный, а контролируемый, имеющий исходный фоновый уровень.
Биологические эффекты продуктов переокисления НЖК
Переокисление ненасыщеных жирных кислот фосфолипидов мембран, значительное увеличение содержания продуктов этого окисления могут привести к целому ряду отрицательных эффектов, большинство из которых наблюдались in vitro. К этим эффектам относят конформацию липидов и белков, изменение структуры и функции мембран, повышение их проницаемости, нарушение активности мембранно-связанных ферментов. Сведения о свободнорадикальных процессах, полученные в эксперименте (in vitro), нельзя полностью экстраполировать на организм человека, хотя такие исследования помогают прояснить их сущность. Очевидно, что in vivo наиболее серьезные изменения в мембранах наступают в следующих случаях: при влиянии ионизирующей радиации, интенсивном ультрафиолетовом облучении, воздействии токсических веществ, обезвреживание которых совершается в эндоплазматической сети с участием специализированной ферментной системы переноса электронов — цитохрома Р-450, НАДФ•Н2; гипербарической оксигенации (гипероксии), интоксикации озоном. При перечисленных воздействиях подтвержден подобный характер изменений и показана эффективность антиоксидантной терапии. Как показывают результаты наших исследований и анализ литературы, абсолютное большинство заболеваний (прежде всего в острый период и в период обострения) сопровождается интенсификацией окисления НЖК и развитием выраженной в различной степени антиоксидантной недостаточности. Возникающий дефицит биоантиоксидантов требует проведения соответствующей коррекции.
Таким образом, важная роль НЖК в организме определяется, прежде всего, биологическими эффектами специфического для них перекисного окисления и высокой физиологической активностью образующихся эйкозаноидов.
Переваривание эфиров холестерола и фосфолипидов. Большая часть холестерола пищи находится в виде эфиров холестерола, которые формируются из свободного холестерола и одной молекулы жирной кислоты. Фосфолипиды в своем составе также содержат жирную кислоту. Эфиры холестерола и фосфолипиды гидролизуются панкреатическим секретом с помощью двух других липаз, которые освобождают жирные кислоты: фермента холестеролэфиргидролаза для гидролиза эфира холестерола и фермента фосфолипаза А2, гидролизующего фосфолипиды.
Мицеллы желчных солей при переваривании играют ту же роль в переносе молекул свободного холестерола и фосфолипидов, что и при переносе моноглицеридов и свободных жирных кислот. По существу без работы мицелл не произойдет всасывания ни одной молекулы холестерола.
Секретин стимулирует секрецию значительного количества ионов бикарбоната. Нейтрализация кислого химуса из желудка. Секретин представляет собой полипептид, содержащий 27 аминокислот (молекулярная масса около 3400). Он присутствует в слизистой двенадцатиперстной кишки и тощей кишки в неактивной форме просекретина в так называемых S-клетках. Когда кислый химус с рН менее 4,5-5,0 поступает в двенадцатиперстную кишку из желудка, это вызывает выделение дуоденальный слизи и активацию секретина, который затем абсорбируется в кровь. Единственной действительно важной составляющей химуса является соляная кислота желудка, которая вызывает выброс секретина.
Секретин, в свою очередь, вызывает секрецию поджелудочной железой большого количества жидкости, содержащей высокую концентрацию иона бикарбоната (вплоть до 145 мэкв/л), но низкую концентрацию ионов хлора. Механизм образования секретина является особенно важным по двум причинам: (1) секретин начинает высвобождаться из слизистой тонкого кишечника, когда рН дуоденального содержимого падает ниже 4,5-5,0; (2) выброс секретина резко увеличивается, когда рН падает до 3,0. Это немедленно вызывает обильную секрецию панкреатического сока, содержащего существенное количество бикарбоната натрия. Конечным итогом является следующая реакция в двенадцатиперстной кишке: НСl + NaHC03 -> NaCl + H2C03
Затем угольная кислота немедленно диссоциирует на двуокись углерода и воду. Углекислый газ абсорбируется в кровь и выводится через легкие, оставляя нейтральный раствор хлорида натрия в двенадцатиперстной кишке. Таким способом немедленно нейтрализуется кислое содержимое, опорожняющееся в двенадцатиперстную кишку из желудка. Слизистая тонкой кишки не может противостоять переваривающему действию кислого желудочного сока, и это является существенным защитным механизмом, предотвращающим развитие дуоденальных язв.
Секреция иона бикарбоната поджелудочной железой обеспечивает подходящий рН для работы панкреатических пищеварительных ферментов, действие которых оптимально в слабощелочной или нейтральной среде при рН от 7,0 до 8,0. К счастью, рН секреции натрия бикарбоната в среднем равняется 8,0.
Холецистокинин и его вклад в регуляцию секреции пищеварительных ферментов поджелудочной железы. Присутствие пищи в верхнем отделе тонкого кишечника вызывает также выделение из I-клеток, находящихся в слизистой двенадцатиперстной кишки и верхней части тощей кишки, второго гормона — холецистокинина. Это полипептид, содержащий 33 аминокислоты. Такое выделение холецистокинина происходит в результате присутствия протеоз, пептонов (продуктов частичного переваривания белков) и длинноцепочечных жирных кислот в химусе, поступающем из желудка.
Холецистокинин, как и секретин, с кровью доставляется к поджелудочной железе, но вместо стимуляции секреции бикарбоната натрия обусловливает преимущественное выделение ацинарными клетками пищеварительных ферментов, причем в больших количествах. Этот эффект подобен тому, который вызывает вагусная стимуляция, но только он более выраженный и составляет от 70 до 80% общей панкреатической секреции ферментов после приема пищи.
Различия между эффектами панкреатической стимуляции секретином и холецистокинином показаны на рисунке, который демонстрирует: (1) интенсивную секрецию бикарбоната натрия в ответ на кислоту в двенадцатиперстной кишке, стимулированную секретином; (2) двоякий эффект в ответ на жир (мыла); (3) сильную пищеварительную секрецию ферментов, вызванную холецистокинином (когда пептоны поступают в двенадцатиперстную кишку). Общее суточное количество секреции составляет около 1 л.
Одной из главнейших функций печени является секреция желчи, которая в норме составляет от 600 до 1000 мл/сут. Желчь выполняет две важные функции. Во-первых, желчь играет важную роль в переваривании жира и его всасывании из-за того, что желчные кислоты: (1) помогают эмульгировать большие жировые частицы пищи на множество мельчайших частиц, поверхность которых потом может быть атакована ферментами, присутствующими в панкреатическом соке; (2) содействуют всасыванию конечных продуктов переваривания жира через мембрану слизистой кишечника.
Во-вторых, желчь служит средством для выделения из крови некоторых важных продуктов жизнедеятельности. Это прежде всего билирубин — конечный продукт разрушения гемоглобина и излишков холестерола.
Физиологическая анатомия секреции желчи
Секреция желчи печенью происходит в две стадии: (1) начальная порция секретируется главными функциональными клетками печени — гепатоцитами. Начальный секрет содержит большие количества желчных кислот, холестерола и других органических соединений. Он выделяется в мелкие желчные канальцы, которые расположены между печеночными клетками; (2) далее желчь течет по канальцам в направлении междольковых перегородок, где канальцы опорожняются в терминальные желчные протоки, а затем — в постепенно увеличивающиеся протоки, достигая печеночного и общего желчного протоков.

Отсюда эта желчь может выделяться прямо в двенадцатиперстную кишку или перенаправляться через желчный проток в желчный пузырь в течение минуты или нескольких часов.
Желчные протоки выделяют вторую порцию печеночного секрета, добавляя его в первичную желчь. Этот секрет представляет собой водный раствор натрия и ионов бикарбоната, выделяемых секреторными эпителиальными клетками, которые выстилают канальцы и протоки. Вторичная секреция дополнительно увеличивает общее количество желчи на 100%. Эта секреция стимулируется главным образом секретином, который вызывает выделение дополнительного количества ионов бикарбоната, добавляя их в панкреатический секрет для нейтрализации кислоты, поступающей в двенадцатиперстную кишку из желудка.
Накопление и концентрация желчи в желчном пузыре. Желчь постоянно секретируется печеночными клетками, но большая ее часть обычно хранится в желчном пузыре до тех пор, пока не понадобится в двенадцатиперстной кишке. Максимальный объем, который может удерживать желчный пузырь, составляет лишь 30-60 мл. Несмотря на 12-часовую секрецию желчи (обычно около 450 мл), она может запасаться в желчном пузыре, поскольку вода, натрий, хлор и многие другие малые электролиты постоянно всасываются через слизистую желчного пузыря, концентрируя остающиеся компоненты желчи (соли желчи, холестерол, лецитин и билирубин).
Большая часть всасывания осуществляется за счет активного транспорта натрия через эпителий желчного пузыря, за которым следует вторичное всасывание ионов хлора, воды и большинство других способных к диффузии компонентов. В результате желчь в норме концентрируется примерно в 5 раз, а максимально она может быть сконцентрирована до 20 раз.
Преобладающими в желчи веществами являются соли желчных кислот, составляющие около половины общего количества растворенного вещества в желчи. Также секретируются и экскретируются в больших концентрациях билирубин, холестерол, лецитин и обычные электролиты плазмы. В процессе концентрации в желчном пузыре вода и большая часть электролитов (исключая ионы кальция) реабсорбируются слизистой желчного пузыря; все другие компоненты, особенно соли желчи и липидные вещества, холестерол и лецитин, существенно не реабсорбируются, и поэтому становятся высококонцентрированными в желчном пузыре.
Печеночные клетки синтезируют около 6 г желчных солей ежедневно. Предшественником желчных солей является холестерол, который не только присутствует в пище, но и синтезируется в печеночных клетках в результате метаболизма жира. Холестерол вначале превращается в холевую кислоту или в хенодиоксихолевую кислоту приблизительно в равных количествах. Эти кислоты, в свою очередь, соединяются в основном с глицином и в меньшей степени — с таурином, образуя глико- и тауроконьюгированные желчные кислоты. Соли этих кислот, в основном соли натрия, секретируются с желчью.
Желчные соли выполняют в кишечном тракте две важные функции. Во-первых, они обладают детергентным свойством в отношении жировой части пищи. Это проявляется в снижении поверхностного натяжения частиц пищи, что позволяет дробить частицы жира на мелкие части при перемешивании в кишечнике. Этот процесс носит название эмульгирования, или детергентной функции желчных солей.
Во-вторых, наиболее важной после детергентной функции является способность желчных солей помогать всасыванию: (1) жирных кислот; (2) моноглицеридов; (3) холестерола; (4) других липидов из кишечного тракта. Они осуществляют это, образуя очень малые физические комплексные соединения с липидами. Эти соединения называют мицеллами, они наполовину растворимы в химусе из-за электрических зарядов желчных солей. Кишечные липиды «транспортируются» в такой форме к слизистой кишечника, где затем всасываются в кровь. При отсутствии желчных солей в кишечном тракте с калом теряется до 40% принятых внутрь жиров, и у человека часто развивается метаболический дефицит, обусловленный потерей этих питательных веществ.

Около 94% желчных солей реабсорбируются в кровь из тонкой кишки, из них около половины — путем диффузии через слизистую в проксимальных отделах тощей кишки, а остальная часть — путем процесса активного транспорта через слизистую кишечника в дистальном отделе подвздошной кишки. Затем они попадают в портальную кровь и поступают назад в печень. Попав в печень, при первом прохождении через венозные синусоиды эти соли всасываются назад печеночными клетками практически полностью и затем повторно секретируются с желчью.
Таким образом, около 94% всех желчных кислот рециркулируются с желчью. В результате эти соли совершают полный круг в среднем 17 раз, прежде чем будут выведены с калом. Небольшие количества желчных кислот, выведенные с калом, возмещаются новыми количествами, постоянно образуемыми печеночными клетками. Эту циркуляцию желчных солей называют энтерогеп.атической циркуляцией желчных солей.
Количество желчи, секретируемой печенью каждые сутки, существенно зависит от наличия желчных солей: чем больше желчных солей в энтерогепатической циркуляции (обычно только около 2,5 г), тем выше уровень желчной секреции. Несомненно, прием внутрь дополнительных желчных солей может увеличить желчную секрецию на сотни миллилитров в сутки. Если желчные соли выделяются наружу через желчную фистулу в течение нескольких суток или недель и не могут быть реабсорбированы из подвздошной кишки, печень компенсаторно увеличивает продукцию желчных солей в 6-10 раз, что в большинстве случаев возвращает уровень секреции желчи к норме. Таким образом, уровень суточной секреции печенью желчных солей активно контролируется наличием (или недостатком) желчных солей в энтерогепатической циркуляции.
Роль секретина в поддержке регуляции секреции желчи. В дополнение к сильному стимулирующему эффекту желчных кислот, активирующих желчную секрецию, гормон секретин, стимулирующий панкреатическую секрецию, увеличивает также секрецию желчи, иногда более чем в 2 раза в течение нескольких часов после еды. Такое увеличение секреции водного раствора, богатого бикарбонатом натрия, почти полностью обусловлено секрецией эпителиальных клеток желчных канальцев и протоков и не является результатом увеличенной продукции самих печеночных паренхиматозных клеток. В свою очередь бикарбонат натрия попадает в тонкий кишечник и совместно с бикарбонатом поджелудочной железы участвует в нейтрализации соляной кислоты из желудка. Таким образом, секретиновый механизм обратной связи нейтрализует дуоденальную кислоту, что обусловлено не только влиянием на панкреатическую секрецию, но также, в меньшей степени, — влиянием на секрецию желчных канальцев и протоков.
елчные соли образуются в печеночных клетках из холестерола плазмы крови. Каждый день в процессе секреции желчных солей из плазмы крови удаляется приблизительно от 1 до 2 г холестерола и секретируется в желчь.
Холестерол практически полностью не растворим в чистой воде, но желчные соли и лецитин в желчи физически соединяются с холестеролом, образуя ультрамикроскопические мицеллы в форме коллоидного раствора. Когда желчь концентрируется в желчном пузыре, желчные соли и лецитин концентрируются вместе с холестеролом, сохраняя холестерол в растворе.
При патологических условиях холестерол может осаждаться в желчном пузыре, в итоге образуя холестероловые камни. Количество холестерола в желчи частично зависит от количества жира, съедаемого человеком, поскольку печеночные клетки синтезируют холестерол как один из продуктов метаболизма жира в организме. По этой причине организм людей, находящихся на протяжении нескольких лет на высокожирной диете, имеет тенденцию к развитию желчных камней.
Воспаление эпителия желчного пузыря, часто возникающее из-за слабовыраженной хронической инфекции, может также изменять всасывающие способности слизистой желчного пузыря, иногда допуская избыточное всасывание воды и желчных солей, но оставляя при этом холестерол в желчном пузыре в более значительных концентрациях.
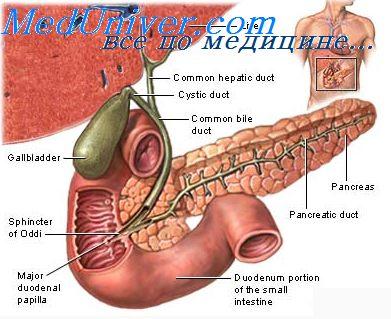
После этого холестерол начинает осаждаться, вначале формируя множество мелких кристаллов холестерола на поверхности воспаленной слизистой, которые затем преобразуются в большие желчные камни.
Секреция в двенадцатиперстной кишке
Обширные скопления сложных слизистых желез, названных железами Бруннера, располагаются в стенке двенадцатиперстной кишки на протяжении первых нескольких сантиметров, главным образом между привратником желудка и фатеровым сосочком, где панкреатический секрет и желчь выделяются в двенадцатиперстную кишку. Эти железы секретируют большое количество щелочной слизи в ответ на: (1) тактильные или раздражающие стимулы слизистой двенадцатиперстной кишки; (2) вагусную стимуляцию, которая повышает секрецию бруннеровых желез одновременно с повышением желудочной секреции; (3) действие гастроинтестинальных гормонов, особенно секретина.
Функцией слизи, выделяемой железами Бруннера, является защита стенки двенадцатиперстной кишки от переваривания ее кислым желудочным соком, поступающим из желудка. К тому же слизь содержит избыток ионов бикарбоната, которые присоединяются к ионам бикарбоната панкреатического сока и печеночной желчи, нейтрализуя соляную кислоту, поступающую в двенадцатиперстную кишку из желудка.
Секреция желез Бруннера подавляется симпатической стимуляцией, поэтому такая стимуляция у очень впечатлительных людей, вероятно, оставляет луковицу двенадцатиперстной кишки незащищенной, и это, возможно, один из факторов, который обусловливает возникновение пептических язв на этом участке желудочно-кишечного тракта приблизительно у 50% пациентов.
По всей поверхности тонкого кишечника расположены маленькие углубления, которые называют криптами Либеркюна. Одна из них представлена на рисунке. Эти крипты залегают между кишечными ворсинками. Поверхность крипт и ворсинок покрыта эпителием, состоящим из клеток двух типов: (1) умеренного количества бокаловидных клеток, которые секретируют слизь для смазывания и защиты поверхности кишечника; (2) большого количества энтероцитов, которые секретируют в криптах большое количество воды и электролитов, а на поверхности прилегающих ворсинок реабсорбируют воду и электролиты вместе с конечными продуктами переваривания.
Кишечная секреция формируется энтероцитами крипт в количестве 1800 мл/сут. Эти секреты в основном представляют собой чистую внеклеточную жидкость и имеют слабощелочное рН в интервале от 7,5 до 8,0. Секрет быстро реабсорбируется ворсинками. Поступление жидкости из крипт в ворсинки обеспечивает водную среду для всасывания веществ из химуса, когда он соприкасается с ворсинками. Таким образом, первостепенной функцией тонкого кишечника является всасывание в кровь нутриентов и продуктов их переваривания.
Механизм секреции жидкости. Точный механизм, контролирующий секрецию жидкости криптами Либеркюна, не известен. Предполагается, что он включает два активных секреторных процесса: (1) активную секрецию ионов хлора в крипты; (2) активную секрецию ионов бикарбоната. Секреция данных ионов вызывает электрический отрицательный заряд в секретируемой жидкости, что обеспечивает движение положительно заряженных ионов натрия через мембрану в секретируемую жидкость. В результате ионы вместе вызывают осмотическое движение воды.
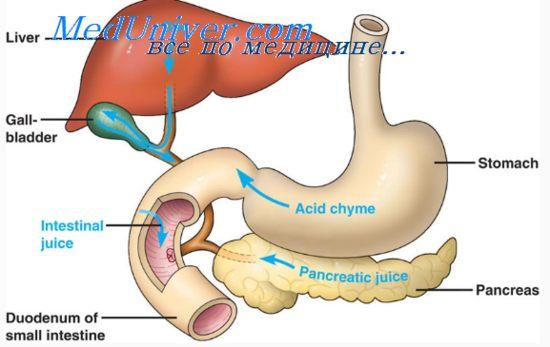
Пищеварительные ферменты в секрете тонкого кишечника. Если собрать секрет тонкого кишечника без клеточных обломков, мы практически не обнаружим там ферментов. Энтероциты слизистой, в особенности те, что покрывают ворсинки, содержат пищеварительные ферменты, переваривающие специфические частицы пищи, пока они всасываются через эпителий. Это следующие ферменты: (1) несколько пептидаз для расщепления небольших пептидов на аминокислоты; (2) четыре фермента — сахараза, мальтаза, изомальтаза и лактаза — для расщепления дисахаридов на моносахариды; (3) небольшое количество кишечной липазы для расщепления нейтральных жиров на глицерин и жирные кислоты.
Эпителиальные клетки, расположенные глубоко в криптах Либеркюна, постоянно подвергаются митозу, и новые клетки перемещаются вдоль базальной мембраны вверх и наружу крипт к верхушке ворсинки. Таким образом происходит непрерывное замещение эпителия ворсинок и формирование новых пищеварительных ферментов. По мере старения клеток ворсинки эпителия в итоге сбрасываются в кишечный секрет. Жизненный цикл эпителиальной клетки кишечника — около 5 сут. Этот быстрый рост новых клеток обеспечивает быстрое восстановление повреждений, которые происходят в слизистой.
Большое значение для регуляции секреции тонкого кишечника имеют местные энтеральные рефлексы, в особенности рефлексы, вызванные тактильными или раздражающими стимулами химуса тонкого кишечника.
очная потребность жиров
Количество жира в пищевом рационе определяется разными обстоятельствами, к которым относят интенсивность труда, климатические особенности, возраст человека. Человек, занятый интенсивным физическим трудом, нуждается в более калорийной пище, следовательно, и в большем количестве жиров. Климатические условия севера, требующие большой затраты тепловой энергии, также вызывают увеличение потребности в жирах. Чем больше расходуется энергия организма, тем большее количество жира нужно для ее восполнения.
Средняя физиологическая потребность в жире здорового человека составляет около 30 % от общей калорийности рациона. При тяжелом физическом труде и соответственно высокой калорийности рациона, обеспечивающей такой уровень энергетических затрат, доля жира в рационе может быть несколько выше - 35 % от общей энергетической ценности.
Нормальный уровень потребления жира составляет примерно 1 -1,5 г/кг, т. е. 70-105 г в день для человека с массой тела 70 кг. В расчет берется весь жир, содержащийся в рационе (как в составе жировых продуктов, так и скрытый жир всех других продуктов). Жировые продукты составляют половину содержания жира в рационе. Вторая половина приходится на так называемые скрытые жиры, т. е. жиры, входящие в состав всех продуктов. Скрытые жиры вводят в те или иные хлебобулочные и кондитерские изделия для улучшения их вкусовых качеств.
С учетом потребности организма в жирных полиненасыщенных кислотах 30% потребляемого жира должны составлять растительные масла и 70% животные жиры. В пожилом возрасте рационально снизить долю жира до 25 % от общей энергетической ценности рациона, которая также уменьшается. Соотношение животных и растительных жиров в пожилом возрасте должно быть изменено до 1:1. Такое же соотношение допустимо при увеличении содержания холестерина в сыворотке крови.
Пищевые источники жиров
ТАГ
|
Продукты, содержащие ненасыщенные жирные кислоты |
Продукты, содержащие мононенасыщенные жирные кислоты |
|
Сливочное масло |
Оливковое масло |
|
Свиной жир |
Арахисовое масло |
|
Кокосовое масло |
Коноплевое масло |
|
Пальмовое масло |
|
ФЛ
|
Продукты, содержащие полиненасыщенные жирные кислоты |
|
|
|
Подсолнечное масло |
|
|
|
Кукурузное масло |
|
|
|
Соевое масло |
|
|
|
Грецкие орехи |
|
|
|
Рыба, рыбий жир |
|
|
|
Высокое содержание Хс |
Умеренное содержание Хс |
|
|
Яичные желтки |
баранина |
|
|
Сметана |
говядина |
|
|
Сыры |
мясо птицы (без кожи) |
|
|
Свинина |
мягкий маргарин |
|
|
Твёрдый маргарин |
|
|
|
Торты, пирожное |
|
|
Содержание холестерина в продуктах питания в мг/100 г
|
Готовые продукты |
Холестерин (мг) |
|
Мозги |
2000 |
|
Почки |
1126 |
|
Печень |
438 |
|
Куриный желудок |
212 |
|
Крабы, кальмары |
150 |
|
Баранина вареная |
98 |
|
Консервы рыбные в собственном соку |
95 |
|
Рыбная икра (красная, черная) |
95 |
|
Говядина вареная |
94 |
|
Сыр жирный 50% |
92 |
|
Куры, темное мясо (ножка, спинка) |
91 |
|
Мясо птицы (гусь, утка) |
91 |
|
Кролик вареный |
90 |
|
Колбаса сырокопченая |
90 |
|
Язык |
90 |
|
Свинина постная вареная |
88 |
|
Шпик, корейка, грудинка |
80 |
|
Куры, белое мясо (грудка с кожей) |
80 |
|
Рыба средней жирности (морской окунь, сом, карп, сельдь, осетр) |
88 |
|
Сырок творожный |
71 |
|
Сыр плавленый и соленые сыры (брынза и др.) |
68 |
|
Креветки |
65 |
|
Колбаса вареная |
60 |
|
Творог жирный 18 % |
57 |
|
Мороженое пломбир |
47 |
|
Мороженое сливочное |
35 |
|
Творог 9% |
32 |
|
Мороженое молочное |
14 |
|
Творог обезжиренный |
9 |
|
Сметана 30 % |
91 |
|
Сметана 20 % |
63 |
Переваривание жиров
Жиры и другие липиды плохо растворимы в воде. Они атакуются ферментами только на границе фаз между водой и липидом. Чем больше эта поверхность, т. е чем лучше эмульгированы жиры, тем легче гидролизуются липиды. Относительно хорошо эмульгирован жир молока. Переваривание жиров начинается уже в желудке благодаря наличию небольших количеств липаз слюны и желудочного сока. Трудноусвояемые липиды, например из блюд, приготовленных из свинины, эмульгируются только в тонком кишечнике с помощью солей желчных кислот и фосфолипидов желчи и атакуются липазами поджелудочной железы.
|
Липазы желудочно-кишечного тракта.
|
||||||||||||||||||
|
|
|||||||||||||||||
Липолитические ферменты проявляют максимальную активность при рН= 7,8-8,2.
У взрослого человека в ротовой полости жиры не подвергаются химическим изменениям из-за отсутствия липолитических ферментов.
Воздействие на жиры липаз становится возможным после эмульгирования жиров, т.к. липиды нерастворимы в воде и они подвергаются воздействию липолитических ферментов только на границе разделе фаз и, следовательно, скорость переваривания зависит от площади этой поверхности. Эмульсия – это дисперсная система двух несмешивающихся жидкостей, из которых одна находится в раздробленном состоянии (в виде капелек) в массе другой. При эмульгировании жиров увеличивается их общая поверхность, что улучшает контакт жира с липазой и ускоряет его гидролиз. В организме основными эмульгаторами являются соли желчных кислот.
В желудке содержание липазы крайне низкое, кроме того, рН желудочного сока (1,0-1,5) не соответствует оптимуму рН липазы (5,5-7,5), и в желудке отсутствуют эмульгаторы жира, поэтому желудочная липаза может расщеплять только предварительно эмульгированные жиры (жиры молока или яичного желтка).
Отделом, в котором переваривается основная часть липидов, является тонкий кишечник, где имеется слабощелочная среда, оптимальная для активности липазы. Нейтрализация попавшей с пищей соляной кислоты осуществляется бикарбонатами, содержащимися в панкреатическом и кишечном соках:
HCl + NaHCO3 →NaCl + H2CO3
Затем выделяется углекислый газ, который вспенивает пищу и способствует процессу эмульгирования.
Н+ + НСО3- → Н2СО3 → Н2О + СО2 ↑.
Эмульгированию также способствуют желчные кислоты, входящие в состав желчи. Они окружают каплю жира и способствуют её дроблению на множество мелких капелек. Таким образом, молекулы жира становятся доступными для действия липаз, содержащихся в соке поджелудочной железы.
Панкреатическая липаза выводится в двенадцатиперстную кишку в виде неактивного профермента - пролипазы. Активация пролипазы в активную липазу происходит под действием жёлчных кислот и другого фермента сока поджелудочной железы - колипазы.
Колипаза попадает в полость кишечника в неактивном виде, и частичным протеолизом под действием трипсина превращается в активную форму. Колипаза гидрофобным доменом связывается с поверхностью эмульгированного жира. Другая часть молекулы колипазы способствует формированию такой конфигурации молекулы панкреатической липазы, при которой активный центр фермента максимально приближен к молекулам жиров, поэтому скорость реакции гидролиза резко возрастает.
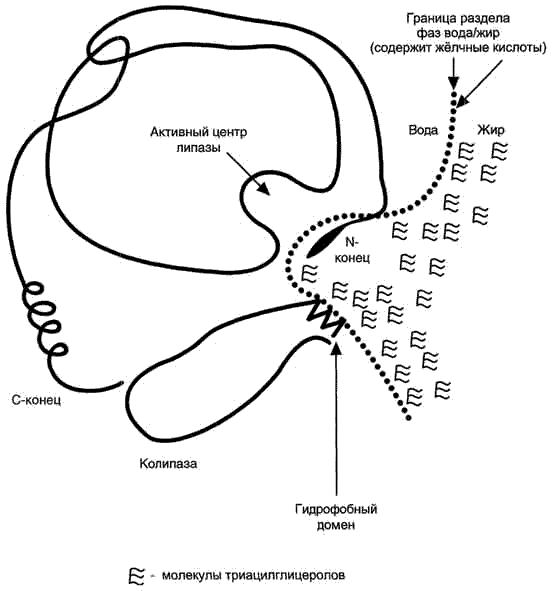
Панкреатическая липаза – гидролаза, отщепляющая с высокой скоростью жирные кислоты из α-положения молекулы, поэтому основными продуктами гидролиза ТАГ являются 2-МАГ и жирные кислоты.
Особенностью панкреатической липазы является то, что она действует ступенчато: сначала отщепляет одну ВЖК в α-положении, и из ТАГ образуется ДАГ, затем отщепляет вторую ВЖК в α-положении, и из ДАГ образуется 2-МАГ.
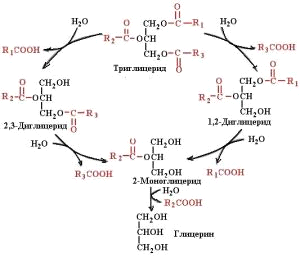
Особенности переваривания ТАГ у грудных детей
У грудных детей и детей младшего возраста основной пищей служит молоко. Молоко содержит жиры, в состав которых входят в основном жирные кислоты с короткой и средней длиной цепей (4-12 атомов углерода). Жиры в составе молока находятся уже в эмульгированном виде, поэтому они сразу же доступны для гидролиза ферментами. На жиры молока в желудке детей действует липаза, которая синтезируется в железах языка (липаза языка). Кроме того, в желудке детей грудного и младшего возраста вырабатывается желудочная липаза, которая активна при нейтральном значении рН, характерном для желудочного сока детей. Эта липаза гидролизует жиры, отщепляя, в основном, жирные кислоты у третьего атома углерода глицерола. Далее гидролиз жиров молока продолжается в кишечнике под действием панкреатической липазы. Жирные кислоты с короткой цепью, как водорастворимые, всасываются частично уже в желудке. Остальные жирные кислоты всасываются в тонком кишечнике.

Переваривание фосфолипидов
В переваривании фосфолипидов участвуют несколько ферментов, синтезирующихся в поджелудочной железе: фосфолипаза А1, А2, С и D.

В кишечнике фосфолипиды подвергаются прежде всего расщеплению с помощью фосфолипазы А2, катализирующей гидролиз сложноэфирной связи во 2 положении, с образованием лизофосфолипида и жирной кислоты.

Фосфолипаза А2секретируется в виде неактивной профосфолипазы, которая активируется в тонкой кишке путём частичного протеолиза трипсином. Коферментом фосфолипазы А2 является Ca2+.
В дальнейшем лизофосфолипид подвергается действию фосфолипазы А1, катализирующей гидролиз сложноэфирной связи в 1 положении, с образованием глицерофосфатидила, связанного с азотсодержащим остатком (серин, этаноламин, холин), который
1) либо расщепляется по действием фосфолипаз C иD до глицерина, H3PO4 и азотистых оснований (холин, этаноламин и т. д.)
2) либо остаётся глицерофолфолипидом (фосфолипазы С и D не работают) и включается в состав мицелл.
Переваривание эфиров холестерола
В составе пищи холестерол находится в основном в виде эфиров. Гидролиз эфиров холестерола происходит под действием холестеролэстеразы - фермента, который также синтезируется в поджелудочной железе и секретируется в кишечник.
Холестеролэстераза вырабатывается в неактивном состоянии и активируется трипсином и Ca2+.Продукты гидролиза (холестерол и жирные кислоты) всасываются в составе смешанных мицелл.

Мицеллообразование
Растворимые в воде глицерин, Н3РО4, жирные кислоты с числом углеродных атомов меньше 10, азотсодержащие вещества всасываются диффузно в воротную вену.
Остальные продукты гидролиза образуют мицеллу, которая состоит из 2-х частей: внутренней — ядра, в которое входят ХС, жирные кислоты с числом углеродных атомов больше 10, МАГ, жирорастворимые витамины и наружной – внешней оболочки, в которую входят соли желчных кислот. Соли желчных кислот гидрофобной группировкой обращены внутрь мицеллы, а гидрофильной – наружу, к диполям воды.
Стабильность мицелл обеспечивается в основном солями жёлчных кислот. Мицеллы сближаются со щёточной каймой клеток слизистой оболочки тонкого кишечника, и липидные компоненты мицелл диффундируют через мембраны внутрь клеток. Вместе с продуктами гидролиза липидов всасываются жирорастворимые витамины A, D, Е, К и соли жёлчных кислот. Наиболее активно соли жёлчных кислот всасываются в подвздошной кишке. Жёлчные кислоты далее попадают через воротную вену в печень, из печени вновь секретируются в жёлчный пузырь и далее опять участвуют в эмульгировании жиров. Этот путь жёлчных кислот называют "энтерогепатическая циркуляция". Каждая молекула жёлчных кислот за сутки проходит 5- 8 циклов, и около 5% жёлчных кислот выделяется с фекалиями.
Всасывание жирных кислот со средней длиной цепи, образующихся, например, при переваривании липидов молока, происходит без участия смешанных мицелл. Эти жирные кислоты из клеток слизистой оболочки тонкого кишечника попадают в кровь, связываются с белком альбумином и транспортируются в печень.

Мицеллы желчных солей выполняют функцию транспортных посредников для переноса моноглицеридов и свободных жирных кислот к щеточной каемке кишечного эпителия, иначе моноглицериды и свободные жирные кислоты будут нерастворимы. Здесь моноглицериды и свободные жирные кислоты всасываются в кровь, а желчные соли высвобождаются обратно в химус, чтобы быть вновь использованными для процесса переноса.
Ресинтез жиров в слизистой оболочке тонкого кишечника
После всасывания продуктов гидролиза жиров жирные кислоты и 2-моноацилглицеролы в клетках слизистой оболочки тонкого кишечника включаются в процесс ресинтеза с образованием триацилглицеролов (рис. 8-16). Жирные кислоты вступают в реакцию этерификации только в активной форме в виде производных коэнзима А, поэтому первая стадия ресинтеза жиров - реакция активации жирной кислоты:
HS КоА + RCOOH + АТФ → R-CO ~ КоА + АМФ + Н4Р2О7.
Реакция катализируется ферментом ацил-КоА-синтетазой (тиокиназой). Затем ацил~КоА участвует в реакции этерификации 2-моноацилглицерола с образованием сначала диацилгли-церола, а затем триацилглицерола. Реакции ресинтеза жиров катализируют ацилтранеферазы.
В реакциях ресинтеза жиров участвуют, как правило, только жирные кислоты с длинной углеводородной цепью. В ресинтезе жиров участвуют не только жирные кислоты, всосавшиеся из кишечника, но и жирные кислоты, синтезированные в организме, поэтому по составу ре-синтезированные жиры отличаются от жиров, полученных с пищей. Однако возможности "адаптировать" в процессе ресинтеза состав пищевых жиров к составу жиров организма человека ограничены, поэтому при поступлении с пищей жиров с необычными жирными кислотами,
385

например бараньего жира, в адипоцитах появляются жиры, содержащие кислоты, характерные для бараньего жира (насыщенные разветвлённые жирные кислоты). В клетках слизистой оболочки кишечника происходит активный синтез глицерофосфолипидов, необходимых для формирования структуры липопротеинов - транспортных форм липидов в крови.

Значение белкового обмена в организме
Белковый обмен занимает особое место в многообразных превращениях веществ, характерных для всех живых организмов. Выполняя ряд уникальных функций, свойственных живой материи, белки определяет не только микро- и макроструктуру отдельных клеточных образований, специфику клеток, органов и целостного организма (пластическая функция), но и в значительной степени динамическое состояние между организмом и окружающей его средой.
Белки способны также выполнять энергетическую функцию, в особенности при избыточном их поступлении с пищей или в экстремальных ситуациях. Когда белки тела подвергаются усиленному распаду, выполняя недостаток питательных веществ, например, при голодании или патологии (при сахарном диабете). Как известно, при сгорании 1 г белков освобождается энергия, равная 4,1 ккал. Эта энергия обычно может быть полностью заменена энергией окисления углеводов и липидов, однако при длительном исключении их из пищи не наблюдается существенных патологических отклонений, тогда как исключение белков из пищи даже на короткий срок приводит к серьезным нарушениям. При недостаточном потреблении белка быстро развивается белковая недостаточность – болезнь, характеризующаяся нарушением ряда важных физиологических функций организма.
Следовательно, белки являются незаменимыми веществами для организма, выполняя пластическую функцию, уникальную каталитическую функцию, которой не наделены ни углеводы, ни жиры, ни какие-либо другие вещества органической природы! Также белки принимают участие в биосинтезе ряда гормонов, регулируя тем самым обмен веществ в организме.
Факторы, определяющие состояние белкового обмена
Состояние белкового обмена определяется множеством факторов, как экзогенных, так и эндогенных:
деятельность ЦНС
обмен белков индуцируется в определенные периоды, когда организму необходимо большее их количество (детский возраст, при активной мышечной работе, беременности и лактации)
характер питания (количественный и качественный белковый состав пищи)
количественный и качественный состав УВ и липидов (т.к. они резко сокращают удовлетворение организмом энергетических потребностей за счет белков)
обеспеченность организма витаминами В1, В2, В6, РР и др.
деятельность желез внутренней секреции (например, после введения АКТГ и тиреотропных гормонов наблюдается интенсивный распад тканевых белков. Ряд других гормонов, в частности СТГ, андрогены и эстрогены, напротив, стимулируют анаболические реакции и способствуют синтезу белка).
Любые отклонения от нормального физиологического состояния организма отражаются на азотистом обмене.
Понятие азотистого баланса
Азотистый баланс – это количественная разница между введением с пищей азота и выведением его в виде конечных продуктов азотистого обмена (г/сут).
Определение азотистого баланса часто используют в клинической практике для оценки обеспеченности больного белковой пищей.
Различают положительный и отрицательный азотистый баланс, а также азотистое равновесие.
Положительный азотистый баланс – количество выводимого из организма азота меньше количества азота, вводимого с пищей. Т.е. азот остается в организме и расходуется на биосинтез высокомолекулярных белковых веществ органов и тканей (анаболические процессы преобладают над катаболическими)
Такое состояние характерно для молодого, растущего организма, а также для женщин во время беременности.
Отрицательный азотистый баланс – количество выделяемого азота превышает количество азота, поступающего в течение суток. Т.е. скорость распада белков преобладает над скоростью синтеза.
Такое состояние встречается при голодании, белковой недостаточности, тяжелых заболеваниях, когда происходит интенсивный распад белков тела у больных, получающих даже полноценную белковую пищу.
Азотистое равновесие – количество азота, теряемого организмом, равно количеству получаемого с пищей азота.
Такое состояние характерно для здорового взрослого человека, находящегося на полноценной диете с нормальным суточным содержанием белка.
Т.о., организм постоянно нуждается в белковой пище, поэтому недостаток белка сопровождается развитием патологии, в конечном счете приводящей к гибели организма. С понятием азотистого баланса тесно связана проблема о нормах белка в питании.
Нормы белка в питании
Нормы белка в питании учитывают разные климатические условия, условия труда, профессию, возраст и другие факторы.
|
Возраст / Степень тяжести труда |
Суточная потребность в белке (г) |
|
Взрослый человек, занимающийся умственным трудом и подвергающийся средней физической нагрузке |
100-120 |
|
Взрослый, выполняющий тяжелую физическую работу |
130-150 |
|
Дети раннего возраста |
55-72 |
|
Дети в возрасте 12-15 лет |
100-120 |
Суточные потребности в белке резко возрастают при беременности и лактации, а также при некоторых патологических состояниях, когда организм теряет белок с мочой или асцистной жидкостью, экссудатами (например, при нефритах, тяжелых инфекционных заболеваниях, ожогах, травмах и т.д.).
Биологическая ценность белков
Состояние белкового обмена зависит не только от количества принимаемого с пищей белка, но и от качественного его состава. Т.к., во-первых, различные белки обладают разной пищевой ценностью (т.е. разным аминокислотным составом), а во-вторых, различные белки обладают разной эффективностью распада под влиянием ферментов ЖКТ.
В организме человека из 20 необходимых аминокислот синтезируются только 10. Другие 10 необходимых аминокислот в организме не синтезируются и для обеспечения нормальной жизнедеятельности должны поступать с пищей – это незаменимые аминокислоты.
Минимальная суточная потребность организма человека в незаменимых аминокислотах, обеспечивающая азотистое равновесие
|
Аминокислота |
Потребность индивидуума, г/сут |
Потребность в расчете на массу тела, в мг/кг |
|
Арг |
1,8 |
Взрослый организм не нуждается |
|
Гис |
0,9 |
|
|
Иле |
0,7 |
10 |
|
Лей |
1,1 |
14 |
|
Лиз |
0,8 |
12 |
|
Мет |
1,1 |
13 |
|
Фен |
1,1 |
14 |
|
Тре |
0,5 |
7 |
|
Трп |
0,25 |
3,5 |
|
Вал |
0,80 |
10 |
Исключение какой-либо незаменимой аминокислоты из пищевой смеси сопровождается развитием отрицательного азотистого баланса, истощением, остановкой роста, нарушениями со стороны нервной системы и др.
Но в природе «неполноценных» белков, не содержащих незаменимые аминокислоты, практически не существует, поэтому следует лишь различать более ценные и менее ценные в питательном отношении белки.
Содержание незаменимых аминокислот в белках различного происхождения
|
Аминокислота |
Содержание (в % на сухую массу) |
|||||
|
пшеничная мука |
соевая мука |
рыбная мука |
говядина |
коровье молоко |
кормовые дрожжи |
|
|
Арг |
4,2 |
4,7 |
5,0 |
7,7 |
4,1 |
8,0 |
|
Гис |
2,2 |
2,4 |
2,3 |
3,3 |
2,6 |
1,7 |
|
Иле |
4,2 |
5,4 |
4,6 |
6,0 |
7,8 |
5,5 |
|
Лей |
7,0 |
7,7 |
7,8 |
8,0 |
11,0 |
7,6 |
|
Лиз |
1,9 |
6,5 |
7,5 |
10,0 |
8,7 |
6,8 |
|
Мет |
1,5 |
1,4 |
2,6 |
3,2 |
0,8 |
1,2 |
|
Фен |
5,5 |
5,1 |
4,0 |
5,0 |
5,5 |
3,9 |
|
Тре |
2,7 |
4,0 |
4,2 |
5,0 |
4,7 |
5,4 |
|
Трп |
0,8 |
1,5 |
1,2 |
1,4 |
1,5 |
1,6 |
|
Вал |
4,1 |
5,0 |
5,2 |
5,5 |
7,1 |
6,0 |
Биологическая ценность пищевого белка целиком зависит от степени его усвоения организмом, что в свою очередь определяется соответствием между аминокислотным составом потребляемого белка и аминокислотным составом белков тела. Такой белок лучше используется организмом для синтеза белков тканей. Для человека, например, белки мяса, молока, яиц биологически более ценны, поскольку их аминокислотный состав ближе к аминокислотному составу органов и тканей человека. Но это не исключает приема растительных белков, в которых содержится необходимый набор аминокислот, но в другом соотношении.
Переваривание белков
Весь сложный процесс переваривания пищевых белков в ЖКТ настроен на то, чтобы под действием протеолитических ферментов лишить белки видовой и тканевой специфичности, т.е. строго избирательно расщепить пептидные связи белковой молекулы вплоть до конечных продуктов гидролиза белков – свободных аминокислот, тем самым дать им возможность всасываться в кровь через стенку кишечника.
Несмотря на то, что человек с пищей получает огромное разнообразие белков, все они подвергаются воздействию ограниченного числа протеиназ. Эти ферменты относятся к классу гидролаз и часто называются также пептидазами. Известны 2 группы пептидаз: экзопептидазы и эндопептидазы.
 Пептидазы
Пептидазы
Эндопептидазы Экзопептидазы
|
Эндопептидазы (катализируют разрыв пептидной связи внутри полипептидной цепи) |
● пепсин вырабатывается в клетках слизистой оболочки желудка в неактивной форме – в виде пепсиногена. Активация пепсиногена происходит в несколько этапов в присутствии соляной кислоты по механизму аутокаталитического действия самого пепсина с отщеплением пептидных фрагментов. Пепсин гидролизует преимущественно пептидные связи, образованные аминогруппами ароматических аминокислот. Он расщепляет практически все природные белки за исключением некоторых кератинов, протаминов, гистонов и мукопротеинов.
● трипсин вырабатывается клетками поджелудочной железы в неактивной форме – в виде трипсиногена. Активацию трипсиногена катализирует не только энтеропептидаза и сам трипсин, но и другие протеиназы и ионы Ca2+. Активирование химически выражается в отщеплении с N-конца полипептидной цепи 6 аминокислотных остатков и соответственно укорочении полипептидной цепи. При этом происходит формирование активного центра и образование трехмерной структуры трипсина.
● химотрипсин синтезируется в поджелудочной железе в виде ряда химотрипсинов (α-, δ-, π-химотрипсины) и двух предшественников – химотрипсиногена А и химотрипсиногена В. Активируются проферменты в кишечнике под действием активного трипсина и химотрипсина. Химотрипсин обладает более широкой субстратной специфичностью, чем трипсин. Он катализирует гидролиз не только принимают участие карбоксильные группы ароматических аминокислот – фенилаланина, тирозина и триптофана.
● эластаза синтезируется в поджелудочной железе в виде проэластазы. Активация фермента происходит под действием трипсина. Название фермент получил от субстрата эластина, содержащегося в соединительной ткани, который он гидролизует. Эластаза обладает широкой субстратной специфичностью, но предпочтительнее гидролизует пептидные связи, образованные аминокислотами с небольшими гидрофобными радикалами, в частности глицином, аланином и серином.
|
|
Экзопептидазы (катализируют разрыв пептидной связи с отщеплением одной какой-либо концевой аминокислоты) |
● карбоксипептидазы подробно изучены две карбоксипептидазы – А и В, катализирующие отщепление от полипептида С-концевых аминокислот. Карбоксипептидаза А разрывает преимущественно пептидные связи, образованные концевыми ароматическими аминокислотами, а карбоксипептидаза В – связи, в образовании которых участвуют С-концевые лизин и аргинин.
● аминопептидазы в кишечном соке открыты два фермента – аланинаминопептидаза, преимущественно катализирующая гидролиз пептидной связи, в образовании которой участвует N-концевой аланин, и лейцинаминопептидаза, не обладающая строгой субстратной специфичностью и гидролизующая пептидные связи, образованные любой N-концевой аминокислотой. Оба фермента осуществляют ступенчатое отщепление аминокислот от N-конца полипептидной цепи.
● дипептидазы дипептидазы завершают процесс переваривания пептидов, расщепляя их в тонком кишечнике до свободных аминокислот.
|
Переваривание белков в желудке
Переваривание белков в желудке происходит под действием желудочного сока. Основными компонентами желудочного сока являются соляная кислота и пепсин.
Соляная кислота
Соляная кислота вырабатывается обкладочными (париетальными) клетками желудочного эпителия. Источником Н+ является H2CO3, которая образуется в обкладочных клетках из СО2, диффундирующего из крови. Образовавшийся бикарбонат выделяется в плазму в обмен на Cl- и Н+, который поступают в просвет желудка путем активного транспорта за счет Н+/K+ - АТФазы.

Значение HCl:
1) переводит неактивный пепсиноген в активный пепсин
2) создает оптимальную среду для действия пепсина (рН = 1,0-2,5)
3) в присутствии соляной кислоты происходит набухание белков (увеличение поверхности соприкосновения фермента с субстратом), частичная денатурация и гидролиз сложных белков
4) стимулирует выработку секретина
5) ускоряет всасывание железа
6) оказывает бактерицидное действие
*В диагностических целях используют определение кислотности желудочного сока. Кислотность желудочного сока (ТЕ) – количество 0,1 М NaOH в 1 мл, затраченное на титрование 100 мл желудочного сока по определенному индикатору. При определении кислотности различают: общую кислотность, связанную HCl и свободную HCl.
Общая кислотность желудочного сока – совокупность всех кислотреагирующих веществ желудочного сока, представляет собой секрет желудка, собираемый в течение 1 ч. В норме 40-60 ТЕ.
Связанная соляная кислота – HCl, связанная с белками и продуктами их переваривания. В норме составляет 20-30 ТЕ.
Свободная соляная кислота – HCl, не связанная с компонентами желудочного сока. В норме 20-4- ТЕ.
Пепсин
Под действием гастринов в главных клетках желудочного эпителия стимулируется синтез и секреция пепсиногена – неактивной формы пепсина. Пепсиноген представляет собой белок, состоящий из одной полипептидной цепи. Под действием соляной кислоты превращается в пепсин.
Образовавшийся активный пепсин быстро активирует остальные молекулы пепсиногена (аутокатализ).
Значение пепсина:
Пепсин – эндопептидаза, поэтому в результате его действия в желудке образуются более короткие пептиды, но не свободные аминокислоты. Пепсин в первую очередь гидролизует пептидные связи в белках, образованных ароматическими аминокислотами и несколько медленнее – образованных лейцином и дикарбоновыми аминокислотами.
Переваривание белков в кишечнике
Желудочное содержимое (химус) в процессе переваривания поступает в 12-перстную кишку. Низкое значение рН химуса вызывает в кишечнике выделение белкового гормона секретина, поступающего в кровь. Этот гормон стимулирует выделение из поджелудочной железы в тонкий кишечник панкреатического сока, содержащего HCO3-, что приводит к нейтрализации HCl желудочного сока и ингибированию пепсина. В результате рН резко возрастает от 1,5-2,0 до 7,0.
В поджелудочной железе синтезируются ферменты ряда протеаз: трипсиноген, химотрипсиноген, проэластаза, прокарбоксипептидазы А и В.
энтеропептидаза
А
 ктивация
трипсиногена: трипсиноген
трипсин
ктивация
трипсиногена: трипсиноген
трипсин
Вал-(Асп)4-Лиз
Все остальные проферменты панкреатических протеаз активируются трипсином путем частичного протеолиза.
Например, трипсин активирует химотрипсиноген, из которого получается несколько активных ферментов. Химотрипсиноген состоит из одной полипептидной цепи, содержащей 245 аминокислотных остатков и пяти дисульфидных мостиков. Под действием трипсина расщепляется пептидная связь между 15-й и 16-й аминокислотами, в результате чего образуется активный π-химотрипсин. Затем под влиянием π-химотрипсина отщепляется дипептид сер(14)-арг(15), что приводит к образованию δ-химотрипсина. Отщепление дипептида тре(147)-арг(148) завершает образование стабильной формы активного фермента – α-химотрипсина, который состоит из трех полипептидных цепей, соединенных дисульфидными мостиками.


Последний этап переваривания белков в кишечнике – гидролиз небольших пептидов, происходит под действием ферментов аминопептидаз и дипептидаз, которые синтезируются клетками тонкого кишечника в активной форме. В результате последовательного действия всех пищеварительных протеаз большинство пищевых белков расщепляется до свободных аминокислот.
Контрольные вопросы
Какое соотношение между белками, жирами и углеводами считается оптимальным в суточном рационе
Какие вещества пищевого рациона называются эссенциальными
В чем состоит сущность пищеварения в обмене веществ
Что является конечным продуктом при переваривании белков
Как аминокислоты поступают через стенку кишечника
Что является конечным продуктом при переваривании углеводов
Как моносахариды поступают через стенку кишечника
Назовите продукты переваривания хромопротеинов
Как всасываются продукты переваривания хромопротеинов через стенку кишечника
Назовите конечные продукты переваривания триацилглицеридов
Назовите конечные продукты переваривания фосфолипидов
Назовите конечные продукты переваривания стеридов
Как поступают конечные продукты переваривания липидов через стенку кишечника
Что такое мицелла
Какими свойствами обладает мицелла и почему
Что такое желчные кислоты
Из чего образуются желчные кислоты
Какими свойствами обладают желчные кислоты
Какие продукты питания являются оптимальными по содержанию полноценного белка
Какие продукты питания являются поставщиками сахарозы
Какие продукты питания являются поставщиками лактозы
Какие продукты питания являются поставщиками крахмала
Какие продукты питания являются поставщиками фруктозы
Какие продукты питания являются поставщиками глюкозы
Почему некоторые продукты называют «с высоким содержанием ЛегкоПереваримых Углеводов (ЛПУ)»
Почему некоторые продукты называют « содержащие сложные углеводы»
Каким группам людей следует употреблять углеводы ЛПУ, а каким – их ограничивать
В чем состоит польза употребления в пищу сложных углеводов
Кому следует ограничивать употребление в питании пищи с преобладанием сложных углеводов
. Суточное выделение желчи у взрослого человека составляет 500-700 мл. Желчь обеспечивает эмульгирование жиров, растворение продуктов их гидролиза, активацию панкреатических и кишечных ферментов, регуляцию моторики и секреции тонкого кишечника, регуляцию секреции поджелудочной железы, регуляцию желчеобразования, нейтрализацию кислой среды и инактивацию трипсина. Кроме того, она участвует во всасывании жирных кислот, образуя с ними растворимые в воде комплексы, которые всасываются в клетки слизистой кишечника, где происходят распад комплексов и поступление кислот в лимфу.
Расщепляться жиры пищи начинают в 12-перстной кишке. Здесь для их переваривания созданы особые условия: из поджелудочной железы поступает фермент липаза, а из желчного пузыря - желчь, содержащая желчные кислоты. Желчные кислоты эмульгируют липиды, что увеличивает поверхность раздела водной фазы и жировых капель. Они также стабилизируют жировую эмульсию. На поверхности мельчайших капель жира адсорбируется фермент липаза, она и осуществляет распад (гидролиз) жира. Активируется этот фермент желчными кислотами. Особенно легко переваривается жир молока, так как представляет собой готовую эмульсию.
При распаде жира пищи образуются глицерин и жирные кислоты. Глицерин всасывается в кровь, а желчные кислоты кооперируются с жирными, образуя мицеллы, которые и поступают в клетки слизистой оболочки тонкой кишки.
Жирные кислоты с числом углеродных атомов менее 10 (присутствуют в изрядном количестве в сливочном масле) сразу поступают в кровеносные сосуды кишечника и затем в печень, где используются в различных реакциях обмена веществ. Вот почему сливочное масло - легкоусвояемый продукт. Длинноцепочные жирные кислоты задерживаются в клетках ворсинок тонкого кишечника, где служат строительным материалом для новых липидов. Это вновь синтезированные, уже ставшие «своими» липиды соединяются с транспортными белками, формируя белково-липидные комплексы. Называются они хиломикронами. Хиломикроны поступают в лимфатическую систему кишечника, затем в малый круг кровообращения, т. е. сначала в легкие, а затем - в другие органы.
При панкреатитах и распространенном раке поджелудочной железы, а также при воспалительных заболеваниях желчного пузыря и опухолях печени, затрудняющих отток желчи, переваривание жиров нарушается. Для этих заболеваний характерно появление болей в верхней половине живота. Живот обычно вздут. Стул - жидкий, зловонный, глинистой консистенции. В кале обнаруживаются остатки непереваренного жира (стеаторея). Плохо всасываются жирорастворимые витамины, что приводит к развитию гиповитаминозных состояний. Особенно опасно полное прекращение выделения желчи в результате закупорки желчного протока камнем или сдавливания его опухолью (механическая желтуха). В этом случае спасает только оперативное вмешательство.
Можно составить меню таким образом, что количество жира в нем будет очень низким. И хотя жировые клетки способны синтезировать жир из глюкозы, этого будет для организма явно недостаточно. Все дело в том, что при низкожировой диете организм получает мало ненасыщенных жирных кислот, в том числе незаменимых (витамина F). Из-за этого в ближайшие месяцы разовьются симптомы недостаточности витамина F. Они проявляются нарушением структуры и функции всех клеточных мембран, ухудшением регенерации (восстановления структуры) тканей. В крови задерживаются триглицериды и повышается содержание холестерина; увеличивается ломкость кровеносных капилляров. Особенно страдает нервная система: нарушается проводимость нервных волокон, гибнут нервные клетки. Ухудшается память. Изменяется кожа: она становится сухой, шелушится, воспаляется. Дегенеративным изменениям подвергается эпителий мочеполовой системы и слизистой оболочки желудочно-кишечного тракта.
Но и явное предпочтение растительных масел, т.е. ненасыщенных жирных кислот, в ущерб животным жирам (насыщенным) нежелательно во многих отношениях. Ведь ненасыщенные жирные кислоты - неустойчивые соединения. Они легко окисляются кислородом с образованием перекисных продуктов. Подобный процесс - ПОЛ (перекисное окисление липидов) происходит и в клеточных мембранах. Чем больше в биомембрану включается ненасыщенных жирных кислот, тем больше шансов, что такая мембрана быстрее погибнет из-за накопления в ней продуктов ПОЛ. Кроме того, при избыточном употреблении растительных масел, особенно рафинированных, в организме создается дефицит витаминов-антиоксидантов.
Недостаток антиоксидантов снижает устойчивость организма к радиации и подготавливает почву для развития рака. Крайне вредно для здоровья прогорклое масло, в котором вообще нет никаких антиоксидантов, зато предостаточно токсичных перекисей жирных кислот.
В эксперименте на грызунах показано, что избыток ненасыщенных липидов (кормление растительным маслом) замедляет рост животных, ведет к жировой инфильтрации печени и почек, вызывает экссудативный диатез, сокращает продолжительность жизни животных. В основе всего этого лежит нарушение жирнокислотного состава мембран клеток.
Пристрастие к жирной пище ведет к энергетической избыточности рациона, к ожирению. Растительные же масла отличаются особо высокой калорийностью, ибо усваиваются легче животных жиров. Желательно ограничиться 25-30 г растительного масла в день.
Потребность в жирах сильно зависит от энергетических затрат. Например, пенсионеру на отдыхе их надо намного меньше, чем спортсмену. Смена образа жизни с активного на сидячий при отсутствии компенсирующего снижения потребления пищи будет приводить к увеличению массы тела. В целом суточный рацион питания должен содержать до 30% жиров, при этом количество насыщенных и ненасыщенных должно быть приблизительно одинаковым.
Даже однократный прием большого количества жирной пищи может вызвать приступ острого панкреатита, расстройство пищеварения или нарушение функции печени.
При длительном чрезмерном употреблении жиров в крови постоянно поддерживается высокий уровень триглицеридов (нейтрального жира) и холестерина. Клетки печени не успевают все это переработать и заполняются жировыми каплями, некоторые из них гибнут (жировая дистрофия печени). Обезвреживающая функция органа нарушается.
Избыточное количество жирных кислот увеличивает наклонность тромбоцитов к агрегации (склеиванию), что создаст почву для формирования внутрисосудистых тромбов. А это причина инфаркта и инсульта, тем более что у полных лиц почти всегда повышено артериальное давление: ведь сердцу приходится затрачивать большие усилия, чтобы протолкнуть кровь через многочисленные узкие сосуды жировой ткани.