
3.3.4. Эмиссионная фотометрия
Спектры испускания, или эмиссионные, получают при возбуждении атомов различными способами (тепловыми столкновениями, фотонами, электронным ударом и т.д.). Время жизни возбужденного состояния невелико и составляет 10-7-10-8 с. В течение этого времени атом теряет избыточную энергию путем испускания кванта электромагнитного излучения. На рисунке представлены спектры испускания и спектры поглощения атомов натрия, водорода и гелия.

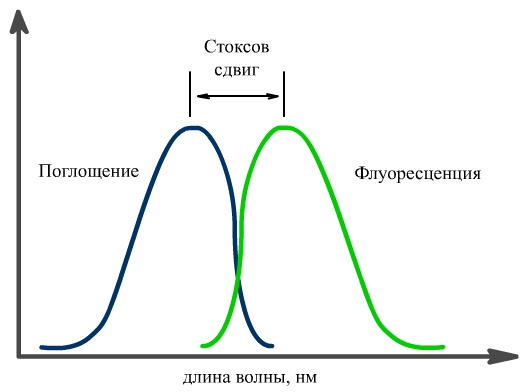
Аналогичные спектры неатомизированных веществ, как уже обсуждалось в теме атомно-асборбционной фотометрии, имеют более широкие полосы, но также сдвинуты друг относительно друга (длина волны, соответствующая максимуму спектра поглощения, меньше длины волны, соответствующей максимуму спектра испускания).
Люминометрия и флуориметрия
Излучение (испускание) света молекулами – люминесценция – может происходить при передаче энергии им в различных процессах:
- воздействие потоком электронов (катодными лучами) – катодолюминесценция;
- тепловой нагрев – термолюминесценция;
- химические реакции – хемилюминесценция;
- воздействие электрическим током – электролюминесценция;
- ультразвуковое воздействие – сонолюминесценция;
- воздействие механическим трением – триболюминесценция;
- облучение ионизирующей радиацией – радиолюминесценция;
- облучение ультрафиолетовым и видимым светом – фотолюминесценция или флуоресценция.
В биомедицинских аналитических исследованиях, в основном, используют флуоресценцию и хемилюминисценцию.
Как уже отмечалось, в основе явления люминесценции лежат процессы поглощения энергии с последующим излучением фотонов. Механизм проявления эффекта люминесценции показан на рисунке.
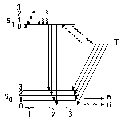
Схема энергетических уровней внутримолекулярных переходов:
1 - абсорбция; 2 - флуоресценция; 3 - фосфоресценция; а - излучательные переходы; б - безызлучательные переходы.
Молекула, находившаяся в основном состоянии S0, в результате поглощения энергии переходит в состояние возбуждения S1 с уровнями колебаний 0', 1' и т. д. Возбужденная молекула через 10-7–10-8 с возвращается в основное состояние, испуская флуоресцентное излучение. Так как чаще всего обратный переход происходит с самого низкого уровня колебаний в возбужденном состоянии на самый высокий уровень колебаний основного состояния, длина волны флуоресцентного излучения больше, чем возбуждающего излучения (правило Стокса).
За счет рассеяния энергии без излучения возможен переход из возбужденного состояния S1 в метастабильное состояние Т, которое имеет продолжительность жизни от 10-3 до нескольких секунд. Излучательный переход из метастабильного состояния называют фосфоресценцией. Она находится в области еще более длинных волн, чем флуоресценция, и продолжается относительно долго после прекращения воздействия.
Явление флуоресценции получило свое название от природного минерала – флюорита CaF2, у которого оно впервые наблюдалось. Веществами, способными к свечению – флуорофорами – являются такие биологические соединения как триптофан, тирозин, фенилаланин, нуклеотиды (НАДН, НАДФ-Н), флавины, порфирины, хлорофиллы, каротиноиды, некоторые витамины, окисленные липиды, белки и другие. В качестве меток при проведении флуофесцентного и люминисцентного анализа часто используются флуорофоры и люминофоры, примеры которых представлены на рисунке:
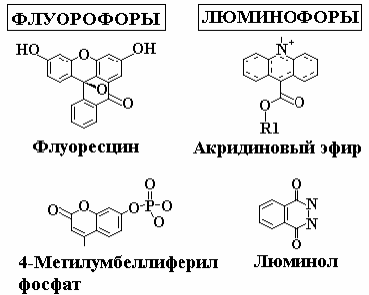
Флуоресцентные метки (флуорофоры) широко используются в биохимии, биотехнологии, клеточной биологии и биологии развития в качестве маркеров экспрессии генов и локализации белков в различных биологических системах, а также их взаимодействий с окружающей средой. Для проведения исследования флуорофор прикрепляется к изучаемому белку.
