
3.0. Обработка экспериментальных данных.
3.1.Для сильной кислоты нСl:
Сформируйте таблицу 2 опытных и расчетных данных. Обработку ведите для 10-15 точек во всем интервале концентраций.
1.Если начальные показания датчика объема жидкого реагента Vначотличны от нуля, сделайте поправку на добавленный объем кислоты:V*= V-Vнач., гдеV– объем добавленной кислоты. Занесите в таблицу 2.
2.Рассчитайте молярную концентрацию электролитасэл-та для каждой экспериментальной точки по формуле
сэл-та = (0,01.V0 +1.V*)/(V0+V*), (16)
где V0 – исходный объем 0,01 М раствора кислоты (50 мл),V*– объем добавленного 1 М раствора электролита с учетом поправки.
3.Рассчитайте ионную силу раствора Iдля каждой из концентрацийсэл-та по формуле (3). Запишите в таблицу 2.
4.Определите коэффициенты активности ионов водорода по правилу ионной силы или по таблице 1 или по формулам (4). Запишите в таблицу.
5.Рассчитайте активности ионов водорода в растворе.
6. Рассчитайте теоретическое значение рН растворов по формуле (12). Запишите в соответствующий столбец.
5.Постройте на одном графике зависимости рН от сэл-тадля рН экспериментального и теоретического.
6. Рассчитайте отклонение от рН теоретического (ΔрН).
Таблица 2
|
Кислота |
V, мл |
V*, мл |
сэл-та моль/л |
pHэксп |
Iр-ра |
Н+ |
aH+ |
pHтеор |
ΔрН |
|
НСl |
… … … … |
|
|
|
|
|
|
|
|
3.2.Для слабой кислотыСн3соон:
Сформируйте таблицу 3 опытных и расчетных данных. Обработку ведите 10-15 точек во всем интервале концентраций.
Таблица 3
|
Кислота |
V, мл |
V*, мл |
сэл-та моль/л |
pHэксп
|
эксп |
теор |
∆
|
pHтеор
|
ΔрН |
КД эксп |
|
СН3СООН |
… … … |
|
|
|
|
|
|
|
|
|
1.Если начальные показания датчика объема жидкого реагента Vначотличны от нуля, сделайте поправку на добавленный объем кислоты:V*= V-Vнач., гдеV– объем добавленной кислоты. Занесите в таблицу 3.
2. Рассчитайте молярную концентрацию электролитасэл-та для каждой экспериментальной точки по формуле
сэл-та = (0,01.V0 +1.V*)/(V0+V*),
где V0 – исходный объем 0,01 М раствора кислоты (50 мл),V*– объем добавленного 1 М раствора электролита с поправкой на начальный объем датчика.
3. Постройте график зависимости pHизмерот сэл-та.
4.Рассчитайте степень диссоциации на основе измеренного значения рН:
эксп=СН+/Сэл-та, гдеСН+= 10-рН.
5. Рассчитайте теоретическое значение
степени диссоциации по приближенной
формуле Оствальда: КД2/Сэл-та,теор=
![]() ,гдеКД– табличная величина.
,гдеКД– табличная величина.
6. Рассчитайте Δ=теор-эксп.
7.Рассчитайте теоретическое значение рН
рНтеор= -lgcH+ = -lg(теор∙сэл-та)
8. Рассчитайте ΔрН =pHрасч-pHизмер.
9.На графике, построенном в пункте 3, отложите точки теоретических величин рН.
10.Рассчитайте значение константы диссоциации из экспериментальных данных рН.
Диссоциация уксусной кислоты: СН3СООН ↔ СН3СОО- + Н+
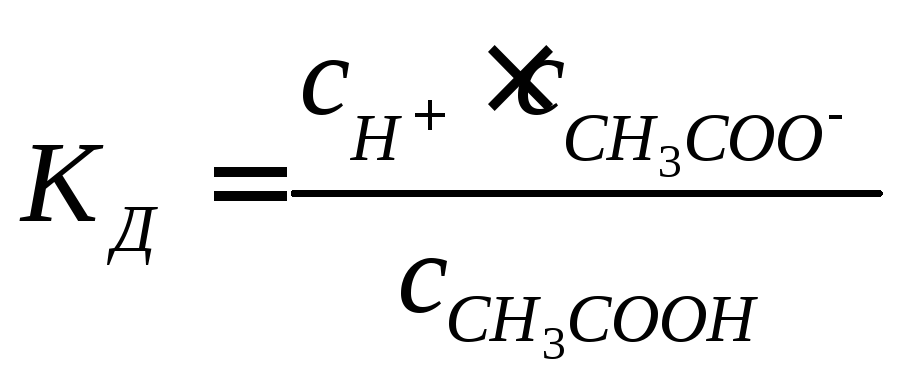 ,гдеСН+ =ССН3СОО-=10-рН, ССН3СООН =Сэл-та- 10-рН, следовательно,
,гдеСН+ =ССН3СОО-=10-рН, ССН3СООН =Сэл-та- 10-рН, следовательно,
![]()
11. Рассчитайте усредненное значение константы КД средн как среднее арифметическое всех значений и сравните с теоретическим значением.
