
- •Коллоидная химия
- •Молекулярно – кинетические свойства
- •Седиментационное диффузионное равновесие.
- •Оптические Свойства. Светорассеяние и Светопоглощение.
- •Светопоглощение.
- •Поверхностные явления.
- •Смачивание. Растекание. Кагезия. Адгезия.
- •Методы измерения поверхностного натяжения.
- •Адсорбция.
- •Взаимодействия при физической адсорбции.
- •Фундаментальное адсорбционное уравнение.
- •Термодинамика. Адсорбция.
- •Уравнение Генри
- •Основы термодинамики дисперсных систем
Смачивание. Растекание. Кагезия. Адгезия.
Смачивание – это явление взаимодействия жидкости с твердым или жидким телом при наличии границы раздела трех фаз.
У гол
между поверхностями ж/г и тв/ж называется
краевым углом смачивания (θ).
гол
между поверхностями ж/г и тв/ж называется
краевым углом смачивания (θ).
Для капли, находящейся
в состоянии равновесия справедливо:
![]()
![]()
![]()
![]() - Уравнение
Юнга.
- Уравнение
Юнга.
В зависимости от значения краевого угла, может быть 3 ситуации:
1) θ < 900 – смачивание
2) θ > 900 – несмачивание
3) θ – не устанавливается
![]()
Работа растекания – это энергия, которая выделяется при покрытии поверхности тонким слоем жидкости или это сила, действующая к поверхности вдоль всей поверхности контакта.
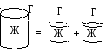
![]() - работа Кагезии
- работа Кагезии
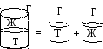
![]() - работа Адгезии
- работа Адгезии
Кагезия – это взаимодействие между частицами одной фазы. Это работа, которую необходимо затратить на разрыв фазы, отнесенная к единице поверхности разрыва.
Работа адгезии
затрачивается на образование двух новых
поверхностей
![]() и
и![]() и выигрывается за счет исчезновения
поверхности твердое тело-жидкость.
и выигрывается за счет исчезновения
поверхности твердое тело-жидкость.
![]()
![]()
А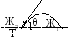 дгезионные
силы возникают на расстояниях, сопоставимых
с молекулярными. Сила взаимодействия
определяется наличием реакционноспособных
групп и энергетическим состоянием
поверхности.
дгезионные
силы возникают на расстояниях, сопоставимых
с молекулярными. Сила взаимодействия
определяется наличием реакционноспособных
групп и энергетическим состоянием
поверхности.
Угол θ характеризует «фильность» поверхности и откладывается в боле полярную фазу.
Для этой картины
условия равновесия:
![]()
Теплота смачивания (НСМ) – это количество энергии, которое выделяется при смачивании единицы поверхности.
Для характеристики
поверхности используют соотношение:
![]()
НВ – теплота смачивания водой, НМ – теплота смачивания поверхности маслом.
Если
![]() >1
– поверхность гидрофильная, если
>1
– поверхность гидрофильная, если![]() <1
– гидрофобная.
<1
– гидрофобная.
Кварц ~2, крахмал ~20, активированный уголь ~ 0,4
Коэффициент
шероховатости
– отношение поверхности истинной к
поверхности геометрической.
![]() ,
,![]()
Шероховатость поверхности увеличивает как явление смачиваемости, так и явление несмачиваемости.
Е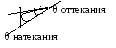 сли
поверхность не ровная (шероховатая),
возможно установление нескольких
краевых углов.
сли
поверхность не ровная (шероховатая),
возможно установление нескольких
краевых углов.

Твердое тело
растворяется в жидкости:
![]()
Методы измерения поверхностного натяжения.
|
Статическое Методы, основанные на изучении статического равновесия
|
Полустатические
n nX – для измеряемой 2. Метод Дю-Нуи
3.
Метод избыточных давлений.
|
Динамические методы: метод колеблющихся струй.
Адсорбция.
Возникает в результате стремления системы уменьшить свою поверхностную энергию
![]() - принцип Кюри
- принцип Кюри
Адсорбцией называется процесс перераспределения компонента между объемной фазой и поверхностным слоем.
В случае химической адсорбции иногда поверхностная энергия может возрастать на фоне общего уменьшения энергии системы.
Адсорбент – более плотная фаза, адсорбат – перераспределяющийся компонент.
Выделяют адсорбцию на границах: Т-Г, Т-Ж, Ж-Г.
Для характеристики адсорбции применяют две величины:
А – полная адсорбция – это количество адсорбата в поверхностном слое, отнесенное к единице массы или площади адсорбента. Может измеряться в моль/м2, моль/кг, г/кг и т.д.
Г – «гамма» - избыточная адсорбция (гипсовская) – это избыток адсорбата в поверхностном слое по сравнению с таким же объемом фазы, отнесенной к единице поверхности или массы адсорбента.
Г<А
Десорбция – это процесс, обратный адсорбции.
Помимо химической адсорбции существует адсорбция физическая, которая отличается меньшей прочностью связей.
Физическая адсорбция осуществляется за счет действия сил Ван-дер-Ваальса:
|
Дисперсионное взаимодействие (Силы Лондона) Всеобщие. Флуктуация электронной плотности в одном атоме порождает флуктуация электронной плотности в другом. (неполярное-неполярное) |
Электростатическое взаимодействие (силы Кеезона) 2 диполя ориентируются по отношению друг к другу определенным образом. (полярное-полярное) |
Индукционное взаимодействие (силы Дебая) Дипольный момент в полярном веществе индуцирует дипольный момент в неполярном. (полярное- неполярное) |


 0
– число капель для стандартной жидкости
0
– число капель для стандартной жидкости