
- •Коллоидная химия
- •Молекулярно – кинетические свойства
- •Седиментационное диффузионное равновесие.
- •Оптические Свойства. Светорассеяние и Светопоглощение.
- •Светопоглощение.
- •Поверхностные явления.
- •Смачивание. Растекание. Кагезия. Адгезия.
- •Методы измерения поверхностного натяжения.
- •Адсорбция.
- •Взаимодействия при физической адсорбции.
- •Фундаментальное адсорбционное уравнение.
- •Термодинамика. Адсорбция.
- •Уравнение Генри
- •Основы термодинамики дисперсных систем
Поверхностные явления.
С
 остояние
молекул жидкости на поверхности и внутри
объема различно. В отличие от твердых
тел, молекулы жидкости не закреплены в
узлах кристаллической решетки. Молекула
в объеме фазы испытывает большее число
межмолекулярных взаимодействий по
сравнению с молекулой, которая находится
на границе раздела фаз. Молекулы,
находящиеся у поверхности, обладают
избыточной поверхностной энергией. Для
того, чтобы образовать единицу поверхности,
необходимо совершить работу и разорвать
межмолекулярные связи.
остояние
молекул жидкости на поверхности и внутри
объема различно. В отличие от твердых
тел, молекулы жидкости не закреплены в
узлах кристаллической решетки. Молекула
в объеме фазы испытывает большее число
межмолекулярных взаимодействий по
сравнению с молекулой, которая находится
на границе раздела фаз. Молекулы,
находящиеся у поверхности, обладают
избыточной поверхностной энергией. Для
того, чтобы образовать единицу поверхности,
необходимо совершить работу и разорвать
межмолекулярные связи.
Поверхностное натяжение – это работа образования единицы поверхности в обратимых изотермических условиях.
![]() - изменение свободной
энергии (Энергии Гельмгольца).
- изменение свободной
энергии (Энергии Гельмгольца).
![]()
![]()
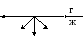
F2 – сила, действующая на ленку со стороны перемычки.
Опыт Дюпре:
![]()
Поверхностное натяжение – это сила, действующая к тангенциальной поверхности и отнесенная к единице длины периметра, ограничивающего эту поверхность.
Обобщенное уравнение I и II законов термодинамики:
![]()
![]() ,
,
![]()
Уравнение Гиббса-Гельмгольца.
Для конденсированных систем в условиях V,T=const справедливо: ΔU = ΔG + TΔS.
GS – энергия Гиббса.
![]() ,
тогда
,
тогда
![]() - для жидкостей.
- для жидкостей.
![]()
![]() ,
(ΔSS
– изменение энтропии, отнесенная к
единице поверхности).
,
(ΔSS
– изменение энтропии, отнесенная к
единице поверхности).
![]() ,
тогда
,
тогда
![]() ,
,![]() ,
=>
,
=>
![]()
![]() - Уравнение
Гиббса-Гельмгольца
- Уравнение
Гиббса-Гельмгольца
Поверхностная энергия не зависит от температуры!
P
= const:
![]()
![]() - поверхностное
натяжение линейно уменьшается при
увеличении температуры.
- поверхностное
натяжение линейно уменьшается при
увеличении температуры.
![]()
![]() ,
=>
,
=>
![]()
![]()
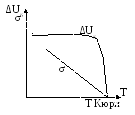
В точке Кюри исчезает поверхность и полная поверхностная энергия обращается в нуль.
Капиллярные явления.
С тремление
жидкости уменьшить свою поверхностную
энергию выражается в появлении кривизны
и дополнительного давления.
тремление
жидкости уменьшить свою поверхностную
энергию выражается в появлении кривизны
и дополнительного давления.![]()
![]() - результирующая сил поверхностного
натяжения, направленная к центру
кривизны. Для условийV,T=const
изменение энергии Гельмгольца равно:
- результирующая сил поверхностного
натяжения, направленная к центру
кривизны. Для условийV,T=const
изменение энергии Гельмгольца равно:
![]()
![]()
![]()
![]() ,
,
![]() -уравнение
Лапласа.
-уравнение
Лапласа.
Для сферы:
![]() ,
,![]() .
.![]()
К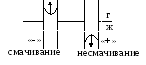
 ривизна
поверхности может быть положительной
и отрицательной.
ривизна
поверхности может быть положительной
и отрицательной.
положительная – центр в жидкой фазе,
отрицательная – центр в газовой фазе.
r0 – радиус кривизны;
r – радиус капилляра
θ – краевой угол смачивания.
![]() . Высота
поднятия:
. Высота
поднятия:
![]()
![]() - формула Жюрена.
- формула Жюрена.
Поскольку система стремится сократить свою поверхностную энергию, она всегда будет стараться иметь минимальную поверхность.
![]() - принцип
Кюри-Гиббса
- принцип
Кюри-Гиббса
Переход из конденсированного состояния в газообразное, n=1 моль, V = Vm = M/ρ
а) T = const
![]() ,
(dGD
– в системе происходит диспергирование)
,
(dGD
– в системе происходит диспергирование)
В случае постоянства
температуры можно записать, что
![]()
![]() - уравнение
Томсана-Кельвина (капиллярной конденсации).
- уравнение
Томсана-Кельвина (капиллярной конденсации).
P – давление над искривленной поверхностью, РS – давление над плоской пов-тью
Следствия:
положительная кривизна: чем < капля, тем больше давление насыщенных паров
отрицательная кривизна: чем < размер пор, тем < давление или тем легче протекает процесс конденсации в порах.
б) Р = const
![]() ,
,
 ,
(
,
(![]() - макрофаза)
- макрофаза)
![]()
![]()
![]()
Следствие: по мере уменьшения размеров частиц происходит снижение температуры фазового перехода.
Методы определения
поверхностной энергии.
Метод Гиббса:
![]()
Метод поверхностного
слоя:
![]()
![]() - избыточная энергия
к поверхности раздела фаз,
- избыточная энергия
к поверхности раздела фаз,
![]() - энергия Гиббса
слоя с толщиной
- энергия Гиббса
слоя с толщиной
![]()
За толщину слоя принимают расстояние по обе стороны от границы раздела фаз, за пределами которого поверхностные свойства перестают отличаться от объемных.
Метод поверхностного слоя используется редко, т.к. громоздок.
