
- •Коллоидная химия
- •Молекулярно – кинетические свойства
- •Седиментационное диффузионное равновесие.
- •Оптические Свойства. Светорассеяние и Светопоглощение.
- •Светопоглощение.
- •Поверхностные явления.
- •Смачивание. Растекание. Кагезия. Адгезия.
- •Методы измерения поверхностного натяжения.
- •Адсорбция.
- •Взаимодействия при физической адсорбции.
- •Фундаментальное адсорбционное уравнение.
- •Термодинамика. Адсорбция.
- •Уравнение Генри
- •Основы термодинамики дисперсных систем
Коллоидная химия
Коллоидная химия – наука о поверхностных явлениях и дисперсных системах. Поверхностное явление – явление на границе раздела фаз.
Дисперсные системы – это многофазные системы, состоящие как минимум из двух фаз, одна из которых находится в мелкораздробленном состоянии.
Дисперсионная фаза (ДФ) – мелкораздробленная фаза, а дисперсионная среда (ДС)– это сплошная часть дисперсионной системы. Т. о., у дисперсных систем два признака: гетерогенность (качественный признак) и дисперсионность (количественный).
Дисперсность
– величина, обратная линейному размеру
частицы (м-1):
![]() , где а
– размер
частицы.
, где а
– размер
частицы.
Классификация:
по степени дисперсности:
высокодисперсные (10-7- 10-9 м ) – космическая пыль;
среднедисперсные (10-7 – 10-5м) – чай, кофе;
грубодисперсные (10-5 – 10-3м).
по геометрическому признаку:
|
Система |
Признак |
Тип |
|
Трехмерные |
3 |
Объемные |
|
Двумерные |
2 |
Тонкие пленки |
|
Одномерные |
1 |
Капилляры |
по кинетическому состоянию ДФ
кинетическое состояние ДФ
 свободнодисперсные
связнодисперсные
свободнодисперсные
связнодисперсные

 (капиллярные
тела)
(капиллярные
тела)
 Золи
суспензии макропористые
Золи
суспензии макропористые
микропористые (>200 нм)
(<2 нм) переходнопористые
Гели пасты (2 – 200 нм)
-
ДФ
ДС
Тип
Тв
Тв
Минералы
Тв
Ж
Коллоидные растворы
Тв
Г
Дым
Ж
Тв
Сок растений, почва
Ж
Ж
Эмульсии (молоко)
Ж
Г
Туман
Г
Тв
Твердые пены (капиллярно – пористые тела)
Г
Ж
Пены (мыльная)
Г
Г
Для коллоидной химии нет
по энергии взаимодействия ДС и ДФ:
Лиофильные (сильное взаимодействие).
Лиофрбные (слабое взаимодействие).
по величинам удельной поверхности:
![]() - межфазовая
поверхность
- межфазовая
поверхность
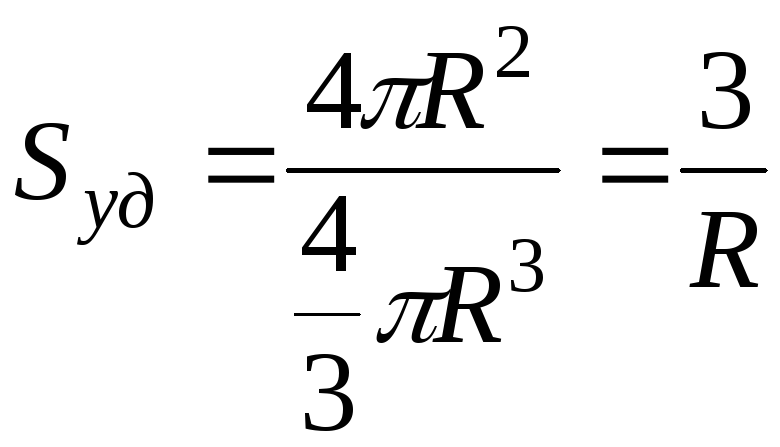 - для частиц
сферической формы (м-1)
- для частиц
сферической формы (м-1)
![]() Sуд
всегда
очень большая величина.
Sуд
всегда
очень большая величина.
Поверхностная энергия GS:
![]() –полная поверхностная
энергия системы.
–полная поверхностная
энергия системы.
![]()
Поверхностная энергия может преобразовываться в энергию Гиббса, тепловую работу, механическую работу, в работу химическую, в электрическую энергию.
Свойства дисперсных систем:
Молекулярно – кинетические (диффузия, осмос, седиментация).
Оптические (светопоглощение и светорассеяние).
Электро-кинетические (электрофорес, электроосмос, потенциал седиментации, потенциал течения).
Молекулярно – кинетические свойства
МКТ рассматривает дисперсные системы с позиции истинных растворов, т. е. ДС – это растворитель, а ДФ – растворенное вещество. Выделяют следующие свойства: броуновское движение, осмос, седиментация. Для дисперсионных систем характерны два вида устойчивости:
Агрегативное – устойчивость по отношению к слипанию.
Седиментационная – по отношению к силе тяжести.
Седиментация.
Седиментация – это движение частиц под действием силы тяжести. Потеря седиментационной устойчивости ведет к расслаиванию системы.
 В
начальный момент времениmg>Fтр
(равноускоренное движение).
В
начальный момент времениmg>Fтр
(равноускоренное движение).
В
момент времени t,
который соответствует установлению
равновесие:
![]() .
.
Закон Стокса:
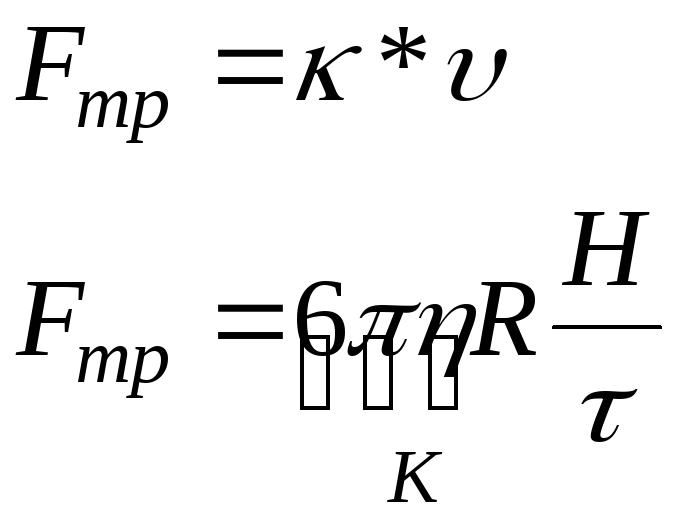 ,
где
,
где
![]() -
коэффициент трения, R
– радиус частицы, Н – высота, τ – время.
-
коэффициент трения, R
– радиус частицы, Н – высота, τ – время.
![]()
![]() - плотность
дисперсной фазы,
- плотность
дисперсной фазы,
![]() - плотность дисперсионной среды
- плотность дисперсионной среды
![]() - основная
формула седиментационого анализа:
измеряя
массы веществ, осевших в какой – либо
момент времени, можно узнать размер
этих частиц.
- основная
формула седиментационого анализа:
измеряя
массы веществ, осевших в какой – либо
момент времени, можно узнать размер
этих частиц.
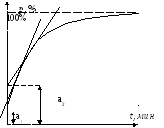
Кривая накопления
(относительно изменения массы)- по ней
находят кумулятивную
фракцию -
это доля частиц, осевших к данному
моменту времени:
![]() .
.
Э то
отрезок, который отсекает на оси ординат
касательная, проведенная к данной точке
кривой накопления.
то
отрезок, который отсекает на оси ординат
касательная, проведенная к данной точке
кривой накопления.
После диффиренцирования:
![]()
Максимум и точка перегиба совпадают:
Система называется монодисперсной, если в ней преобладают частицы одного размера; если двух размеров – бидисперсная:
П оли
дисперсная:
оли
дисперсная:

Диффузия.
Диффузия – это процесс, направленный на выравнивание концентраций в первоначально неоднородной среде. По своей сути противоположен седиментации.
S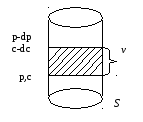 – площадь поперечного сечения, p-dp,
c-dc.Давление
и концентрация меньше, ν - расстояние
– площадь поперечного сечения, p-dp,
c-dc.Давление
и концентрация меньше, ν - расстояние
Два уровня. Движущей силой процесса диффузии выступает градиент осмотического давления:
![]() . В состоянии
равновесия
. В состоянии
равновесия
![]() и для первой частицы справедливо:
и для первой частицы справедливо:![]() ,
,![]() – из
закона Стокса.
– из
закона Стокса.
N – число частиц (Na), С – концентрация, ν – высота
![]()
![]() .
.
![]() - число частиц в объеме, диф. поток в
единице времени, ν – линейная скорость
движения, высота к единице поверхности.
- число частиц в объеме, диф. поток в
единице времени, ν – линейная скорость
движения, высота к единице поверхности.
![]()
![]()
Получаем диффузионный
поток:
![]() ,
т. к.
,
т. к.![]() .
.
![]() -
1-й закон
Фика;
-
1-й закон
Фика;
![]()
- уравнение Эйнштейна (коэффициент диффузии).
Поскольку все направления движения равновероятны, была предложена проекция среднеквадратичного сдвига:
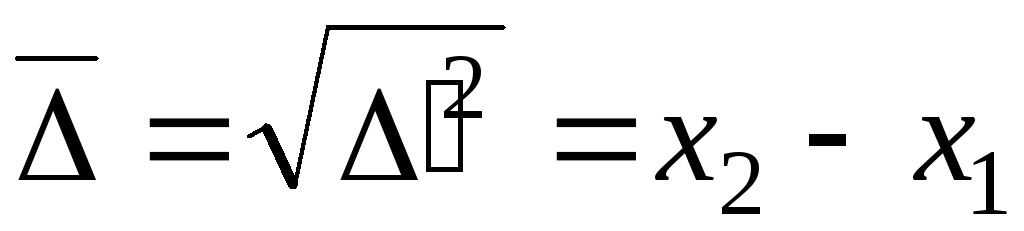 ,
,
![]() И
И дут
вверх:
дут
вверх:![]() ;
идут вниз:
;
идут вниз:![]() .
.
Переносимая масса:
![]()
диффузионный поток в единицу времени через единицу поперечного сечения.
![]() - по 1 – му закону
Фика.
- по 1 – му закону
Фика.
![]() ,
,
![]()
- уравнение для среднеквадратичного сдвига
D ~ 10-11 – 10-14 м2/с, [D]=[м2/с]
Коэффициент диффузии – это поток вещества, переносимый через цилиндр с единичной площадью поперечного сечения в единицу времени.
