
- •Лекция №9
- •Регуляция ферментативной активности.
- •Изоферменты или изоинзимы.
- •Классификация ферментов.
- •Лекция №10
- •Биоэнергетика.
- •Энергетика переноса электронов.
- •Механизм энергетического сопряжения в митохондриях.
- •Химеосмотическая, протондвижущая концепция.
- •Моносахариды.
- •Лекция №13
- •Обмен углеводов.
Классификация ферментов.
В 1961 г. на международном биохимическом съезде была предложена классификация:
1. Оксидоредуктазы – это ферменты, катализирующие окислительно-восстановительные реакции.
2. Трансферазы – это ферменты, катализирующие реакции переноса групп с одно субстрата на другой.
3. Гидралазы – это ферменты, катализирующие реакции гидролиза.
4. Лиазы – это ферменты, катализирующие присоединение групп к двойным связям или отщепление групп с образованием двойной связи.
5. Изомеразы – это ферменты, катализирующие реакции изомеризации.
6. Синтетазы (лигазы) – это ферменты, катализирующие реакции увеличения цепочки, образования связи CN CO CC и т.д.
Каждый класс ферментов разделяется на подкласс и подподкласс, в зависимости от индивидуальных превращений, при этом учитывается природа кофермента, тип связи, на который действует фермент.
Такая классификация позволяет идентифицировать индивидуальные ферменты с помощью шифра, состоящего из 4 цифр.
1-я цифра класс;
2-я цифра подкласс;
3-я цифра подподкласс;
4-я цифра порядковый номер фермента в данном подподклассе.
-
Класс Оксидоредуктазы
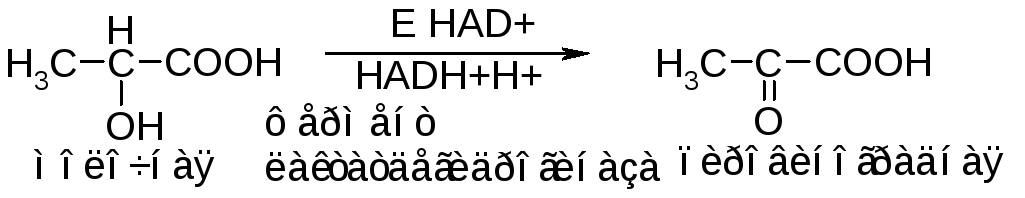
Дегидрогиназы – с помощью этих ферментов происходит отщепление атомов водорода от субстрата и переноса на другой субстрат.
Оксидазы – катализируют реакции окисления в результате переноса электронов с донора к акцептору.
1 – класс
1 – что является донором
1 – акцептором служит
НАД –
никотинамидадениндинуклеотид –
небелковая часть дегидрогиназы.
1 - класс
1
2 – акцептором служит цитохром
1– класс
1
3 – акцептором служит кислород
1 – класс
2 – донор альдегидная группа.
1 – акцептором служит НАД и НАДФ
Пример: 1-2-1-12 глицеральальдегидтрифосфат: НАД-оксидоредуктаза (фосфорилирующая).
2. Трансферазы.
2
2.1 – переносят одноуглеродные остатки
2 – трансферазы оксиметильных, формильных, метиленовых групп
Источником этих групп является тетрагидрофолевая кислота.

-
– трансферазы, которые переносят альдегидные и кетонные группы.
-
- ацилтрансферазы, переносят остатки кислоты
2.3.1 – ацетилтрансферазы переносят остатки уксусной килоты
Лекция №10
К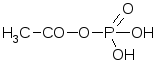 оэнзим
А (небелковой частью является
ацетилтрансферазой)
оэнзим
А (небелковой частью является
ацетилтрансферазой)
![]()
Н ебелковая
часть ацетилтрансферазы: Коеэнзим А
ебелковая
часть ацетилтрансферазы: Коеэнзим А
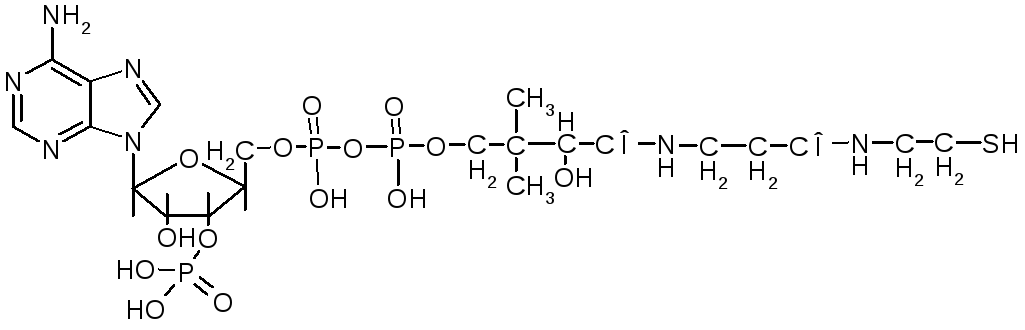
Ацетилхолинтрансфераза 2-3-1-6

2-6 ферменты: перенос азотистых групп, входит большое число ферментов аминотрансфераз. Небелковой частью является витамин B6 – фосфоперидаксаль.

Реакция переаминирования: глютаминовая кислота + пировиноградная кислота – перенос аминогруппы с глютаминовой кислоты на пировиноградную.

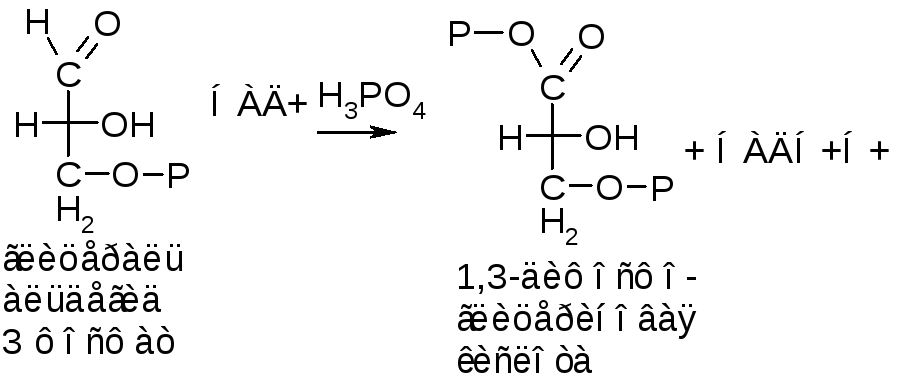
2-7 ферменты: переносят фостфатные группы.
2-7-1 – фосфокеназы.
Глюкофосфокеназа

Если перенос фосфатной группы осуществляется внутри одной молекулы – такой фермент называется фосфомутаза.

Гидралазы – ферменты, способствующие гидролитическому расщеплению.
3-1 – эстеразы, действюут на сложноэфирные группы.
3-1-1 – липаза, расщепляет сложные эфиры глицерина и высших жирных кислот.

3-1-1-4 – лецитиназа, расщепляет эфирные связи в фосфотидил производных.

3-1-1-4
3-1-1-5
3-1-3
Лецитиназа A2 отщепляет непредельную жирную кислоты R1-COOH, после этого образуется соединение лизолецитин, это вещество вызывает гемолиз эритроцитов. A2 входит в состав змеиного яда.
3-2 ферменты – гликозидазы, способствуют гидролизу гликозидных связей.
3-2-1-12 – амилаза, она действует на крахмал и расщепляет крахмал по 1,4-гликозидным связям.
Альфа- (3-2-1-20) и бета-гликозидазы (3-2-1-21) – расщепляет альфа гликозидные связи и бета-гликозидные связи соответственно.
К бета-гликозидазе относится фермент сахараза.

![]() -гликозидазы
-гликозидазы

![]() - гликозидазы
- гликозидазы
3-4 ферменты – пептидазы, действуют на пептидные связи, разделяются на эндопептидазы (пепсин, трепсин, хемотрепсин), которые расщепляют внутренние пептидные связи и экзопептидазы (аминопептидаза, карбоксипептидазы), расщепляют внешние пептидные связи.
3-4-1-1 – пепсин, он действует в желудке и проводит гидролиз пептидных связей, прилегающих к остаткам ароматических и дикарбоновых кислот с N-конца.
3-4-4-4 – трепсин, в кишечнике, гидролиз пептидных связей, амидов, сложно-эфирных связей у аргинина и лизина с С-конца.
3-4-4-5 – хемотрепсин, расщепляет полипептиды, белки по карбоксильным группам ароматических аминокислот.
3-5 ферменты – гидралазы, действующие на CN-связи, отличные от пептидных.
3-5-1-5 – уреаза, расщепляет мочевину на аммиак и углекислый газ.
Аргиназа, аргигнин расщепляется на орметин и мочевину.
3-6 ферменты, действуют на кислотно-ангидридные связи.
АТФ + H2O
![]() АМФ
+ пирофосфат.
АМФ
+ пирофосфат.
Пирофосфат:


Лиазы.
4-1 – углерод углеродные лиазы
4-1-1 – декарбоксилиаза кетона и аминокислот.
Пировиноградная кислота превращается в уксусный альдегид и выделяется углекислый газ, т.е. происходит декарбоксилирование.
![]()
Небелковая часть фермента – витамин B1 – тиаминпирофосфат или (дифосфотиамин).

4-1-2 альдолаза.
фруктоза-1-6-дифостфат расщепляется и образуется фосфодиоксиацетон и фосфоглицериновый альдегид.

4-2-CO-лиазы, т.е. расщепляют углерод-кислородные связи.
Например, гидратаза.
Яблочная кислота образует фумаровую кислоту, отщепляя молекулу воды.

4-3-CN-лиазы

Изомерезы.
5-1 – рацемазы, способствуют переходу D в L форму.
5-1-1-1 – аланинрацемаза
5-2 – цис-транс-изомеразы, фумаровая в малеиновую и наоборот.
5-3 – эпимеразы, превращение эпимеров друг в друга.

Синтетазы (или лигазы).
6-1-1 аминоацил транспортной РНК синтетазы
6 -2
образуются углерод-серные связи,
кислотно-тиоловые лигазы.
-2
образуются углерод-серные связи,
кислотно-тиоловые лигазы.
![]() 6-4
ацетилкоэнзим-А-карбоксилаза, с помощью
неё происходит образование углерод-углеродных
связей.
6-4
ацетилкоэнзим-А-карбоксилаза, с помощью
неё происходит образование углерод-углеродных
связей.
 Механизм
ферментативного действия.
Механизм
ферментативного действия.
Превращение субстрата в продукты реакции под влиянием ферментов может быть выражено в общем виде
![]()
Образование промежуточных комплексов требует меньше энергии, чем непосредственное превращение субстрата.

Все молекулы в системе должны обладать каким-то запасом энергии, чтобы превратиться продукты реакции. Образование разных фермент-субстратных комплексов приводит к тому, что энергетический барьер каждого субстратного комплекса значительно ниже, чем общий барьер реакции.
Теория индуцированного состояния.
Согласно этой теории, фермент связывается с правильным субстратом и сам фермент приобретает в процессе некоторое изменение – индуцированное соответствие (состояние).
Образование фермент-субстратного комплекса происходит индуцированное соответствие – фермент и субстрат претерпевают структурные изменения, чтобы соответствовать друг другу.

Факторы, которые способствуют:
-
Сближении и ориентация фермента и субстрата, в результате этого атакуемая ферментом связь оказывается не только расположенной в непосредственной близости от каталитического центра, но и правильно ориентирована.
-
Общий кислотно-основной катализ. В активном центре фермента, как правило находятся группы специфических аминокислотных остатков, которые являются хорошими донорами протонов и хорошими акцепторами протонов (протонодонорные карбоксильная, гидрокси, сульфгидрильная; протоноакцепторные: карбокси-группа, NH2, S-, O-; сульфгидрильная группа может быть как протонодонорной, так и протоноакцепторной).
-
Ковалентный катализ
![]()
![]()
![]()
![]()
Х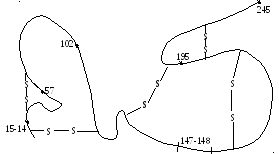 емотрепсин
– это
полипептид, содержащий 245 аминокислотных
остатков, имеет 5 дисульфидных мостиков.
емотрепсин
– это
полипептид, содержащий 245 аминокислотных
остатков, имеет 5 дисульфидных мостиков.
57 – гистидин;
102 – аспарагиновая кислота;
195 – сирин;
Неактивный
хемотрепсин превращается в активную
форму превращается после того, как под
действием фермента трепсина и активного
хемотрепсина расщепляются 4 пептидные
связи. Но удержив ается
дисульфидными связями.
ается
дисульфидными связями.
Это был процесс расщепления пептидной связи под действием хемотрепсина в активном состоянии.
Лекция №11
Действие аминотрансферазы.
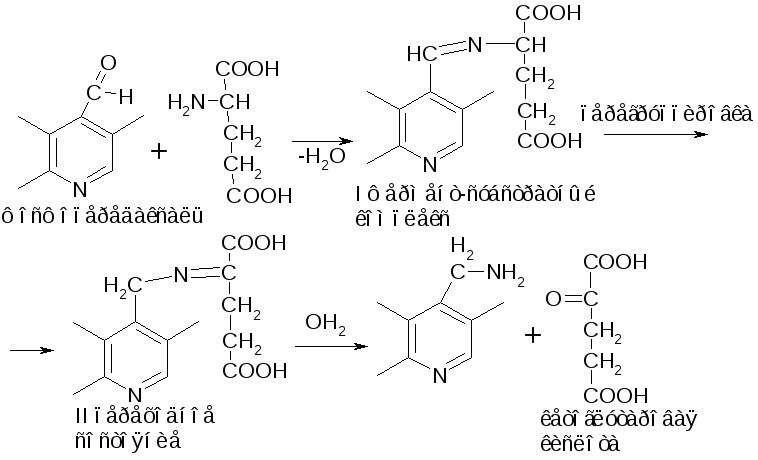
На первой стадии происходит образовании шиффового основания, далее происходит группировка.

Реакции переаминирования, протекают очень активно при отщеплении аминокислот.
Биологическое окисление, биэнергетика.
Все клетки такни потребляют кислород и выделяют углекислый газ и воду, т.е. все клетки дышат. При дыании во всех клетках и тканях окисляются питательные вещества, это осуществляется с помощью окислительно-восстановительных реакций. Процесс окисления и дегидрирования – это процессы эквивалентные. В одних случаях происходит окисление, в результате отщепления атомов водорода от субстрата, а в других случаях происходят переносы электронов.

Все дегидрогиназы можно разделить на два типа:
1. Анаэробные дегидрогиназы – переносят атомы водорода на какие-то промежуточные компоненты.
Всего анаэробных дегидрогиназ известно около 150. Впервые НАД и НАДФ были выявлены и идентифицированы с 1933 по 1936 Гварбургом и Эйлером. Многие клетки содержат трансгидрогиназы, катализирующие обратимый перенос атомов водорода с НАД восстановленного на НАД окисленный.
![]()
Больше всего в клетках находится НАД, в основном он присутствует в митохондриях, НАДФ – в митохондриях и цитоплазме. Связь кофермента с белковой частью в процессе катализа обратимо разрушается, т.е. связь не прочная.
2. Аэробные дегидрогиназы – переносят атомы водорода на атомы кислорода с образованием перекиси.
Это солжные белки, содержащие в качестве небелковой компоненты флавинмононуклеотид (у растений) и флавинадениндинуклеотид (у животных). Флавинмононуклеотид – это фосфорный эфир рибофлавина и является витамином В2.
ФМН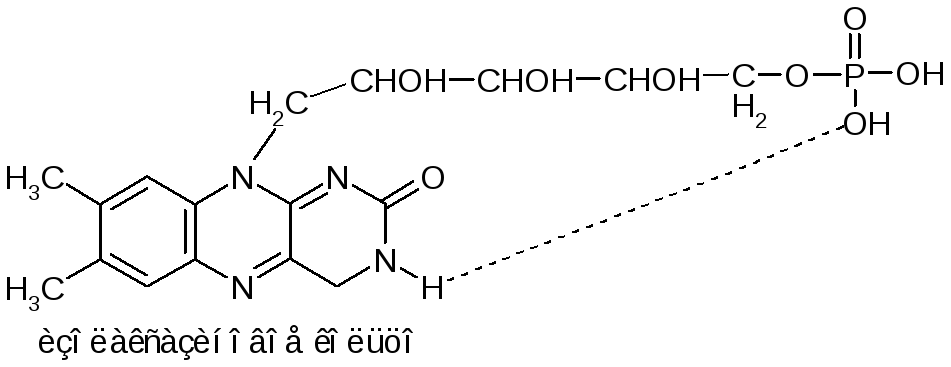

![]()
Были впервые выделены флавиновые ферменты Гварбургом и Куном в середине 30-х годов. У большинства дегидрогиназ этого типа влавиновые нуклеотиды очень прочно связаны с белковой частью и не отщепляются от нее в процессе катализа. В окисленной форме флавиновые дегидрогиназы интенсивно окрашены в красный, коричневый цвета. Восстановленный ФАД способен дальше реагировать:

![]()
Далее в процессе окисления или дыхания принимает участие коэнзим-Q (КоQ или убихинон). Он имеет углеводородную структуру и растворим в липидном слое мембран, он функционирует в этом слое от одной системы дыхания к другой, перенося атомы водорода. Все остальные ферменты белковой природы жестко связаны с мембраной, не растворимы.


Оксидазы, которые участвуют в процессе дыхания – это в основном цитохромы (тирозиназа, пероксиназа). Это ферменты, с помощью которых происходит еренос электронов с одного субстрата на другой. Цитохромы – это гем-содержащие белки, участвующие в процессе переноса электронов в аэробных услових. Они включаются в процесс переноса электронов в определенной последовательности и переносят электроны от флавиновых ферментов к молекуле кислорода. Все цитохромы содержат в качестве простетической группы железо-порфериновое кольцо, т.е. гемм. Отличаются все цитохромы природой белковой части и некоторыми радикалами в гемме.
Всего выделено 5 типов цитохромов: В, C, C1, A, A3. Участвуют в процессе дыхания.

Радикалы
|
|
b каталаза, пероксидаза |
с |
а |
|
X |
CН2=СН- |
|
|
|
XX |
СН2=СН- |
СН2=СН- |
|
|
XXX |
СН3 |
|
|
Все цитохромы обладают различными окислительно-восстановительными потенциалами. Перенос электронов осуществляется за счет изменения степени окисления железа.
![]()
 В
результате многочисленных экспериментальных
данных было выяснено, что схема переноса
электронов в дыхательной цепи
осуществляется в следующей
последовательности:
В
результате многочисленных экспериментальных
данных было выяснено, что схема переноса
электронов в дыхательной цепи
осуществляется в следующей
последовательности:
Цитохромы A и A3 – это цитохромоксидаза, она состоит из 6 или из 7 субъединиц в зависимости от суборганизмов, где она присутствует. Каждая из этих субъединиц содержит гиминовую группу и атом меди. Предполагают, что две субъединицы относятся к цитохрому А, а остальные к цитохрому А3. Восстановленный цитохром A3 – это единственный компонент митохондрий, который способен легко восстанавливать молекулярный кислород.
В цепи дыхания функционируют ещё и другие компоненты – железо-серные центры. Из митохондриальной мембраны удалось выделить структурно-обособленные комплексы функционально связанных между собой переносчиков электронов.
Комплекс 1 состоит из НАД восстановленной дегидрогиназы и её железо-серных центров, которые функционируют в тесной связи друг с другом.
Комплекс 2 включает сукцинат дегидрогиназу и железо-серные центры.
Комплекс 3 состоит из цитохрома A и B и железо-серных центров.
Комплекс 4 состоит из цитохромов A и A3 и железо-серных центров.
Убихинон служит связующим звеном между комплексами 1, 2, 3, а цитохром С связывает между собой комплекс 3 и 4.



