
- •Лекция №9
- •Регуляция ферментативной активности.
- •Изоферменты или изоинзимы.
- •Классификация ферментов.
- •Лекция №10
- •Биоэнергетика.
- •Энергетика переноса электронов.
- •Механизм энергетического сопряжения в митохондриях.
- •Химеосмотическая, протондвижущая концепция.
- •Моносахариды.
- •Лекция №13
- •Обмен углеводов.
Лекция №9
Необратимое ингибирование ферментов: действие йодацетамида, который ингибирует ферменты, содержащие в активном центре сульфгидрильные группы.
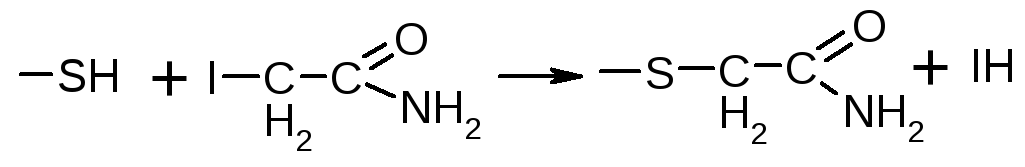
Происходит блокирование этой группы и ковалентное взаимодействие.
Обратимое ингибирование ферментов предполагает нековалентное связывание ингибитора с ферментным и по своей природе может быть
-
конкурентное;
-
неконкурентное;
-
бесконкурентное.
Конкурентное ингибирование– ингибитор конкурирует с субстратом в активном центре.

Происходит расщепление субстрата. Ингибитор конкурирует с субстратом за активный центр, т.е. какой-то частью он структурно напоминает субстрат, как бы включается и образуется фермент-ингибиторный комплекс, субстрат уже сюда включиться не может. Чтобы снять это влияние, необходимо повысить концентрацию субстрата, он будет вымывать фермент из этого комплекса.
Примером может служить действие фермента сукцинатдегидрогиназы на янтарную кислоту:
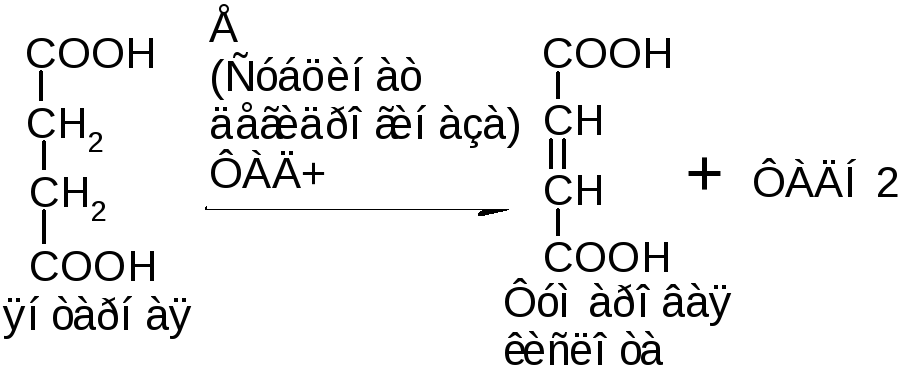
Вступать в реакцию могут кислоты, имеющие две карбоксильные группы (щавелево-уксусная кислота, малоновая кислота).
Неконкурентное ингибирование: ингибитор связывается с ферментом не в активном центре, а где-то в другом месте, при этом меняется структура активного центра, активный центр становится непригодным для связывания субстрата.

Отличить конкурентное ингибирование от неконкурентного ингибирования можно обнаружить снятием скорости ферментативной реакции от

С увеличением концентрации ингибитора возрастает константа Михаэлиса, т.е. необходимо увеличить концентрацию субстрата, чтобы насытить фермент.

Если же ингибирование неконкурентное, тогда вид зависимости будет иным, будет изменяться максимальная скорость.
[I0] < [I1] < [I2]
Бесконкурентное ингибирование – ингибитор взаимодействует уже с образовавшимся с фермент-субстратным комплексом, образуется ингибиторно-фермент-субстратный комплекс, дальше катализ не идет.


Меняется и константа Михаэлиса и максимальная скорость процесса.
В ферменте всегда можно выделить каталитический центр – это тот участок в ферменте, где происходит непосредственное взаимодействие с субстратом. Его можно условно разделить на две части: собственно каталитический участок и контактная (якорная) площадка, которая обеспечивает специфическое сродство к субстрату. Если фермент – сложный белок, то каталитическую функцию выполняет кофермент, а якорная площадка – уникальная третичная структура белка. Если же фермент – простой белок, то и якорная площадка и каталитический участок определяются уникальной комбинацией радикалов аминокислот в одном месте в ферменте.
Мультиферментые системы.
В клетке многие ферменты как правило работают одновременно, катализируя последовательные цепи реакции, в которых продукты первой реакции являются субстратами для второй реакции и т.д. субстраты и продукты реакции как низкомолекуолярные соединения диффундируют в клетке и быстро находят каждый свой фермент. По сложности молекулярной организации такие мультиферментные системы можно разделить на три группы:
-
О
 тдельные
ферменты растворены в цитоплазме и
работают независимо друг от друга, а
субстраты – это малые молекулы, они
диффундируют в этой цитоплазме, каждый
находит свой фермент и процесс катализа
идет.
тдельные
ферменты растворены в цитоплазме и
работают независимо друг от друга, а
субстраты – это малые молекулы, они
диффундируют в этой цитоплазме, каждый
находит свой фермент и процесс катализа
идет.
Каждый фермент работает самостоятельно, обособлено.
-
Ф
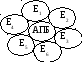 ерменты
образуют общеферментный комплекс, т.е.
они объединены в один комплекс. При
разрушении такого комплекса активность
системы резко падает. Примером является
дрожжевая система жирных кислот
(синтетаза жирных кислот), в клетках
осуществляется синтез высших жирных
кислот вплоть до пальмитиновой кислоты.
ерменты
образуют общеферментный комплекс, т.е.
они объединены в один комплекс. При
разрушении такого комплекса активность
системы резко падает. Примером является
дрожжевая система жирных кислот
(синтетаза жирных кислот), в клетках
осуществляется синтез высших жирных
кислот вплоть до пальмитиновой кислоты.
АПБ – ацил-переносящий белок
Синтетаза жирных кислот – комплексная мультиферментная система. При таком синтезе даже не нужно АТФ, т.к. синтез происходит с минимальными затратами энергии.
-
Ф
 ерменты
связаны с каким-то надмолекулярным
образованием, например, дыхательная
цепь, которая связана с внутренней
мембраной митохондрии. Ферменты этой
системы вживлены во внутреннюю мембрану.
ерменты
связаны с каким-то надмолекулярным
образованием, например, дыхательная
цепь, которая связана с внутренней
мембраной митохондрии. Ферменты этой
системы вживлены во внутреннюю мембрану.
Мембрана помогает действию этих ферментов. Другой пример – это рибосомы, в них происходит процесс синтеза белка, а все остальные части рибосомы – ферменты.
