
- •В.А. Панов Автоматизация проектирвания средств и су. Физико-технические эффекты
- •Введение
- •Понятие фтэ
- •1.2. Формализация описания фтэ
- •Дерево фтэ
- •Синтез физического принципа действия
- •Алгоритм синтеза фпд
- •Классификация фтэ
- •Описание фтэ
- •2.1. Механические эффекты
- •2.1.1. Центробежная сила
- •2.1.2. Гироскопический эффект
- •2.1.3. Гравитация
- •2.1.4. Электропластический эффект в металлах
- •2.2.Молекулярные явления
- •2.2.1. Тепловое расширение
- •2.2.2. Капиллярные явления
- •2.2.3. Фазовые переходы
- •Гидростатика и гидродинамика
- •2.3.1. Сорбция
- •2.3.2. Диффузия
- •2.3.3. Осмос
- •2.3.4. Цеолиты
- •Гидростатика и гидродинамика
- •Колебания и волны
- •2.5.1. Резонанс
- •2.5.2. Реверберация
- •2.5.3. Акустомагнетоэлектрический эффект
- •Волновое движение
- •2.6.4. Дисперсия волн
- •2.6.5Электрические и электромагнитные явления
- •2.7.1.Электрическое поле
- •2.7.1.1.Джоуля-Ленца закон
- •2.7.1.2. Закон Кулона
- •2.7.1.3. Электростатическая индукция
- •2.7.2.1. Контур с током в магнитном поле
- •Сила Лоренца
- •Магнитострикция
- •Электромагнитное поле
- •Эдс индукции
- •Взаимная индукция
- •Индукционный нагрев
- •Диэлектрические свойства вещества
- •Пьезоэлектрический эффект
- •2.8.2. Обратный пьезоэлектрический эффект
- •Пироэлектрики
- •Электреты
- •Сегнетоэлектрики
- •Магнитные свойства вещества
- •Закон Кюри
- •Виллари эффект
- •Магниторезистивный эффект
- •Баркгаузена эффект
- •Эффект Эйнштейна – де-Хааза
- •Электрические свойства вещества
- •Тензорезистивный эффект
- •Терморезистивный эффект
- •Термоэлектрические и эмиссионные явления
- •2.11.1. Эффект Зеебека
- •2.11.2. Эффект Пельтье
- •2.11.3. Термоэлектронная эмиссия
- •Гальвано- и термомагнитные явления
- •Холла эффект
- •2.12.2. Эттинсгаузена эффект
- •Электрические разряды в газах
- •Электрокинетические явления
- •Свет и вещество
- •2.15.1. Полное внутреннее отражение
- •Фотоэлектрические и фотохимические явления
- •2.16.1. Фотоэффект
- •2.16.2. Дембера эффект
- •Люминесценция
- •Фотоупругость
- •Электрооптический эффект Керра.
- •Фарадея эффект
- •Эффект Зеемана
- •Дихроизм
- •Явления микромира
- •Электронный парамагнитный резонанс
- •Акустический парамагнитный резонанс
- •Ядерный магнитный резонанс
- •. Фотофорез
- •Стробоскопический эффект
- •Электрореологический эффект
- •Акустоэлектрический эффект
- •Заключение
- •Литература
2.3.3. Осмос
Входы: концентрация.
Выходы: давление.
Графическая иллюстрация:

Рис. 2.11. Осмос через полупроницаемую мембрану: частицы растворителя (синие) способны пересекать мембрану, частицы растворённого вещества (красные) — нет
Сущность:
Осмос - самопроизвольный переход вещества через полупроницаемую перегородку (мембрану), разделяющую два раствора различной концентрации или раствор и чистый растворитель. Осмос приближает систему к равновесию путем выравнивания концентраций по обе стороны перегородки.
Наиболее важный случай осмоса - переход молекул чистого растворителя в раствор через полупроницаемую мембрану, не пропускающую молекулы растворенного вещества (рис 2.11). В этом случае происходит переход молекул из чистого растворителя в раствор, концентрация которого при этом понижается. В общем случае двух растворов А и В разной концентрации (концентрация раствора А больше, чем В) возникает поток вещества от А к В. Этот поток можно предотвратить, если повысить давление в растворе В, причем разность давлений π по обе стороны перегородки при этих условиях называется осмотическим давлением, а достигнутое термодинамическое равновесие - осмотическим равновесием.
Электроосмос (электроэндоосмос) - движение жидкостей или газов через капилляры, твердые пористые диафрагмы и мембраны, а также через слои очень мелких частиц под действием внешнего электрического поля.
Осмос можно усилить (или ослабить), применяя электрические поля.
Математическое описание:
![]() ,где:
,где:
![]() -
осмотическое давление;
-
осмотическое давление;
V - молярный объем растворителя;
R – универсальная газовая постоянная;
T – температура;
х - молярная доля растворенного вещества.
Уравнение состояния Вант-Гоффа:
![]() -
для разбавленных растворов неэлектролитов,
где
-
для разбавленных растворов неэлектролитов,
где
с - молярность раствора;
![]() -
для разбавленных растворов электролитов,
где
-
для разбавленных растворов электролитов,
где
![]() -
коэффициент Вант-Гоффа;
-
коэффициент Вант-Гоффа;
![]() -
степень диссоциации;
-
степень диссоциации;
υ- число ионов, на которое распадается молекула электролита.
Применение.
1. Осмос (электроосмос) применяется для очистки коллоидных растворов от примесей, для очистки глицерина, сахарных сиропов, воды, при дублении кожи, а также при окраске некоторых материалов.
A.c. 240825: Способ сушки изоляции кабелей в шахтах электросетях с изолированной нейтралью отличается тем, что, с целью упрощения процесса, токоведущие жилы кабелей подсоединяют к положительному полюсу источника постоянного тока, отрицательный полюс которого соединяют с землей для осуществления сушки за счет использования явления электроосмоса.
2.3.4. Цеолиты
Входы: нет.
Выходы: цвет, адсорбционные свойства.
Графическая иллюстрация:
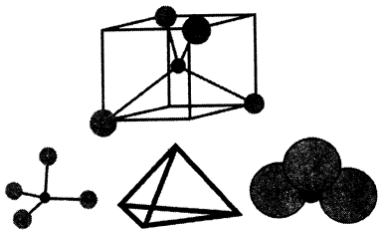
Рис.2.12. Структура кристалла цеолита:
- кислород;
кислород;
- кремний или алюминий.
кремний или алюминий.
Сущность:
Цеолиты – вещества, способные менять свои свойства (цвет, адсорбционная способность и др.) под действием других веществ или в результате изменения внешних условий.
Цеолиты являются кристаллическими водными алюмосиликатами , они относятся к группе каркасных алюмосиликатов. Каркасы цеолитов (Рис.2.12) содержат каналы и сообщающиеся между собой полости, в которых находятся ионы и молекулы воды. Катионы довольно подвижны и обычно могут в той или иной степени обмениваться на другие катионы. Чистые цеолиты бесцветны. Если катионы щелочных или щелочноземельных металлов, обычно присутствующие в синтетических цеолитов, обменять на ионы переходных металлов, цеолиты могут приобрести окраску. Если окраска индивидуального иона зависит от того, находится он в гидратизированном или безводном состоянии, окраска цеолита будет меняться со степенью гидратации.
Математическое описание:
Общая формула цеолита
Mex/n [AlxSiyO2(x+y)]×zH2O,
где
Me — металл,
n — его степень окисления,
х — число атомов алюминия,
у — число атомов кремния,
z — число молекул воды.
Применение.
1. Цеолиты используются для выделения и очистки углеводородов нефти и как катализаторы, а также для очистки, осушки и разделения газов (в т. ч. воздуха), осушки фреонов, извлечения радиоактивных элементов, создания глубокого вакуума и т.д.
2. Способность цеолитов менять цвет в присутствии паров воды используется для определения последней.
3. Каркасы цеолитов похожи на пчелиные соты и образованы из цепочек анионитов кремня и алюминия. Из-за своего строения каркас имеет отрицательный электрический заряд, и этот заряд компенсируется катионами щелочных или щелочноземельных металлов, находящимися в полостях - сотах. Цеолит (диаметр его пор) определяется соотношением кремния и алюминия и типом катионов (главным образом, это вода). Она удаляется при нагревании до 600, 800°С, сам каркас при этом не разрушается, он сохраняет первоначальную структуру. Именно поэтому цеолит способен вновь поглощать воду и другие вещества. Размером пор определяется и размер частиц, способных в них проникать. Цеолиты могут как бы просеивать молекулы, сортировать их по размерам. Кроме того, они используются как адсорбенты, которые в 10-100 раз эффективнее, чем все другие осушители и работают при различных температурах. При 190°С адсорбционная способность цеолитов резко повышается. Они поглощают даже воздух, создавая в сосуде разряжение.
4. Цеолиты используют как ионообменники, не разрушающиеся под действием излучения, а также в качестве катализаторов устойчивых к действию высоких температур, каталитических ядов, позволяют гибко менять свойства.
