
- •Конденсированные двухкомпонентные системы.
- •I. По растворимости в твердом состоянии:
- •II. По образованию химического соединения:
- •Диаграмма состояния неизоморфноплавящихся веществ.
- •Построение диаграмм плавкости.
- •Диаграммы состояния неизоморфноплавящихся веществ с обазованием устойчивого химического соеднения.
- •Диаграммы состояния изоморфноплавящихся веществ.
- •Правило рычага.
- •Построение Диаграмм состояния изоморфноплавящихся веществ.
Конденсированные двухкомпонентные системы.
Конденсированнымисистемаминазываются системы, в которых отсутствует
паровая фаза:![]() ;
;![]() .
.
Вид диаграмм состояния в двухкомпонентных конденсированных системах зависит от типа взаимодействия веществ в твердом и жидком состояниях. Все вещества классифицируются:
I. По растворимости в твердом состоянии:
а) изоморфноплавящиеся, т.е. неограниченно растворимые как в твердом, так и жидком состоянии (в твердом состоянии образуют одну фазу);
б) неизоморфноплавящиеся, т.е. неограниченно растворимые в жидком состоянии и нерастворимые в твердом состоянии ( в твердом состоянии образуют две фазы).
II. По образованию химического соединения:
а) вещества, образующие одно или несколько химических соединений;
б) вещества, которые не взаимодействуют между собой.
Диаграммы состояния двухкомпонентных конденсированных систем строят по кривым охлаждения.
Кривыми охлажденияназывается зависимость изменения температуры затвердевающих (плавящихся) веществ во времени.
Рассмотрим кривую охлаждения чистого вещества(вода).

По линии 1-2 идет кристаллизация воды при температуре кристаллизации (0 0С).
В точке 2 исчезает последняя капля жидкости (вся вода превращается в лед).
По прямой 2-3 идет охлаждение льда до температуры окружающей среды.
По правилу фаз Гиббса: С=К-Ф+n
n=2 1) Т , 2) Р
когда Р = const, тоn=1.
С=К-Ф+1
В точке 4 С=1-1+1=1 (менять можно один параметр – Т)
В точке 5 С=1-2+1-0 (ничего менять нельзя)
Теоретические кривые охлаждения несколько отличаются от практических небольшим отклонением в точке 1. Вследствие переохлаждения температура падает ниже температуры замерзания. Но в результате начала кристаллизации воды и выделении при этом теплоты кристаллизации температура быстро повышается и достигает какого-то постоянного значения.
Такой тип кривых охлаждения характерен для всех чистых веществ.
Диаграмма состояния неизоморфноплавящихся веществ.
К типу неизоморфноплавящихся веществ
относится система
![]() висмут + кадмий. Они неограниченно
растворимы в жидком состоянии, но
нерастворимы в твердом состоянии
(образуют 2 фазы). Это выражается в том,
что при затвердевании расплава
кристаллизуется один компонент, в то
время как другой остается в расплаве.
Поэтому неизоморфные смеси в твердом
состоянии неоднородны и состоят издвух
твердых фаз: кристаллов компонента
А и кристаллов компонента В.
висмут + кадмий. Они неограниченно
растворимы в жидком состоянии, но
нерастворимы в твердом состоянии
(образуют 2 фазы). Это выражается в том,
что при затвердевании расплава
кристаллизуется один компонент, в то
время как другой остается в расплаве.
Поэтому неизоморфные смеси в твердом
состоянии неоднородны и состоят издвух
твердых фаз: кристаллов компонента
А и кристаллов компонента В.
Диаграммы таких веществ имеют следующий вид:
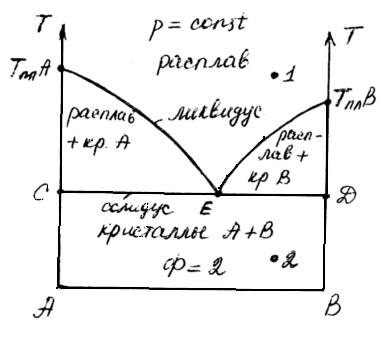
Обычно диаграммы конденсированных систем строят в координатах «состав – температура». Их также называют диаграммами плавности. На осях ординат откладывают температуры плавления чистых веществ А и В (tплAиtплB).
Линия АЕВ – это линия начала кристаллизации, которая называется линией ликвидуса. Все фигуративные точки, лежащие выше линии ликвидуса, характеризуют состав гомогенной части расплава при различных температурах.
По правилу фаз Гиббса:
точка 1 С = К-Ф+n= 2-1+1 = 2 (можно менять состав и температуру)
n=1 при Р=const(изменяется только Т)
Линия СД характеризует конец кристаллизации расплава и называется линиейсолидуса. Ниже линии солидуса вещества А и В образуют две фазы в твердом состоянии – кристаллы А и кристаллы В. Все фигуративные точки, лежащие ниже линии солидуса, характеризуют состав твердой смеси.
По правилу фаз Гиббса:
точка 2 С=К-Ф+1=2-2+1=1, т.е. при сохранении постоянства состава равновесных твердых фаз произвольно можно изменять только температуру.
Точка Е называется точкой эвтектики. Это точка соответствует равновесию между жидким раствором (расплавом) и двумя кристаллическими фазами. Такое равновесие называетсяэвтектическим равновесием.Соответствующий жидкий раствор, равновесный этим двум фазам, называетсяэвтектикой. Этим же термином обозначается и твердый продукт (сплав), образующийся при кристаллизации этого раствора и, следовательно, обладающий эвтектическим составом. Жидкий раствор называютжидкой эвтектикой, а твердый сплав –твердой эвтектикой. Эвтектические сплавы характеризуются малыми размерами и однородностью кристаллов и имеют высокие твердость и механическую прочность.
По правилу фаз Гиббса:
точка Е С=К-Ф+1=2-3+1-0, т.е. расплав эвтектического состава кристаллизуется как чистое вещество при постоянной температуре.
точка А – точка кристаллизации вещества А: С=К-Ф+n=1-2+1-0
Однако, различие между чистым веществом и эвтектикой состоит в том, что при кристаллизации чистого вещества из его расплава состав твердой фазы одинаков с составом жидкого расплава. При кристаллизации эвтектики состав жидкого расплава отличается от состава каждой из равновесных с ним твердых фаз.
Диаграммы плавности с простой эвтектикой, состоящей из чистых компонентов, встречаются довольно часто среди металлических, солевых, органических систем, например, системы Ag-Pb,Zn-Sn,Bi-Cd,KCl-LiCl,AgBr-KBr, хлорид бензоила – дифенил. Диаграммы состояния аналогичного вида характерны и для многих водных солевых систем (диаграммы растворимости), при охлаждении которых кристаллизуются эвтектические смеси, состоящие из воды и солей, называемыекриогидратами. Например, системыNH4Cl-H2O,NaNO3-H2O. Явления, связанные с образованием и свойствами эвтектик, известны очень давно. Эвтектики применяются для практических целей. Так, для пайки свинцовых водопроводных труб издавна применяется легкоплавкий припой –третник, состоящий из двух частей олова и одной части свинца, (2 масс. ч. Sn+ 1 масс. ч.Pb), очень близкий по составу к эвтектическому сплаву этих металлов.
Эвтектические смеси применяются и для получения искусственного холода, действие которых основано на поглощении теплоты при образовании жидких эвтектик из некоторых солей и снега. Например, смесь шестиводного хлорида кальция со снегом дает понижение температуры до – 50 0С (CaCl2∙6H2O+снег;t3= –500С).
