
andryush
.pdf
Для пропена, как представителя алкенов, типичны реакции электрофильного присоединения АЕ. Электронодонорная алкильная (метильная) группа, увеличивая электронную плотность π-связи, активирует ее в реакциях электрофильного присоединения по сравнению с этиленом и производными алкенов, содержащими электроноакцепторные заместители. Под действием +I-эффекта метильной группы происходит смещение электронной плотности π-связи, что приводит к возникновению частичных зарядов на атомах углерода при двойной связи.
δ- δ+
CH2 = CH CH3
В реакции с хлороводородом в роли электрофильной частицы выступает протон Н+. Электрофильное присоединение протекает через образование карбокатиона. На этой стадии разрывается π-связь и оба электрона предоставляются для образования связи с протоном. Затем карбокатион подвергается нуклеофильной атаке хлорид-ионом Cl–, что приводит к получению конечного продукта присоединения –2-хлоропропан.
δ- |
|
|
медленно |
|
|
|
|
|||||||||
δ+ |
δ+ |
δ- |
|
|
|
|
|
|
Cl |
CH3 |
- |
CH - CH3 |
||||
|
H - CH2 - CH - CH3 |
|||||||||||||||
CH = CH - CH |
+ H - Cl |
|
|
|||||||||||||
|
|
|
||||||||||||||
2 |
3 |
|
|
|
|
карбокатион |
|
|
||||||||
|
|
|
|
|
|
Cl |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Образующийся на стадии σ-комплекса вторичный карбокатион более стабилен, чем первичный (динамический фактор). Это обусловлено частичным погашением положительного заряда во вторичном карбокатионе за счет +I-эффекта двух алкильных групп.
CH2 CH2- CH3 |
CH3 CH CH3 |
Первичный |
Вторичный |
карбокатион |
карбокатион |
Стабильность карбокатиона увеличивается
Таким образом, и статический (распределение электронной плотности в молекуле до реакции), и динамический (образование более устойчивого карбокатиона в ходе реакции) факторы способствуют протеканию реакции гидрохлорирования пропена с образованием 2-хлоро- пропана. Это согласуется с правилом Марковникова, по которому
51
в реакциях гидрогалогенирования несимметричных алкенов с электронодонорными заместителями при кратной связи протон присоединяется к более гидрогенизированному атому углерода.
Наличие кратной углерод-углеродной связи в пропене можно доказать с помощью другой реакции электрофильного присоединения – реакции бромирования. При пропускании газообразного пропена через раствор брома в воде (бромную воду) происходит обесцвечивание раствора вследствие присоединения брома по кратной связи. Эта реакция служит качественной пробой для обнаружения двойной или тройной связи. В результате этой реакции бурый раствор бромной воды обесцвечивается.
|
CCl , 200C |
|
|
||
CH3 - CH = CH2 + Br2 |
4 |
|
CH3 |
- CHBr - CH2Br |
|
|
|
|
|||
пропен |
1,2-дибромопропан |
|
Задача 2. Какие продукты образуются при взаимодействии бута- диена-1,3 с хлороводородом при эквимолярном соотношении субстрата и реагента [1]?
Решение. В результате сопряжения двух двойных связей π-элек- тронная плотность в молекуле бутадиена-1,3 делокализована, т. е. распределена по всей молекуле.
Н2С = СН – СН = СН2
бутадиен-1,3 |
|
|
|
|
|
|
H |
H |
|
|
H |
H |
|
|
|
|
|
|
||
C1 = C2 |
|
H |
= |
|
C1 C2 |
H |
H |
|
|
H |
|
||
C3 |
= C4 |
|
C3 |
C4 |
||
|
|
|
||||
H |
|
H |
|
|
H |
H |
|
|
|
|
|
Для сопряженных диенов, как и алкенов, характерны реакции электрофильного присоединения. Особенностью реакции присоединения к сопряженным диенам является образование при эквимолярном соотношении субстрата и реагента наряду с обычным для алкенов продуктом 1,2-присоединения продукта 1,4-присоединения. При взаимодействии бутадиена-1,3 с хлороводородом такими продуктами соответственно являются 3-хлоробутен-1 и 1-хлоробутен-2.
52
1,1,22 –-присоединение
H-CH2 - CH - CH = CH2
Cl
CH2 = CH - CH = CH2 + HCl
H-CH2 - CH = CH - CH2Cl
1, 1,44– присоединениерисоединение
Причиной появления двух продуктов присоединения является образование карбокатиона, имеющего мезомерное строение. Так, в результате присоединения к бутадиену-1,3 протона Н+ образуется карбокатион, в котором атом С1 переходит в sp3-гибридизованное состояние и выходит из системы сопряжения. В оставшемся сопряженном фрагменте, включающем атомы С2, С3 и С4, на трех р-АО делокализованы два электрона.
CH3 - CH - CH = CH2  CH2 - CH = CH - CH3
CH2 - CH = CH - CH3
CH3 - CHCl - CH = CH2 |
CH2Cl - CH = CH - CH3 |
2-хлоробутен-1 |
1-хлоробутен-2 |
Атака хлорид-ионом мезомерного аллильного карбокатиона по С2 или С4 приводит к образованию двух продуктов присоединения, из которых более устойчив симметрично замещенный 1-хлоробутен-2. В связи с этим продукт 1,4-присоединения, т. е. 1-хлоробутен-2, преобладает в реакционной смеси.
Вопросы для самоконтроля
1.Дайте определение понятию «карбокатион».
2.Какие органические соединения способны к реакциям присоединения?
3.Сформулируйте правило присоединения Марковникова и перок-
сидный эффект Хараша.
53
Домашнее задание
Т а б л и ц а 4
Вариант |
Задание |
|
|
|
|
|
Сравните реакционную способность этилена и пентена-1 в реак- |
|
1 |
циях электрофильного присоединения. Какой продукт образует- |
|
ся при взаимодействии более активного из этих алкенов с бро- |
||
|
||
|
моводородом? Напишите механизм реакции |
|
|
|
|
|
Какие продукты получаются при взаимодействии пропена |
|
|
и 2-метилпропена с хлороводородом? Какой из этих алкенов |
|
2 |
более активен в реакциях электрофильного присоединения? |
|
|
Дайте обоснование правилу Марковникова с учетом статиче- |
|
|
ского и динамического факторов |
|
|
|
|
|
Какие продукты образуются при взаимодействии 2,3-диметил- |
|
3 |
бутадиена-1,3 с 1 моль хлороводорода? Чем обусловлено обра- |
|
|
зование продукта 1,4-присоединения? |
|
|
|
|
4 |
Какие продукты образуются при последовательном присоедине- |
|
нии 2 моль хлороводорода к изопрену? Напишите схемы реакций |
||
|
||
|
|
|
|
Какой продукт образуется в результате реакции гидратации |
|
5 |
пропена? Почему гидратация пропена происходит в присутствии |
|
|
каталитических количеств серной кислоты? |
|
|
|
|
|
Взаимодействие гептадиена-2,4 с бромом в эквимолярном соот- |
|
6 |
ношении приводит к образованию двух продуктов. Какие соеди- |
|
|
нения образуются в данной реакции? |
|
|
|
|
|
Из какого исходного алкена путем гидратации получают трет- |
|
7 |
бутиловый спирт (2-метилпропанол-2)? Напишите механизм ре- |
|
|
акции |
|
|
|
|
|
Сравните относительную стабильность карбокатионов, которые |
|
|
могли бы образоваться при присоединении протона к кратной |
|
8 |
связи С=С в молекуле акриловой (пропеновой) кислоты. Почему |
|
|
продуктом реакции гидратации пропеновой кислоты является |
|
|
β-гидрокси-, а не α-гидроксипропановая кислота? |
|
|
|
|
|
Напишите схему реакции бромирования циклопропана. В чем |
|
9 |
заключается особенность реакционной способности малых цик- |
|
|
лов? |
|
|
|
54
|
П р о д о л ж е н и е т а б л. 4 |
|
|
|
|
Вариант |
Задание |
|
|
|
|
|
Какой продукт образуется в результате реакции гидратации кро- |
|
10 |
тоновой (бутен-2-овой) кислоты? Обоснуйте сделанный вывод |
|
|
с учетом статического и динамического факторов |
|
|
|
|
|
Напишите механизм реакции присоединения иодоводорода к ак- |
|
11 |
риловой (пропеновой) кислоте. Какими факторами обусловлено |
|
|
протекание этой реакции против правила Марковникова? |
|
|
|
|
|
Расположите в ряд по уменьшению реакционной способности |
|
12 |
в реакции гидратации следующие ненасыщенные соединения: |
|
пропен, пропеновая кислота, 2-метилпропен. Для наиболее ак- |
||
|
||
|
тивного из них напишите механизм реакции гидратации |
|
|
|
|
|
Какой продукт получается в результате бромирования цикло- |
|
13 |
пентена? Рассмотрите механизм и пространственную направ- |
|
|
ленность реакции |
|
|
|
|
|
Гидрирование сопряженных диенов водородом в присутствии |
|
|
платинового катализатора протекает как 1,2- и 1,4-присоеди- |
|
14 |
нение. Напишите схему реакции присоединения 1 моль водоро- |
|
|
да к хлоропрену (2-хлоробутадиену-1,3) с образованием всех |
|
|
возможных продуктов |
|
|
|
|
|
Как идет присоединение хлороводорода к этилену, хлорвинилу, |
|
15 |
изобутилену? Расположите их в порядке возрастания скорости |
|
реакции. Для наиболее активного из них напишите механизм |
||
|
||
|
реакции гидрогалогенирования |
|
|
|
|
|
Напишите реакцию присоединения бромоводорода к 2-метил- |
|
16 |
бутену-2 в присутствии пероксида водорода. Объясните ано- |
|
мальное (против правила Марковникова) присоединение бромо- |
||
|
||
|
водорода |
|
|
|
|
|
Какие продукты получаются при взаимодействии пентена-1 |
|
|
и 2-метилпентен-1 с бромоводородом? Какой из этих алкенов |
|
17 |
более активен в реакциях электрофильного присоединения? |
|
|
Дайте обоснование правилу Марковникова с учетом статическо- |
|
|
го и динамического факторов |
|
|
|
|
|
Какой продукт образуется в результате реакции гидратации пен- |
|
18 |
тена-2? Почему гидратация пентена-2 происходит в присутствии |
|
|
каталитических количеств серной кислоты? |
|
|
|
55

О к о н ч а н и е т а б л. 4
Вариант |
Задание |
Напишите механизм реакции присоединения бромоводорода к
193,3-дихлорпропену-1. Какими факторами обусловлено протекание этой реакции против правила Марковникова?
Какие продукты образуются при последовательном присоедине-
20нии 2 моль хлороводорода к пенадиену-1,3? Напишите схемы реакций
3.2.6.Электрофильное замещение
вароматических соединениях
Для ароматических соединений бензольного ряда, конденсированных и гетероциклических ароматических соединений характерны реакции, не приводящие к нарушению ароматической системы, т. е. реакции замещения [2].
Электронная плотность π-сопряженной системы бензольного кольца является удобным объектом для атаки электрофильными реагентами.
Первичной стадией является генерирование электрофильной частицы. Она обычно образуется путем взаимодействия реагента EY с катализатором и может представлять собой либо электронодефицитную часть поляризованной молекулы реагента, либо частицу Е+ с полным положительным зарядом (после гетеролитического разрыва связи).
Поляризация |
Разрыв |
молекулы |
связи |
E Y E Y E Y
Образование π-комплекса. Первоначальная атака электрофилом π-электронного облака кольца приводит к координации реагента с π-системой и образованию комплекса донорно-акцепторного типа, называемого π-комплексом. Ароматическая система не нарушается:
+ E 




 E
E
56
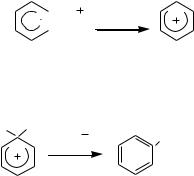
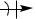
Образование σ-комплекса. Лимитирующая стадия, на ней электрофил образует ковалентную связь с атомом углерода за счет двух электронов π-системы кольца, что сопровождается переходом данного атома углерода из sp2- в sp3-гибридизованное состояние и нарушением ароматической системы кольца, молекула превращается в карбокатион.
H
 E
E
 E
E
Стабилизация σ-комплекса. Осуществляется путем отщепления от σ-комплекса протона. При этом за счет двух электронов разрывающейся ковалентной связи С–Н восстанавливается замкнутая π-система кольца, т.е. происходит возврат молекулы в ароматическое состояние:
H |
E |
|
E |
|
|
Y |
|
|
|
+ HY |
|
|
|
|
Влияние заместителей на реакционную способность и ориентацию электрофильного замещения
Заместители в бензольном кольце нарушают равномерность в распределении π-электронного облака кольца и тем самым оказывают влияние на реакционную способность кольца [2].
• Электронодонорные заместители (Д), повышающие электронную плотность кольца и увеличивающие скорость электрофильного замещения, называются активирующими.
• Электроноакцепторные заместители (А), понижающие электронную плотность кольца и уменьшающие скорость реакции, называются
дезактивирующими.
Имеющийся в кольце заместитель не только влияет на реакционную способность, но и проявляет ориентирующее действие по отношению к вводимому в кольцо электрофилу.
Ориентирующее влияние заместителей обусловлено их электронными эффектами и отражает распределение электронной плотности в молекуле субстрата. Например, в толуоле электронодонорная группа
57

повышает электронную плотность на всех атомах углерода кольца, но особенно в орто- и пара- положениях.
CH3
δ 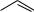 δ
δ
δ
По влиянию на реакции электрофильного замещения заместители делятся на две группы.
• Заместители I рода – электронодонорные, активирующие группы, орто- и пара-ориентанты. К ним относятся алкильные группы, проявляющие +I-эффект по отношению к соседнему sp2-гибриди- зованному атому углерода, и проявляющие +М-эффект группы:
–NH2, –NHR, –NR2, –OH |
+M >> –I |
сильно активируют |
–OCH3, –OR, –NHCOR |
+M > –I |
умеренно активируют |
–CH3 |
+I |
слабо активируют |
–C6H5, –CH = CH2 |
+M > –I |
слабо активируют |
–F, –Cl, –Br, –I |
–I > +M |
слабо дезактивируют |
Если по силе действия +М-эффект от группы превосходит
–I-эффект, то орто- и пара-ориентант обогащает бензольное ядро электронной плотностью. В деформированной π-системе эта плотность у атомов углерода повышается неравномерно, и в орто- и пара- положениях возникает частичный отрицательный заряд, облегчая атаку электрофила в этих положениях.
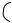 OCH3
OCH3
|
|
|
|
|
δ |
|
|
|
δ |
|
|
|
|
|
|
|
|
|
|
δ
Вместе с тем среди заместителей 1-го рода есть такие, в которых – I-эффект>+M-эффекта. Тогда электронная плотность в ядре понижается и оно становится менее доступным для атаки электрофилов. Однако
58
в орто- и пара-положениях она понижается незначительно. Поэтому электрофильное замещение галогенбензола протекает труднее, чем самого бензола.
• Заместители II рода – проявляют электроноакцепторный характер за счет отрицательных индуктивного или мезомерного эффектов. Это дезактивирующие группы, мета-ориентанты:
–С ≡ N, –CHO, –COR, –COOH, |
–I, –M |
умеренно дезактивируют |
–COOR, –SO3H |
|
|
–CF3, –CCl3 |
–I |
сильно дезактивируют |
–NO2 |
–I, –M |
сильно дезактивируют |
δ
=  C
C
O
OH
δ δ
Правила ориентации в дизамещенных аренах. В дизамещенных производных бензола ориентирующее влияние заместителей будет согласованным, если заместители направляют электрофильный реагент в одни и те же положения кольца.
CH3
 NO2
NO2
При несогласованной ориентации заместители конкурируют между собой и можно предсказать основное направление реакции, руководствуясь следующими обобщениями.
1. Если в кольце есть активирующая и дезактивирующая группы, то ориентация электрофильного реагента определяется главным образом активирующей группой
OH
COOH
59
2. Атакующий электрофил, как правило, не замещает водород в кольце между двумя заместителями, находящимися в мета-положении относительно друг друга (стерические препятствия)
OH
Br
3. Если в бензольном кольце имеются сильная и слабая активирующие группы, то ориентация в основном определяется сильной активирующей группой
OH
CH3
3.2.7. Обучающие задачи
Задача 1. Кумол (изопропилбензол) является основным продуктом для промышленного синтеза фенола и ацетона. Предложите пути алкилирования бензола с целью получения кумола.
Решение. Для замещения в ароматическом кольце атома водорода на алкильную группу используют реакцию алкилирования. Электрофильный алкильный реагент могут получить из галогеноалканов с участием катализатора – кислоты Льюиса (алкилирование по Фриделю– Крафтсу), а также алкенов или спиртов в сильнокислой среде. Для введения в бензольное кольцо изопропильного радикала в качестве реагентов можно использовать 2-хлоропропан (изопропилхлорид), пропен или пропанол-2 (изопропиловый спирт).
CH |
|
|
|
|
|
CH |
|
|
|
|
|
|
|
|
CH3 |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
3 |
|
|
|
δ |
3 |
|
|
|
|
|
δ |
|
|
|
|
|
|
|||
CH - Cl |
+ AlCl |
|
|
CH |
|
|
Cl |
|
|
|
AlCl |
|
|
|
CH + AlCl4 |
||||||
|
|
3 |
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
CH3 |
|||||||
|
|
|
Комплекс с кислотой Льюиса |
Изопропильный |
|||||||||||||||||
|
|
|
|
о |
|
|
екс с |
исл той ьюиса |
|
|
|
|
|
|
|||||||
карбокатион
карбокатион
60
