
- •Следовательно, искомое уравнение имеет вид
- •2. Фотометрический метод анализа
- •Решение
- •3. Поляриметрический метод анализа
- •Пример 1
- •4. Потенциометрический метод анализа
- •4.1. Вычисление электродных потенциалов и напряжения
- •4.2. Потенциометрическое определение рН – прямая потенциометрия
- •4.3. Потенциометрическое титрование
- •4.4. Окислительно-восстановительное титрование
- •Потенциометрическое титрование по методу осаждения
- •5. Кондуктометрический метод анализа
- •Основные величины, используемые в кондуктометрии
- •6. Кулонометрический метод анализа
- •7. Полярография и амперометрия
- •8. Хроматографический метод анализа
- •Список литературы
- •Приложение 1 Атомные, групповые рефракции и рефракции связей
- •Приложение 2 Стандартные окислительно-восстановительные (редокс) потенциалы в водных растворах при 25 с
- •Приложение 3 Потенциалы электродов сравнения при 25 с
- •Приложение 4 Константы ионизации некоторых кислот (Ка) и оснований (Кb) при 25 с
- •Приложение 5 Произведения растворимости малорастворимых в воде соединений (при 25 с)
- •Оглавление
- •Приложение 2. Стандартные окислительно-восстановительные (редокс) потенциалы в водных растворах при 25 с 70
Сравните найденную рефракцию с вычисленной по таблицам атомных рефракций и рефракций связей.
Решение: Формула четыреххлористого углерода CCl4.
1. Определяем молярную рефракцию CCl4 по правилу аддитивности, суммируя:
а) рефракции атомов
 см3/моль;
см3/моль;
б)
рефракции связей
 см3/моль.
см3/моль.
2. Вычисляем молярную рефракцию CCl4 по формуле Лорентца–Лоренца, используя опытные данные:

 ,
,
 .
.
Теоретическое значение R(CCl4) и рассчитанное по рефракциям атомов хорошо согласуются.
Пример 2. Для определения состава водно-ацетоновых растворов были определены показатели преломления стандартных растворов, приведенных ниже:
|
Содержание ацетона, % |
10 |
20 |
30 |
40 |
50 |
|
Показатель преломления |
1,3340 |
1,3410 |
1,3485 |
1,3550 |
1,3610 |
Построить калибровочный график для определения ацетона, вывести уравнение зависимости показателя преломления от концентрации и определить по графику и уравнению содержание ацетона в растворе, показатель преломления которого равен 1,3500.
Решение. Строим график зависимости показателя преломления n от концентрации (%) (см. рисунок).
1. Уравнение калибровочного графика определяем методом избранных точек. Для этого выбираем на концах прямой точки: для концентрации 15 % n= 1,338 и для концентрации 45 % n= 1,358. Составим два уравнения:
1,358 = А + В45,
1,338 = А + В15.
Решаем
эти уравнения и получаем: 
А = 1,3279 и В = 6,710–4.
Следовательно, искомое уравнение имеет вид
n =1,3279 + 6,710–4
2. По калибровочному графику находим, что показателю преломления 1,3500 соответствует концентрация 33 %. Подставив значение показателя преломления в наше уравнение, получаем:
1,3500 = 1,3279 + 6,710–4 .
Отсюда находим массовую долю ацетона в водно-ацетоновой смеси:

2. Фотометрический метод анализа
В основе измерений и расчетов фотометрического метода лежит закон светопоглощения окрашенных растворов – закон Бугера–Ламберта–Бера: оптическая плотность А растворов прямо пропорциональна молярной концентрации поглощающего вещества С, толщине слоя l и молярному коэффициенту поглощения :

где I0, It – значения силы тока до (I0) и после (It) поглощения.
Расчеты включают:
определение по градуировочному графику в координатах А – C как оптической плотности А, так и концентрации вещества С;
определение А, С и по уравнению Бугера–Ламберта–Бера.
Пример 1.
Для определения меди в цветном сплаве навеску 1,5 г сплава после растворения обработали аммиаком и получили 500 мл окрашенного раствора, оптическая плотность которого при толщине слоя 5 см равна 0,127. Молярный коэффициент поглощения аммиаката меди равен 423. Определите массовую долю меди в сплаве.
Решение: для решения задачи используем уравнение Бугера–Ламберта–Бера.
Рассчитываем концентрацию меди (в моль/л):

Определяем содержание меди в 500 мл раствора (г):
610–563,54 г – 1000 мл
х г – 500 мл
 ,
,
где 63,54 – молярная масс атома меди.
Определяем массовую долю в сплаве (в %):


Пример 2.
Какая толщина окрашенного раствора необходима для ослабления светового потока в 10 раз, если молярный коэффициент поглощения равен 4700, а концентрация раствора 10–4 моль/л?
Решение:
используем уравнение Бугера–Ламберта–Бера
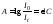 .
.
Зная,
что
 есть
ослабление светового потока, после
подстановки данных в уравнении получим:
lg 10
= 470010–4
l.
есть
ослабление светового потока, после
подстановки данных в уравнении получим:
lg 10
= 470010–4
l.
Откуда

Пример 3.
Для
определения кремния в сталях в виде
кремнемолибденового комплекса был
построен градуировочный график в
координатах оптическая плотность А
– концентрация диоксида кремния
 по
следующим данным:
по
следующим данным:
|
|
0,2 |
0,4 |
0,6 |
0,8 |
1,0 |
|
А |
0,15 |
0,29 |
0,43 |
0,61 |
0,74 |
Навеску стали 0,253 г растворили в кислоте и после соответствующей обработки получили 100 мл окрашенного раствора кремнемолибденового комплекса с оптической плотностью 0,56.
Определить
содержание Si
(в
%) в стали.
Решение
Строим градуировочный график в координатах А –
 .
.По графику при А = 0,56 определяем
 =
0,75 мг/мл.
=
0,75 мг/мл.Рассчитываем содержание SiO2 (в г) в 100 мл раствора: х = 100 0,75 = 75 мг = = 0,075 г.
Определяем содержание Si в навеске:
60,085 г SiO2 – 28,086 г Si
0,075 г – х
 г,
г,
где 60,085 – молярная масса SiO2; 28,086 – молярная масс Si.
Рассчитаем содержание Si (в %) в стали:


3. Поляриметрический метод анализа
Поляриметрический метод анализа основан на измерении вращения плоскости поляризации света оптически активными веществами. Существуют количественные зависимости между концентрацией оптически активных веществ в растворах и направлением (или углом) вращения поляризованного света.
= [] C l,
где – угол вращения плоскости поляризации, градусы; [] – удельное вращение или угол вращения плоскости поляризации луча раствором, содержащим 1 г оптически активного вещества в 1 см3 при толщине слоя раствора l = 1 дм; С – концентрация вещества, г/мл; l – толщина слоя оптически активного вещества, дециметры.
