
- •Распределение максвелла–больцмана
- •Распределение по координатам и импульсам
- •Распределение Максвелла
- •Распределение по импульсам
- •Распределение по скоростям
- •Средняя квадратичная проекция скорости
- •Распределение в сферических координатах
- •Распределение по модулю скорости
- •Наиболее вероятная скорость
- •Средняя скорость
- •Средняя квадратичная скорость
- •Распределение по энергии
- •Наиболее вероятная энергия
- •Средняя энергия
- •Плотность потока импульса
- •Плотность потока энергии
- •ВыТекание газа из отверстия сосуда в вакуум
- •Термоэлектронная эмиссия
- •Время выхода частицы из потенциальной ямы
- •Распределение Больцмана
- •Получение распределения
- •ФормулА Больцмана
- •Газ в центрифуге
- •Ориентационная поляризация диэлектрика
- •Термодинамические потенциалы Основные положения
- •Химический потенциал
- •Электрохимический потенциал
- •Внутренняя энергия
- •Равновесие двухфазной системы
- •Получение химического потенциала системы
- •Активность системы
- •Термодинамический потенциал Гиббса
- •Распределение частиц по состояниям
- •Большое каноническое распределение
- •Распределение микросостояний по фазовому пространству
- •Интеграл состояния
- •Большое каноническое распределение
- •Вопросы коллоквиума
- •Вопросы экзамена
Термодинамические потенциалы Основные положения
Статистическая величина, например плотность вероятности, характеризует микросостояние.
Термодинамическая величина, например внутренняя энергия, характеризует макросостояние и является средним по микросостояниям фазового ансамбля.
Термодинамический потенциал зависит от состояния системы и не зависит от пути перехода к этому состоянию. Понятие ввел Гиббс в 1874 г.
Рассмотрим
систему, состояние которой определяется
набором термодинамических параметров
![]() .
Если переход между точками
.
Если переход между точками
![]()
не
зависит от формы пути, то выбираем путь,
состоящий из участков, параллельных
осям, тогда изменение потенциала
![]() выражаетсяполным
дифференциалом
выражаетсяполным
дифференциалом
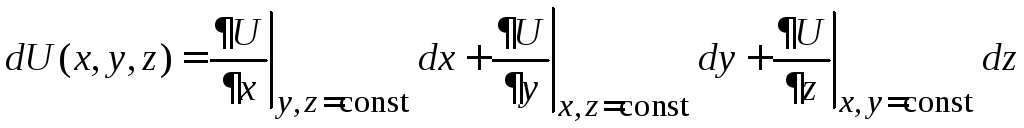 .
.
Термодинамические потенциалы зависят от трех аргументов и отличаются их выбором:
внутренняя энергия
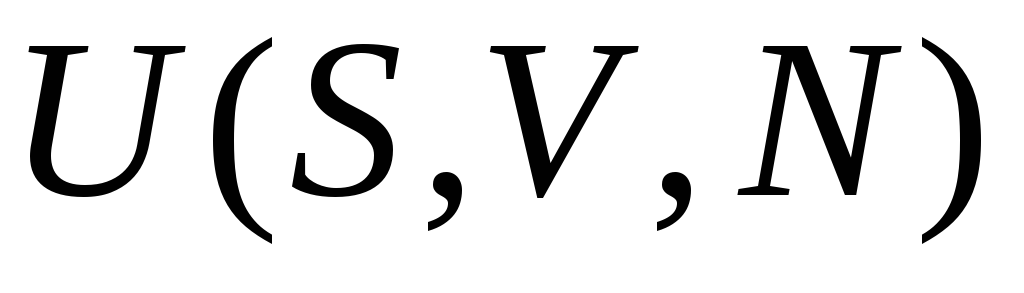 ,
,свободная энергия
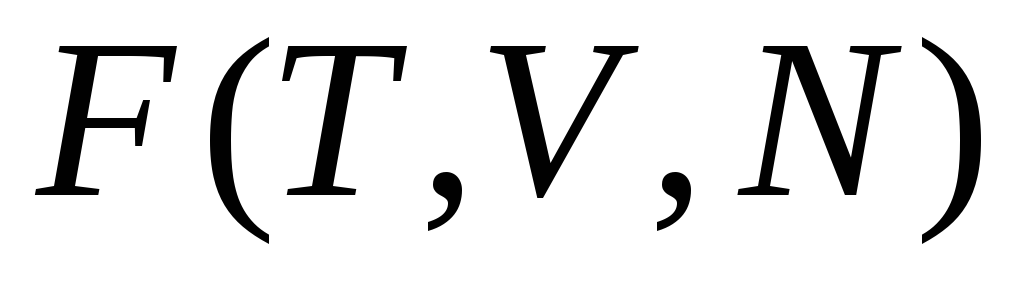 ,
,
химический потенциал
 ,
,
энтропия
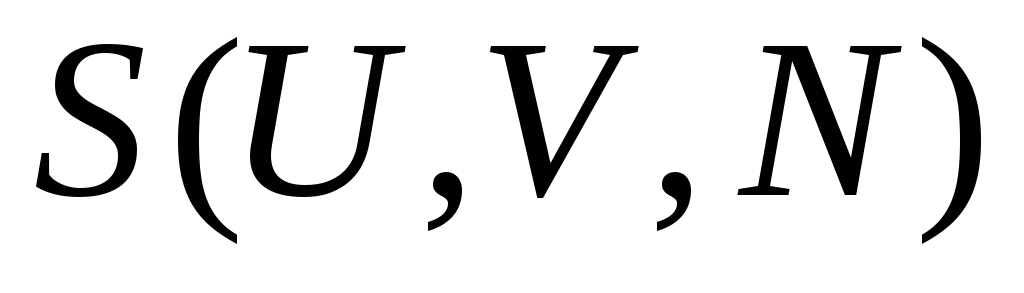 ,
,термодинамический потенциал Гиббса
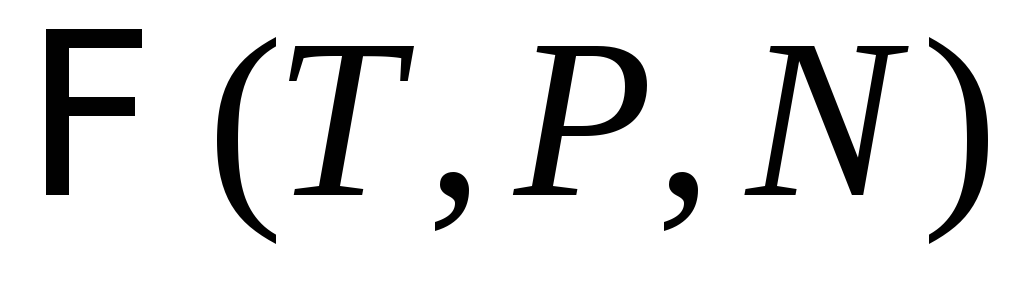 ,
,-потенциал
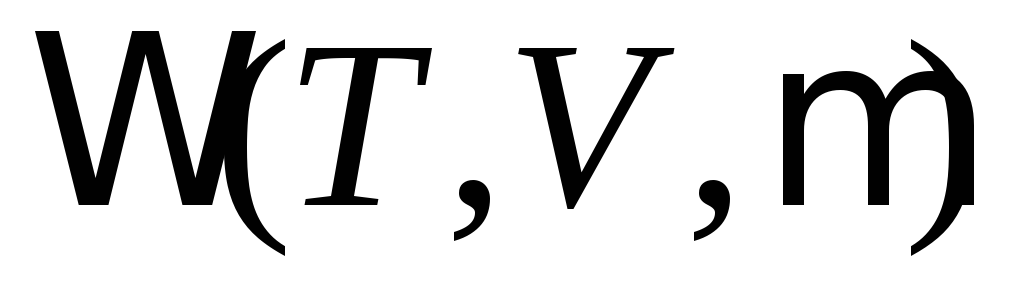 .
.
Потенциалами не являются:
работа A,
теплота Q.
Соотношения между потенциалами, полученные при постоянном N, сохраняются при переменном N.
Условие равновесия системы. Если для рассматриваемого процесса выбрать потенциал, аргументы которого не изменяются в ходе процесса, тогда в равновесном состоянии выбранный потенциал минимален.
Химический потенциал
В
систему добавляем частицу, в результате
изменяется часть термодинамических
параметров ![]() Выбираем тот термодинамический потенциал,
у которого два аргумента не меняются
при добавлении частицы. Химический
потенциал равен изменению термодинамического
потенциала при добавлении частицы в
систему,
если неизменны остальные переменные,
от которых зависит потенциал.
Выбираем тот термодинамический потенциал,
у которого два аргумента не меняются
при добавлении частицы. Химический
потенциал равен изменению термодинамического
потенциала при добавлении частицы в
систему,
если неизменны остальные переменные,
от которых зависит потенциал.
При
![]() получаем
получаем
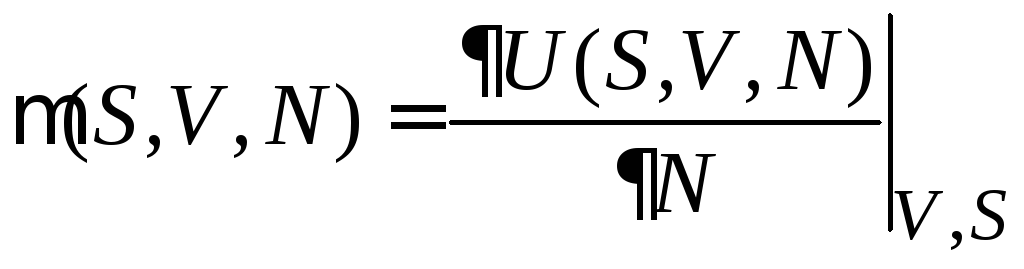 .
.
Химический потенциал равен изменению внутренней энергии при добавлении частицы, если система имеет постоянный объем и не обменивается теплом (S = 0).
Химический потенциал имеет размерность энергии и равен изменению полной энергии системы при приближении частицы к частицам системы. Если частицы взаимно притягиваются, то химический потенциал отрицательный, т. к. сближение частиц уменьшает энергию взаимодействия. Если частицы отталкиваются, то химический потенциал положительный, т. к. сближение частиц увеличивает энергию взаимодействия.
Химический
потенциал характеризует активность
процессов, упорядочивающих частицы
системы. Ее состояние является результатом
«конкуренции» между химическим
потенциалом и тепловой энергией ![]() .
.
От химического потенциала зависит число частиц в одном состоянии. Поэтому химический потенциал находится из условия нормировки на число частиц системы. Если число частиц не сохраняется, то химический потенциал равен нулю.
Электрохимический потенциал
Характеризует систему во внешнем поле
![]() ,
(2.59)
,
(2.59)
– химический потенциал без поля;
u(r) – энергия частицы в поле.
Далее доказано, что электрохимический потенциал одинаков во всех точках равновесной системы
![]() ,
,
поэтому он характеризует не частицу, а систему частиц.
В электростатическом поле
![]() ,
,
(r) – потенциал точки поля, где находится частица с зарядом q.
Химический потенциал ввел Гиббс в 1875 г.,
электрохимический потенциал – Эдвард Арманд Гуггенгейм в 1929 г.
