
4. Эмпирические правила изоморфизма
..docxЭмпирические правила изоморфизма
-
Правило Ретгерса: удельный вес или удельный объем изоморфной смеси (твердого раствора) является аддитивной функцией объемов (удельных весов) тех исходных компонентов, из которых она образована.
-
Правило Вегарда: размер элементарной ячейки (или среднее межатомное расстояние) изоморфной смеси (твердого раствора) является аддитивной функцией параметров ячейки чистых компонентов (межатомных расстояний), из которых она образована.
3) Основное правило Гольдшмидта: изоморфные смеси образуются в широких пределах при температурах, лежащих далеко от точки плавления, если ионные радиусы взаимозамещающихся структурных единиц различаются не более, чем на 15% от меньшего значения при тождестве знака заряда.
КСl
и КВr
(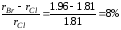 )
− совершенный изоморфизм
)
− совершенный изоморфизм
КСl
и KI
( )
– ограниченный изоморфизм
)
– ограниченный изоморфизм
КСl
и NaCl
(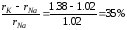 )
− изоморфизм отсутствует
)
− изоморфизм отсутствует
Мд КСl и NaCl не наблюдается(20), то при 500°С эти соединения полностью смешиваются, т.е. существует совершенный изоморфизм. При охлаждении твердый раствор распадается на исходные фазы.
Это ориентировочное значение и его нельзя рассматривать в отрыве от тд факторов.
Относимо к ионным кристаллам. Так, Na+ и Сu+ не могут замещать друг друга вследствие резкой разницы в типах их химической связи. Буквально, то нужно ожидать одной и той же способности к взаимным замещениям данной пары элементов А и В, в какой бы системе это ни происходило. Однако влияния химического (кристаллического) окружения на степень проявления изоморфизма, а также примеры, когда недействительным. Он не является достаточным, и иногда не является необходимым.
-
Аналогом пр. Гольдшмидта для металлических и ковалентных кристаллов правило 15%-ной разницы атомных диаметров Юм-Розери (1934).
5) В.С. Соболев (1948) и А.С. Поваренных (1964) наметили корреляцию между типом диаграммы плавкости, по Розебому, и относительной разницей размеров Δr/r1 или ΔR/R1 (r – радиусы ионов, Δr – разность радиусов замещающих друг друга ионов, R – межатомные расстояния). Если
ΔR/R1 < 4–5% – изоморфные замещения непрерывны при всех температурах;
4–5% < ΔR/R1 < 8–10% – изоморфизм совершенный (непрерывный) только при
средних и высоких температурах (>100–400°С);
8–10% < ΔR/R1 < 14–16% – изоморфизм ограниченный, с понижением температуры
происходит распад изоморфных смесей;
14–16% < ΔR/R1 < 20–25% – изоморфизм становится ограниченным даже при самых
высоких температурах;
ΔR/R1 > 20–25% – заметных замещений обычно не наблюдается.
6) Гольдшмидт, Ферсман.
Электроотрицательность – величина, характеризующая способность атома к поляризации ковалентных связей. Если в двухатомной молекуле А–В образующие связь электроны притягиваются к атому В сильнее, чем к атому А, то атом В считается более электроотрицательным, чем А. Получены шкалы (ЭО) для различных валентных состояний атомов, для ионов, молекул и групп атомов (Бацанова и Луо-Бенсона)..
Изоморфная взаимозаместимость (ее пределы при данной температуре) тем меньше, чем больше отличаются электроотрицательности замещающих друг друга атомов (при прочих равных условиях).
Различие электронного строения атомов и разным характером образуемых ими химических связей объясняется отсутствие или ограниченность изоморфизма близких по размерам, но отличающихся по электроотрицательности пар, как К+ и Ag+ Na+ и Сu+ Са2+ и Cd2+
7) Правило полярности (направленности) Гольдшмидта:
а) изовалентное замещение: ион с меньшим радиусом будет входить в общую кристаллическую структуру легче, чем ион с большим радиусом, занимающий ту же позицию. (Na+ охотнее замещает K+ в KCl, чем более крупный K+ будет замещать Na+ в NaCl).
б) гетеровалентное замещение: ион с бóльшим зарядом входит в кристалл легче, чем ион с меньшим зарядом, занимающий ту же кристаллографическую позицию. (Mg2+ может замещаться на Sc3+, а обратное замещение маловероятно (rMg(2+) = 0.72 Ǻ, rSc(3+) = 0.75 Ǻ).
в) Ион с меньшим радиусом или бóльшим зарядом входит как примесь в кристаллическую структуру легче, чем ион с бóльшим радиусом или меньшим зарядом (правило полярности Гольдшмидта–Ферсмана).
На фоне стремления смешанного кристалла к минимуму электростатической энергии вхождение в структуру иона с меньшим размером или бóльшим зарядом “укрепляет решетку”, т.е. является “энергетически выгодным”.
8) Закон диагоналей Гольдшмидта–Ферсмана
 В
диагональных направлениях табл увеличение
радиуса на 6–10% сопровождается
одновременным увеличением заряда. Это
обеспечивает наиболее благоприятные
условия для гетеровалентного изоморфизма.
Диагональные ряды изоморфизма. Стрелки
указывают на направленность (полярность)
изоморфизма. Иногда направление
заменяется на вертикальное, (Zr4+–
Hf4+,
Nb5+–Ta5+,
Mo6+–W6+).
Это следствие “лантаноидного сжатия”
– уменьшения радиусов Ln-элементов
с ростом Z
приблизительно на 0.2 Ǻ, в результате
которого размеры указанных выше пар
атомов оказываются чрезвычайно близки.
Так Hf
вообще не образует в природе собственных
минералов и был обнаружен в рудах
циркония.
В
диагональных направлениях табл увеличение
радиуса на 6–10% сопровождается
одновременным увеличением заряда. Это
обеспечивает наиболее благоприятные
условия для гетеровалентного изоморфизма.
Диагональные ряды изоморфизма. Стрелки
указывают на направленность (полярность)
изоморфизма. Иногда направление
заменяется на вертикальное, (Zr4+–
Hf4+,
Nb5+–Ta5+,
Mo6+–W6+).
Это следствие “лантаноидного сжатия”
– уменьшения радиусов Ln-элементов
с ростом Z
приблизительно на 0.2 Ǻ, в результате
которого размеры указанных выше пар
атомов оказываются чрезвычайно близки.
Так Hf
вообще не образует в природе собственных
минералов и был обнаружен в рудах
циркония.
«звезды изоморфизма», показывают в обобщенной форме совокупности элементов, связанных с некоторыми элементами изоморфными отношениями. Наиболее тесные изоморфные отношения K обнаруживает со своими ближайшими соседями (Na, Rb, Ba) и менее прочные – с более далекими (Sr, Tl, Cs, Ln).
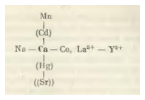


9) правило кристаллохимической компенсации:
если Ва2+ замещается на Ln3+, то лучшей компенсацией избыточной валентности является одновременное замещение другого иона Ва2+ на К+:
2Ва2+ → Ln3+ + К+
10) Макаров - общий физико-химический критерий возможности изоморфных замещений – принцип индифферентности.
Изоморфные смеси образуются элементами, которые в двойных (металлических) системах не взаимодействуют друг с другом с образованием химических соединений.
