
- •1. Общая характеристика и классификация методов исследования.
- •2. Колебательная спектроскопия.
- •3. Метод ядерного магнитного резонанса.
- •4. Метод электронного парамагнитного резонанса.
- •5. Микроволновая спектроскопия.
- •6. Рентгеновская кристаллография.
- •7. Метод ядерного квадрупольного резонанса.
- •8. Метод ядерного гамма - резонанса.
- •9. Методы электронной уф-спектроскопии
- •10. Методы масс-спектрометрии.
- •11. Дополнительные вопросы для получения превосходной оценки:
- •7.1. Рекомендуемая литература.
10. Методы масс-спектрометрии.
10.1. Методы ионизации: электронный удар, фотоионизация, электростатическое неоднородное поле, химическая ионизация. Комбинированные методы. Ионный ток и сечение ионизации. Зависимость сечения ионизации от энергии ионизирующих электронов (от ускоряющего потенциала). Потенциалы появления ионов. Принципиальная схема масс-спектрометра Демпстера. Вертикальные и адиабатические электронные переходы.
10.2. Принципиальная схема масс-спектрометра Демпстера. Фокусирующее действие однородного поперечного магнитного поля (фокусировка по направлению). Электростатическая фокусировка цилиндрическим конденсатором (фильтрация ионов по энергии). Двойная фокусировка. Разрешающая сила масс-спектрометра. Ионный источник. Система напуска. Молекулярное течение газа.
10.3. Типы ионов в масс-спектрометрах: молекулярные, осколочные, метастабильные, перегруппировочные, многозарядные и отрицательные. Диссоциативная ионизация. Динамические масс-спектрометры. Времяпролетный масс-спектрометр. Квадрупольный масс-спектрометр (фильтрат масс). Спектрометр ион-циклотронного резонанса.
10.4. Применение масс-спектрометрии в химии. Идентификация веществ. Роль разрешения, потенциалов появления, методов ионизации, метастабильных ионов в идентификации веществ. Таблицы массовых чисел. Соотношение изотопов. Корреляция между молекулярной структурой и масс-спектрами. Измерение потенциалов появления ионов и определение потенциалов ионизации и энергии разрыва связей. Преимущества фотоионизации.
10.5. Масс-спектральные термодинамические исследования. Определение парциальных давлений компонентов газовых смесей. Условия испарения вещества. Диффузионная ячейка Кнудсена. Связь ионного тока с парциальным давлением пара в ячейке Кнудсена. Определение теплоты сублимации веществ, теплоты реакции и константы равновесия. Проблема расшифровки масс-спектра.
11. Дополнительные вопросы для получения превосходной оценки:
11.1. Общие принципы методов рентгеновской и фотоэлектронной спектроскопии. Параметры и структура спектров. Применение методов в химии.
11.2. Применение методов фотоэлектронной спектроскопии в химии. Структурно-аналитическое применение. Количественный анализ. Теоретическое моделирование и объяснение химических сдвигов. Определение химических элементов и энергий связи электронов на внешних и внутренних оболочках атомов. Применение метода для исследования твердых тел.
11.3. Спектроскопические и дифракционные методы. Соотношение амплитуд рассеяния в дифракционных методах. Области применения рентгенографии, электронографии и нейтронографии в химии.
Задачи
3. Структуры каких веществ изображены на рисунке? Назовите тип решётки, определите число формульных единиц, координационный полиэдр и координационные числа атомов.





3. Структуры каких веществ изображены на рисунке? Назовите тип решётки, определите число формульных единиц, координационный полиэдр и координационные числа атомов.






Подсказка:
Изображены структуры: графита P63/mmc, CaF2 (флюорита Fm3m, к.ч.=8,4, ThO2, Li2O, Na2O, Na2S); TiO2 (рутила P42/mnm к.ч.=6,3), Mg P63/mmc (α-Co, α-Be), Cu Fm3m (Au, Ag, Al, γ-Fe), α-Fe Im3m (Na, K, Ba), алмаза Fd3m, FeS2 (пирита Pa3 к.ч.=6,3), CO2 (Pa3 к.ч.=2,1), ZnS (сфалерита F43m к.ч.=4 и вюртцита P63mc к.ч.=4), NiAs (никелина P63/mmc к.ч.=6), BN (P6m2 к.ч.=3), NaCl (Fm3m к.ч.=6), CsCl (Pm3m к.ч.=8), β-SiO2 (кристобалита Fd3m к.ч.=4,2,).
3. Привести общий вид ЭПР-спектра радикала CD3* и определить расстояние между линиями в его сверхтонкой структуре aD, если константа СТС аН для СН3* равна 2.25 мТ, а магнитные моменты ядер в единицах ядерного магнетона равны 2.792µяд (для водорода) и 0.857µяд, для дейтерия, I(2D) = 1.
3. Рассчитайте величины межплоскостных расстояний d и углов 2 для плоскостей с (hkl) = (111) и (200), полученных на рентгенограмме кубического кристалла с Р-решёткой и параметром а = 5.0 Å при съемке на CuK-излучении ( = 1.5418 Å). Предскажите и схематически отобразите рентгенограмму для отражений до семейства плоскостей с (hkl) = (200).
3. Рассчитайте величины межплоскостных расстояний d и углов 2 для плоскостей с (hkl) = (222) и (321), полученных на рентгенограмме кубического кристалла с I-решёткой и параметром a = 6.0 Å при съемке на CuK-излучении ( = 1.5418 Å). Предскажите и схематически отобразите рентгенограмму для отражений до семейства плоскостей с (hkl) = (222).
3. Параметр примитивной кубической ячейки US = 5.484 Å. На каких углах 2 с использованием CuK – излучения ( = 1.5418 Å) могут быть зарегистрированы рефлексы для плоскостей (111), (220) и (400)?
3. Рентгенограммы поликристаллических веществ А и В с кубической структурой содержат разное количество пиков, поскольку вещество А имеет элементарную ячейку типа P, а вещество В ячейку типа I. Для какого из веществ в рентгенограмме меньше пиков и почему?
3. Рентгеновские исследования показали, что KSiH3 (М=70.18) с периодом решетки 7.15 Å имеет решётку типа NaCl с атомами калия и ионами SiH3 в узлах. Вычислите плотность кристалла. Рассчитайте расстояние в Å между ближайшими ионами K и SiH3 в решетке. Предскажите и схематически отобразите рентгенограмму до семейства плоскостей с (hkl) = (222) при использовании рентгеновских лучей с =1.791 Å.
Атомная единица массы (а.е.м.) = 1.6610-27 кг; NA = 6.0221023 моль-1.
3. Приведите общий вид спектра ЭПР ион радикала пиридилия (C5H5N)-. Константы СТВ a(14N) равна 1,6 мТ, а для α-, β- и γ- протонов аН имеют значения 0.128, 0.412 и 0.856 мТ, соответственно.
3. При облучении γ-излучением пентафторида фосфора при 300К образуются радикалы тетрафторида фосфора 3IPI9F4* (спины ядер 31Р и 19F равны 1/2). Эти радикалы дают ЭПР спектр с центром при 339.6 мТ в радиоспектрометре с рабочей частотой 9.5 ГГц, при этом a(31Р) = 135 мТ, a(19F ) = 20 мТ. Определите g-фактор образующихся радикалов и приведите общий вид ЭПР-спектра.
3. Изобразите спектр радикала *СН2ОН, если расстояние между пиками в дублете равно 0.12 мТ, а между центрами дублетов -1.8 мТ.
3. При облучении молекулярного водорода жестким УФ-излучением могут образовываться частицы различного состава и строения Н*, Н2+, Н3+, Н3. Как будут выглядеть их ЭПР-спектры и можно ли обнаружить их в смеси, если предположить, что указанные формы присутствуют в заметных концентрациях?
3. При взаимодействии ферроцена с сильными окислителями, например йодом, образуются, так называемые, комплексы с переносом заряда. Привести общий вид спектра ЭПР ион-радикала ферроцена (C5H5)2Fe-, т.е. определить количество линий и соотношение их интенсивностей. Будут ли все линии наблюдаться в прямом спектре?
3. В этиленовом радикале Н'Н''С=С*Н все протоны неэквивалентны. Константы сверхтонкого взаимодействия с протонами, соответственно, равны a(Н') = 3.42 мТ; a(Н'') = 6.85мТ ; a(Н) = 1.57мТ. Привести ожидаемый спектр ЭПР.
3. Приведите общий вид спектра ЭПР соединений [V(NH3)6]Cl2, [Ti(NH3)4]Cl2 и K3(CoBr6) при слабом нулевом поле. Объясните причину парамагнетизма частиц. Спины ядер I(51V и 57Co) = 7/2, I(49Ti ) = 5/2.
3. Приведите общий вид спектра ЭПР соединений K4(MnF6), K3(CrF6) и K4[Co(CN)6] при сильном нулевом поле. Объясните причину парамагнетизма частиц. Спины ядер I(51Mn) = 5/2, I(52Cr) = 0, I(57Co) = 7/2.
3. Приведите общий вид спектра ЭПР соединений [V(NH3)6]Cl2, [Ti(NH3)4]Cl2 и K3(CoBr6) при сильном нулевом поле. Объясните причину парамагнетизма частиц. Спины ядер I(51V и 57Co) = 7/2, I(49Ti ) = 5/2.
3. Приведите общий вид спектра ПМР и соотношения интегральных интенсивностей в них для трех изомеров дихлорпропана С3Н6С12
3. Спектр ПМР соединения (С4Н8О3) представляет триплет, квадруплет и два синглета с отношением интегральных интенсивностей 3:2:2:1. Химические сдвиги мультиплетов составляют 1,1; 3,6; 4,2 и 11,1м.д. Изобразите общий вид такого спектра и определите структуру молекулы.
3. По спектру ПМР определить структуру соединения с брутто формулой C7H12O4.

3. Привести структуру одного из изомеров кислоты С3Н6ВгСООН в соответствии со спектром ПМР.

3. Какому из изомеров дихлорпропана принадлежит спектр?

3. По спектру ПМР определить структуру соединения с брутто формулой C8H11NO.
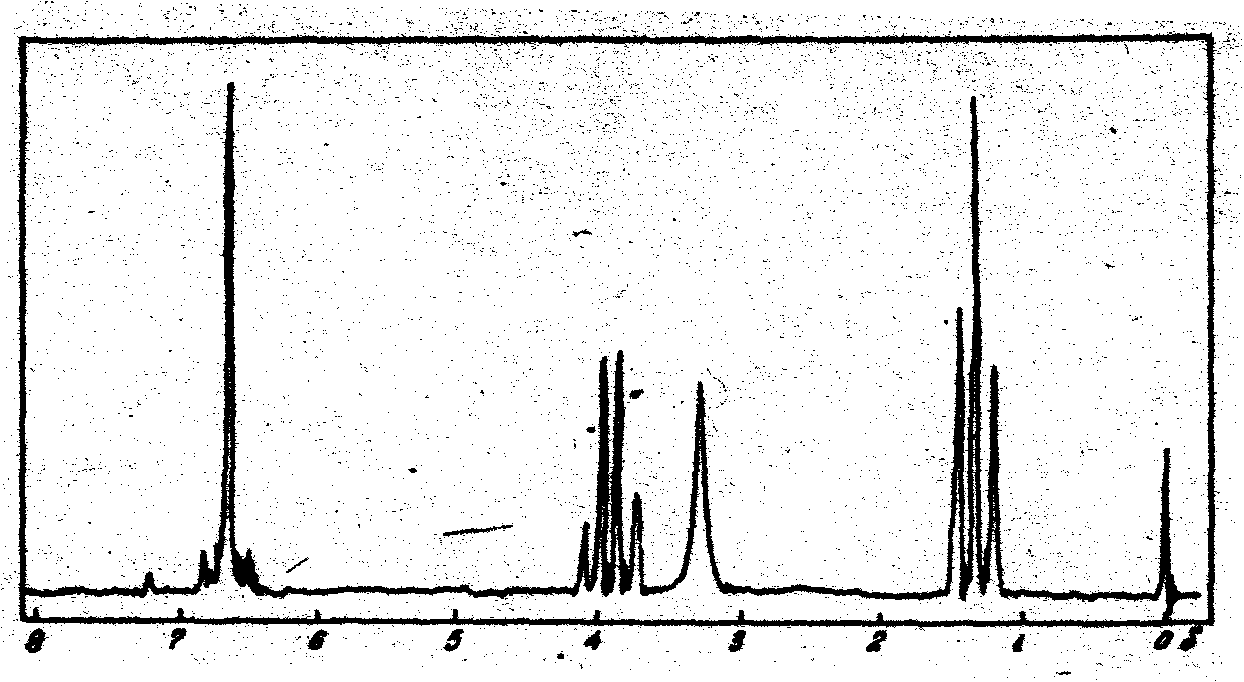
3. В спектре ПМР смеси двух веществ (С2Н2Вг2) и (С2Н2С12) наблюдаются два синглета с соотношением интенсивностей 1:2. Каковы возможные структуры веществ и их мольные концентрации?
3. ПМР-спектр смеси, содержащей циклогексан, тетраметилсилан, хлороформ и бензол содержит четыре синглета одинаковой интенсивности с химическими сдвигами 0; 1,4; 7,2 и 7,4 м.д. Сделайте отнесение всех сигналов к конкретным веществам и определите количественный состав смеси.
3. Спектр ПМР низкого разрешения для соединения (C8H11NO) содержит четыре пика с соотношением интенсивностей 3:2:2:4. В спектре высокого разрешения эти пики представлены четырьмя мультиплетами: триплет (1.3 м.д.), синглет (3.2 м.д.), квадруплет (4.0) и мультиплет (6.5 м.д.). Определить структурную формулу молекулы.
3. Определите максимально заселенные вращательные состояния для молекул НCl, DCl, N2 и I2 при 300К. Постоянные Bе и е равны, соответственно, 10.5909 и 0.3019, 5.445 и 0.112, 1.9983 и 0.0171, 0.0374 и 0.00012 см-1.
3. Во вращательном КР-спектре окиси углерода, возбуждаемом линией ртути возд = 4358 Å. получены линии со следующими волновыми числами: 22933.0; 22925.3; 22917.6 см-1. Определите вращательную постоянную Bо, момент инерции Iо и межъядерное расстояние rо. Постоянная αе = 0.0175 см-1.
Скорость света = 3108мсек-1; h = 6.625610-34Джсек. Атомная единица массы (а.е.м.) = 1.6610-27 кг.
3. Найдите вращательные уровни энергии первых трех вращательных состояний молекулы HCl в см-1, кДжмоль-1 и эВ (Ве= 10.5909 см-1, е = 0,3019 см-1, re = 1.2747Å). Основываясь на правилах отбора J, рассчитайте положение первых трех линий в ИК- и КР-вращательных спектрах молекулы и отобразите их на схеме (в см-1).
Скорость света = 3108мсек-1; h = 6.625610-34Джсек; hс = 19.876810-26Джм.
Атомная единица массы (а.е.м.) = 1.6605388610-27 кг; NA = 6.02214151023 моль-1; 1 эВ = 1.60217710-19 Дж.
3. Найдите приближенно энергию диссоциации Do (в кДжмоль-1 и эВ) и относительное содержание молекул хлора (ωе = 564.9, ωехе = 4 см-1) в первом и втором возбужденных колебательных состояниях по отношению к основному при 298 и 500К?
Скорость света = 31010 смсек-1; h = 6.625610-34Джсек; hс = 19.876810-26Джм, R = 8.314472 Дж моль-1K-1,NA = 6.02214151023 моль-1; 1 эВ = 1.60217710-19 Дж.
3. В ИК-спектре поглощения молекулы D37C1 наблюдается ряд колебательных полос поглощения с центрами при 2091.0, 4128.6 и 6112.8 см-1. Изобразите спектр с указанием интенсивности линий. Проведите отнесение колебательных полос к соответствующим колебательным переходам Δυ. Определите энергию диссоциации Do (в кДжмоль-1), частоту колебания ɷe , постоянную ангармоничности ɷeхе и силовую постоянную kе молекулы D37C1.
Скорость света = 3108мсек-1; h = 6.625610-34Джсек; hс = 19.876810-26Джм.
Атомная единица массы (а.е.м.) = 1.6605388610-27 кг.
3. Отличаются ли энергии диссоциации (Dо) изотопных молекул Н2 и D2? Чему равна энергия диссоциации Dо изотопозамещенной молекулы в кДжмоль-1 и эВ? Частоты колебаний молекул Н2 и D2 равны соответственно ωе = 4396.55 и 3120 см-1, а е·xe =118 и 59.4 см-1. Межъядерные расстояния в минимуме кривой потенциальной энергии одинаковы и равны 0.74 Å. Будут ли различия в колебательных и вращательных состояниях этих молекул, и каковы эти различия, если они есть?
3. В КР-спектре паров над треххлористым галлием GаС13 при 960°С, возбуждаемых линией 514.6 нм аргонового лазера, наблюдаются три линии: 518.0; 524.9 и 527.0 нм, относящиеся к основным колебаниям плоской симметричной модели молекулы GаС13. Определите частоты основных гармонических колебаний в см-1.
3. Интерпретируйте ИК-спектр соединения С4Н802 и определите его структуру.

3. Интерпретируйте ИК-спектр соединения С4Н802 и определите его структуру.

3. В спектре ЯКР на 14N в твердом пиридине C5H5N при 77К наблюдаются линии при 3.90 и 2.95 МГц. Найдите константу квадрупольного взаимодействия e2Qq и параметр асимметрии η.
3. Сколько переходов следует ожидать в спектре ЯКР на 57Co для твердых веществ K3[Co(CN)6] и K3(CoBr6)? Какова энергия квадрупольных переходов, выраженная в константах квадрупольного взаимодействия e2Qq. Природное содержание 57Co(I = 7/2) равно 100%. Эффект Штернгеймера отсутствует и η=0.
3. Определите структуру соединения I2Br2Cl4 , если известно, что а) молекула I2С16 плоская и имеет МБ-спектр, содержащий один мультиплет с величиной ХС равной 3.50 мм/с, б) рассматриваемая молекула также плоская, но имеет спектр, содержащий два мультиплета с ХС 2.82 и 3.48 мм/с. Изобразите все возможные структуры плоской Молекулы I2Вг2С14 и методом исключения, основываясь на сравнении ХС спектров двух приведенных молекул, выберите искомую структуру.
3. Объясните почему МБ-спектр Na4[Fe(CN)6] представляет одиночную линию, а спектр Na2[Fe(CN)5NO] дублет? Каково соотношение интенсивностей пиков, чем его можно объяснить?
3. Изобразите структуру ядерных энергетических уровней и качественный вид спектра ЯГР при наличии квадрупольного расщепления (спин ядра 129I в основном состоянии равен 7/2, а возбужденном – 5/2).
3. Каков компонентный состав раствора (содержание В и С), если оптические плотности D(), измеренные при 1 и 2 равны: D(1) = 0.48 и D(2) = 0.26. Значения экстинкции () для вещества В составляют: (1) = 13250 и (2) = 890, а для вещества С: (1) = 480 и (2) = 43280 дм3 мол-1 см-1.
3. Какие изменения в УФ-спектре акролеина СН2=СН–СНО [макс= 203 нм ( = 12000), макс= 345 нм ( = 20)] следует ожидать при разбавлении его этанолом, содержащем следы кислоты.
3. Когда пловец ныряет на большие глубины, он входит в темный мир. Приняв, что средний коэффициент экстинкции морской воды в видимой области равен 6.210-5 дм3моль-1см-1, рассчитайте глубину, на которой до ныряльщика будет доходить половина света от поверхности.
3. Электронные спектры поглощения растворов о- и п-нитроанилинов в диапазоне длин волн 200-400 нм полностью перекрываются, хотя и имеют существенные различия в ε. Определите состав раствора, содержащего оба изомера, если значения оптической плотности раствора, измеренного при λ1 =265 нм и λ2 = 304 нм составляют Аλ1 = 0.7476 и Аλ2 = 0.6358, соответственно. Коэффициенты поглощения о-изомера (lgε = 3.64 для λ1 и lgε = 2.43 для λ2), а п-изомера (lgε = 2.79 для λ1 и lgε = 3.87 для λ2).
3. Вычислите значения мольных коэффициентов погашения для максимумов в УФ-спектре и в видимой области для окрашенного в красный цвет противоопухолевого антибиотика рубомицина М = 560.8. Спектр (рис.) получен для раствора 4.49 мг вещества в 250 мл этанола при толщине кюветы 10 мм.

3. УФ-спектр спектр поглощения 4-метилпентен-3-она-2 (окиси мезитила) [СНз-СО-СН=С(СН3)2] содержит два максимума, которые в зависимости от растворителя лежат в интервале 230-245 нм и 305-327 нм. В ряду н-гексан, этанол и вода длинноволновый максимум претерпевает гипсохромный сдвиг, а коротковолновый – батохромный сдвиг. Основываясь на этих фактах, отнесите оба максимума к конкретным типам переходов и приведите объяснения.
3. Если смешать два изотопных вещества 79Вг2 и 81Вг2, то масс-спектр смеси со временем будет меняться. Чем можно объяснить такие изменения, если реакция изотопного обмена имеет близкую к нулю энтальпию. В чем они проявятся.
3. Какие конкретно изменения (по сравнению с чистыми компонентами) будут происходить в масс-спектрах двухкомпонентной газовой смеси 16О2 и 17О2, если в ней происходят процессы изотопного обмена с константой реакции К = 1?
