
- •Тема 3. Многоэлектронная проблема в квантовой химии.
- •3.1. Многоэлектронный атом. Приближение самосогласованного поля
- •3.2. Сложение моментов количества движения в многоэлектронных атомах.
- •3.3. Векторная модель атома.
- •3.3. Атомные термы. Мультиплетные состояния.
- •3.4. Волновая функция многоэлектронной системы. Квантово-механическая формулировка принципа Паули.
- •3.5. Периодическая система элементов с точки зрения квантовой механики.
- •3.6. Свойства атомов
- •3.7. Вариационный принцип.
- •3.8. Уравнения Хартри-Фока
- •3.9. Метод взаимодействия конфигураций.
- •3.10. Возбужденные состояния атома
Тема 3. Многоэлектронная проблема в квантовой химии.
3.1. Многоэлектронный атом. Приближение самосогласованного поля
В водородоподобном атоме имеется лишь один электрон, взаимодействующий с ядром. Описывающие водородоподобный атом одноэлектронные волновые функции называются атомными орбиталями (АО). Они служат удобными моделями для качественного описания свойств не только атома водорода, но и других атомов. Но все же у них есть один явный недостаток: они не учитывают тот факт, что электрон в многоэлектронном атоме взаимодействует не только с ядром заряда Ze, но и со всеми оставшимися электронами.
Попытаемся сформулировать задачу определения многоэлектронной волновой функции атома таким образом, чтобы она была решением уравнения Шредингера для движения частицы в центрально-симметричном поле
![]() ,
(3.1)
,
(3.1)
но с эффективным потенциалом (r1). Нужно определить функцию (r) таким образом, чтобы получающиеся решения были близки к таковым, получаемым для многоэлектронного атома.
Такой потенциал находят следующим образом.
Пусть рассматриваемый атом содержит n электронов. Обозначим один из электронов индексом "1", а оставшиеся - индексами "i" (i1). Тогда на электрон 1 со стороны ядра и всех других электронов i будет действовать следующий потенциал :
![]() (3.2)
(3.2)
Здесь 0 - диэлектрическая постоянная "вакуума"; r1 - расстояние от электрона "l" до ядра; Z – заряд ядра; r1i - расстояние между электронами "i" и "1".
Сделаем так, чтобы потенциал 3.2 зависел только от координат электрона "1" и не зависел от координат других электронов. Для этого усредним потенциал 3.2 по координатам всех электронов за исключением электрона с номером "1". Тогда в потенциале 3.2 вместо величины 1/r1i следует использовать ее среднее значение
 (3.3)
(3.3)
Здесь через x i обозначена совокупность { x i , y i , z i , i } пространственных и спиновых координат.
Благодаря усреднению, потенциал 3.3 зависит только от координат электрона "1". Однако, он будет в общем случае необязательно сферически – симметричным, поскольку сохраняется зависимость не только от r1 (радиус-вектора), но и от углов i и i (сферических координат). Для ее устранения проведем еще одно усреднение: теперь уже по направлениям радиус-вектора электрона 1, т.е. по координатам и .
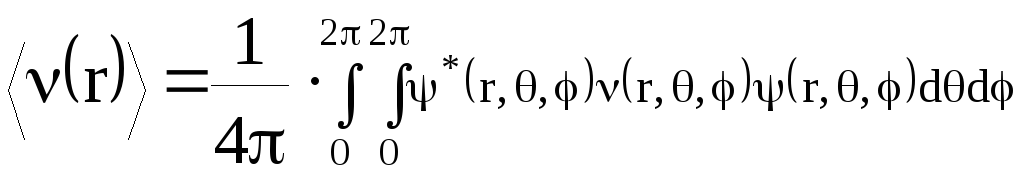 ,
(3.4)
,
(3.4)
Здесь r, , - сферические координаты электрона "1".
Вследствие усреднения по координатам и (интегрирование !) потенциал 3.4 будет зависеть лишь от величины радиус-вектора электрона и иметь сферическую симметрию. Его можно подставить в уравнение 3.1. Однако, несмотря на упрощения, уравнение 3.1 с потенциалом 3.4 нельзя решить точно из-за сложного вида потенциала 3.4. Для его решения необходимо использовать приближенные методы, например, итерационные. Одним из наиболее удачных является метод с использованием модели самосогласованного поля (ССП). Он был предложен Хартри, а затем усовершенствован Фоком.
Метод состоит из нескольких этапов.
На первом из них осуществляется выбор пробных волновых функций для всех электронов атома.
На втором – выбирается один из электронов и рассчитывается потенциал, который обусловлен другими электронами в предположении, что распределение всех других электронов "заморожено" и создает в точке "локализации" выбранного электрона определенное потенциальное поле.
На третьем – потенциал усредняется описанным выше образом.
На четвертом – решается уравнение Шредингера 3.1.
Затем последовательность из этапов 1-4 повторяется для всех электронов атома. В результате получается новый набор волновых функций, с которыми проводится новый цикл самосогласования.
Указанная последовательность действий продолжается до тех пор, пока полученные после очередного цикла волновые функции не совпадут с пробными.
Применение описанной выше или похожей на нее процедуры (ССП) позволяет определить вид волновых функций атома. Они во многом будут напоминать АО водородоподобного атома. Так, узлы волновых функций, расположение максимальных значений их в пространстве, их форма будут напоминать соответствующие особенности АО водородоподобных атомов. Однако, в отличие от них для атомов с более чем одним электроном орбитальные энергии будут зависеть как от квантового числа n, так и от квантового числа l. Для одного и того же значения n энергия увеличивается с ростом l. Объяснение этого явления состоит в том, что с ростом l АО все меньше проникают в область вблизи ядра. Поэтому эффективность экранирования заряда ядра, действующего на электрон, уменьшается, и кулоновское взаимодействие между электроном и ядром возрастает.
В приведенной ниже таблице показано, как во втором ряду Периодической системы с изменением порядкового номера элемента меняется разница энергий 2s- и 2р-АО.
|
|
Li |
Be |
B |
C |
N |
O |
F |
|
E(2p)-E(2s), эв |
1.85 |
3.36 |
5.75 |
8.77 |
12.39 |
16.53 |
21.54 |
Из таблицы следует, что при одном и том же значении n разность E(2p)-E(2s) увеличивается с ростом l и атомного номера.
