Общие реакции на подлинность
.docОбщие реакции подлинности лекарственных средств различных химических классов
В фармакопеи разных стран включена ОФС «Общие реакции подлинности». Это связано с тем, многие лекарственные субстанции и ГЛФ содержат одни и те же катионы, анионы или одинаковые функциональные группы в составе органических соединений, проявляющих терапевтическую активность. Общие реакции подлинности могут использоваться для определения идентичных примесей в различных ЛС.
В настоящее время активно рассматриваются проблемы гармонизации фармакопей различных стран, ведь лекарство, которое продается или покупается, перестает принадлежать какой-либо одной стране. Требования, применяемые для оценки качества фармацевтических препаратов, должны быть согласованы различными странами.
Часто разные страны для какого-либо ЛП приводят в своих фармакопеях одинаковые показатели качества, одинаковые методики анализа по этим показателям и одинаковые числовые нормы. Это отражает деятельность фармакопейных дискуссионных групп (PDG), работающих в системе ICH – Международной конференции по гармонизации требований к регистрации ЛС, используемых в медицине. В работе ICH непосредственное участие принимают Всемирная организация здравоохранения и три ведущие фармакопеи – Фармакопея США, Европейская фармакопея и Японская фармакопея.
Любая фармакопея состоит минимум из 2 основных разделов. Один из них содержит фармакопейные статьи (ФС), другой – общие фармакопейные статьи (ОФС).
ОФС содержат информацию общего характера. ОФС «Общие реакции на подлинность» содержит методики качественных реакций на неорганические ионы и некоторые функциональные группы органических соединений.

ГОСУДАРСТВЕННЫЙ СТАНДАРТ КАЧЕСТВА ЛЕКАРСТВЕННОГО СРЕДСТВА
ОБЩАЯ ФАРМАКОПЕЙНАЯ СТАТЬЯ
Общие реакции ОФС (ГФ XII)
на подлинность
Алюминий. Около 15 мг лекарственного средства растворяют в 2 мл воды. К полученному раствору или к 2 мл раствора, приготовленного как указано в частной фармакопейной статье, прибавляют 0,5 мл хлористоводородной кислоты разведенной 8,3 % и 0,5 мл реактива тиоацетамида; осадок не образуется. Затем по каплям прибавляют раствор натрия гидроксида разведенный 8,5 %; образуется гелеобразный белый осадок, растворимый при последующем прибавлении раствора натрия гидроксида разведенного 8,5 %. Постепенно прибавляют 10 % раствор аммония хлорида; снова образуется гелеобразный белый осадок.
Тиоацетамид в кислой среде гидролизуется с образованием сульфид ионов (вместо токсичного сероводорода).
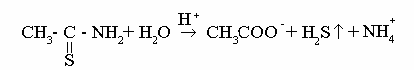
Соль сульфида алюминия имеет высокую степень растворимости и по- этому осадок не образуется, в отличие от ионов (Be2+, Pb2+, Sn2+, Sn4+ и Sb3+), взаимодействующих с S2- с образованием осадка. Перечисленные ионы как и Al3+ обладают амфотерными свойствами и с гидроксидом натрия образуют гелеобразные осадки. Для исключения ложноположительных реакций и проводится реакция с тиоацетамидом.
После прибавления гидроксида натрия образуется осадок: Al3++3OH- → Al(OH)3 ;
при последующем добавлении гидроксида натрия осадок растворяется:
Al(OH)3 +OH-(избыток) → [Al(OH)4]-
После добавления к полученному раствору аммония хлорида, вновь выпадает гелеобразный осадок:
[Al(OH)4]-+NH4+ →Al(OH)3 +NH3+H2O.
Амины ароматические первичные. Около 50 мг лекарственного средства растворяют в 1 мл хлористоводородной кислоты разведенной 8,3 %, нагревают при необходимости, охлаждают во льду, прибавляют 2 мл 1 % раствора натрия нитрита; полученный раствор прибавляют к 1 мл щелочного раствора β-нафтола, содержащего 0,5 г натрия ацетата; образуется осадок от желто-оранжевого до оранжево-красного цвета.
Примечание. Приготовление щелочного раствора β-нафтола, содержащего 0,5 г натрия ацетата. 2 г β-нафтола растворяют в 40 мл 10 % раствора натрия гидроксида и прибавляют 0,5 г натрия ацетата. После растворения доводят объем раствора водой до метки и перемешивают.
Раствор используют свежеприготовленным.
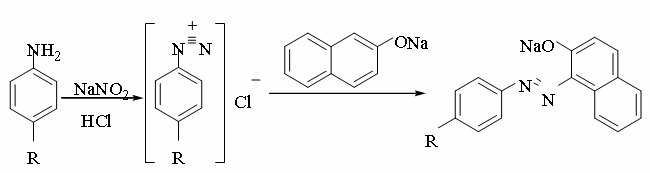
Аммоний. 1 мл раствора соли аммония (2–6 мг аммоний-иона) нагревают с 0,5 мл 10 % раствора натрия гидроксида; выделяется аммиак, обнаруживаемый по запаху и по посинению влажной красной лакмусовой бумаги.
NH4+ + OH- → NH3↑ + H2O
Ацетаты. А. 2 мл раствора ацетата (20–60 мг ацетат-иона) нагревают с равным количеством серной кислоты концентрированной и 0,5 мл спирта 96 %; появляется характерный запах этилацетата.
CH3COONa + C2H5OH + H2SO4 →CH3COOС2Н5 + NaHSO4 +СО2
Б. К 2 мл нейтрального раствора ацетата (20–60 мг ацетат-иона) прибавляют 0,2 мл 3 % раствора железа(III) хлорида; появляется красно-бурое окрашивание, исчезающее при прибавлении разведенных минеральных кислот.
3CH3COONa + FeCl3 → Fe(CH3COO)3 + 3NaCl
3Fe(CHOO)3 + 2H2O → [Fe3(OH)2(CH3COO)6]CH3COO + 2CH3COOH [Fe3(OH)2(CH3COO)6]CH3COO + 9HCl → 3FeCl3 + 7CH3COOH + 2H2O
Бензоаты. К 2 мл нейтрального раствора бензоата (10–20 мг бензоат-иона) прибавляют 0,2 мл 3 % раствора железа(III) хлорида; образуется розовато-желтый осадок, растворимый в эфире.
6С6H5COO−+2Fe3++10H2O →(С6H5COO)3Fe⋅Fe(OH)3⋅7H2O+3C6H5COOH
Бромиды. А. К 1 мл раствора бромида (2–30 мг бромид-иона) прибавляют 1 мл хлористоводородной кислоты разведенной 8,3 %, 0,5 мл 5 % раствора хлорамина, 1 мл хлороформа и взбалтывают; хлороформный слой окрашивается в желто-бурый цвет.

Б. К 2 мл раствора бромида (2–10 мг бромид-иона) прибавляют 0,5 мл азотной кислоты разведенной 16 % и 0,5 мл 2 % раствора серебра нитрата; образуется желтоватый творожистый осадок, нерастворимый в азотной кислоте разведенной 16 % и трудно растворимый в 10 % растворе аммиака.
NaBr + AgNO3 → AgBr↓ + NaNO3
AgBr + 2NH3. 2H2O → [Ag(NH3)2]Br
Висмут. А. Указанное в частной фармакопейной статье количество лекарственного средства (около 50 мг висмут-иона) взбалтывают с 3 мл хлористоводородной кислоты разведенной 8,3 % и фильтруют. К фильтрату прибавляют 1 мл 2 % раствора натрия сульфида или сероводорода; образуется коричневато-черный осадок, растворимый при прибавлении равного объема азотной кислоты концентрированной.
2BiONO3 + 3Na2S + 4HCI → 2Bi2S3↓ + 2NaNO3 + 4 NaCI + 2H2O
2Bi3+ + 3S2- → Bi2S3↓
Б. Указанное в частной фармакопейной статье количество лекарственного средства (около 50 мг висмут-иона) взбалтывают с 5 мл серной кислоты разведенной 16 % и фильтруют. К фильтрату прибавляют 2 капли 10 % раствора калия йодида; образуется черный осадок, растворимый в избытке реактива с образованием раствора желтовато-оранжевого цвета.
Bi3+ + 3I- → BiI3↓
BiI3 + КI→ К[BiI4]
Железо(II). К 2 мл раствора соли железа(II) (около 20 мг железо(II)-иона) прибавляют 0,5 мл хлористоводородной кислоты разведенной 8,3 % и 1 мл 5 % раствора калия феррицианида; образуется синий осадок.
FеСl2 + K3[Fe(CN)6] ® 2КСl + KFeFe(CN)6¯
Железо(III). А. К 2 мл раствора соли железа(III) (около 1 мг железо(III)-иона) прибавляют 0,5 мл хлористоводородной кислоты разведенной 8,3 % и 1–2 капли 5 % раствора калия ферроцианида; образуется синий осадок.
Fe3+ + 4К+ + [Fe(CN)6]4- → KFeFe(CN)6¯ + 3К+
Б. К 2 мл раствора соли железа(III) (около 1 мг железо(III)-иона) прибавляют 0,5 мл хлористоводородной кислоты разведенной 8,3 % и 1–2 капли 5 % раствора аммония тиоцианата; появляется красное окрашивание.
Fe3+ + 6CNS- → [Fe(CNS)6]3-
В. К раствору соли железа(III) (около 1 мг железо(III)-иона) прибавляют раствор аммония сульфида; образуется черный осадок, растворимый в разведенных минеральных кислотах.
2Fe3+ + 3S2- → 2FeS↓ + S
Fe2+ + S2- → FeS↓
Йодиды. А. К 2 мл раствора йодида (3–20 мг йодид-иона) прибавляют 0,2 мл серной кислоты разведенной 16 %, 0,2 мл 10 % раствора натрия нитрита или 3 % раствора железа(III) хлорида и 2 мл хлороформа; при взбалтывании хлороформный слой окрашивается в фиолетовый цвет.
2KI + 2NaNO2 + 2H2SO4 → I2 + 2NO↑ + Na2SO4 + K2SO4 + 2H2O
Б. К 2 мл раствора йодида (2–10 мг йодид-иона) прибавляют 0,5 мл азотной кислоты разведенной 16 % и 0,5 мл 2 % раствора серебра нитрата; образуется желтый творожистый осадок, нерастворимый в азотной кислоте разведенной 16 % и 10 % растворе аммиака.
I- + Ag+ → AgI↓
В. При нагревании 0,1 г лекарственного средства с 1 мл серной кислоты концентрированной выделяются пары фиолетового цвета.
2KI + 2H2SO4 → I2↑ + SO2↑+ K2SO4 + 2H2O
Калий. А. К 2 мл раствора соли калия (10–20 мг калий-иона) прибавляют 1 мл 20 % раствора винной кислоты, 1 мл 10 % раствора натрия ацетата, 0,5 мл спирта 96 % и встряхивают; постепенно образуется белый кристаллический осадок, растворимый в разведенных минеральных кислотах и растворах гидроксидов щелочных металлов.
KCI + H2C4H4O6 → KHC4H4O6↓ + HCI
Б. К 2 мл раствора соли калия (5–10 мг калий-иона), предварительно прокаленной для удаления солей аммония, прибавляют 0,5 мл уксусной кислоты разведенной 30 % и 0,5 мл 10 % раствора натрия кобальтинитрита; образуется желтый кристаллический осадок.
Na3[Co(NO2)6] + 2KCI → K2Na[Co(NO2)6↓ + 2NaCI
В. Соль калия, внесенная в бесцветное пламя, окрашивает его в фиолетовый цвет или при рассматривании через синее стекло – в пурпурно-красный.
Кальций. А. К 1 мл раствора соли кальция (2–20 мг кальций-иона) прибавляют 1 мл 4 % раствора аммония оксалата; образуется белый осадок, нерастворимый в уксусной кислоте разведенной 30 % и 10 % растворе аммиака, растворимый в разведенных минеральных кислотах.
C2O42- + Ca2+ ® СаС2О4¯
Б. Соль кальция, смоченная хлористоводородной кислотой 25 % и внесенная в бесцветное пламя, окрашивает его в кирпично-красный цвет.
Карбонаты (Гидрокарбонаты). А. К 0,2 г карбоната (гидрокарбоната) или к 2 мл раствора карбоната (гидрокарбоната) (1:10) прибавляют 0,5 мл хлористоводородной кислоты разведенной 8,3 %; выделяется газ, при пропускании которого через раствор кальция гидроксида образуется белый осадок.
NaHCO3 + НСl ® NaCl + CO2 + Н2О
СО2 + Са(ОН)2 ® СаСО3 ¯ + Н2О
Б. К 2 мл раствора карбоната (1:10) прибавляют 5 капель насыщенного раствора магния сульфата; образуется белый осадок (гидрокарбонат образует осадок только при кипячении смеси).
4Na2CO3 + 4MgSO4 + 4Н2О ® 3MgCO3.Mg(OH)2.3H2O¯ + CO2+ 4Na2SO4
В. Раствор карбоната (1:10) при прибавлении 1 капли 1 % раствора фенолфталеина окрашивается в красный цвет (отличие от гидрокарбоната).
СО32- + НOН ® ОН- + НСО3-
НСО3- + НОН ® ОН- + Н2О + CO2
Магний. К 1 мл раствора соли магния (2–5 мг магний-иона) прибавляют 1 мл 10 % раствора аммония хлорида, 1 мл 10 % раствора аммиака и 0,5 мл 5 % раствора натрия фосфата; образуется белый кристаллический осадок, растворимый в разведенных минеральных кислотах и уксусной кислоте.
М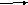 gCl2
+ Na2HPO4 + NH3
NH4Cl
NH4МgPO4¯+
2 NaCl
gCl2
+ Na2HPO4 + NH3
NH4Cl
NH4МgPO4¯+
2 NaCl
Мышьяк. Мышьяк в лекарственных средствах присутствует в виде соединений, в которых его степень окисления равна +3 и +5, поэтому в ГФ приводятся реакции на арсениты (AsO3−) и арсенаты (AsO43−).
1. Арсениты. А. К 0,3 мл раствора соли мышьяка(III) (около 30 мг арсенит-иона) прибавляют 0,5 мл хлористоводородной кислоты разведенной 8,3 % и 2 капли 2 % раствора натрия сульфида или сероводорода; образуется желтый осадок, нерастворимый в хлористоводородной кислоте концентрированной, растворимый в 10 % растворе аммиака.
AsO2- + 8H+ ®2As3+ + 4H2O
2As3+ + 3Na2S ®As2S3 + 6Na+
As2S3 + 6NH4OH ® (NH4)3AsS3 + (NH4)3AsO3 + 3H2O
Следует отметить, что As2S3 растворяется также и в избытке реактива.
As2S3 + 3Na2S ®2Na3AsS3
Б. К 0,3 мл раствора соли мышьяка(III) (около 3 мг арсенит-иона) прибавляют 1–2 капли 2 % раствора серебра нитрата; образуется желтый осадок, растворимый в азотной кислоте разведенной 16 % и 10 % растворе аммиака.
AsO33– + 3Ag+ → Ag3AsO3↓
Ag3AsO3 + 9NH3 + 3H2O → 3Ag(NH3)2OH + (NH4)3AsO3
2. Арсенаты. А. К 0,3 мл раствора соли мышьяка(V) (около 30 мг арсенат-иона) прибавляют 0,5 мл хлористоводородной кислоты разведенной 8,3 %, 2 капли 2 % раствора натрия сульфида или сероводорода и нагревают; образуется желтый осадок, нерастворимый в хлористоводородной кислоте концентрированной, растворимый в 10 % растворе аммиака.
AsO43−+ 8H+ →As5+ + 4H2O
2As5+ + 5S2−→As2S5↓
Б. К 0,3 мл раствора соли мышьяка(V) (около 1 мг арсенат-иона) прибавляют 1–2 капли 2 % раствора серебра нитрата; образуется коричневый осадок, растворимый в азотной кислоте разведенной 16 % и 10 % растворе аммиака.
AsO43– + 3Ag+ → Ag3AsO4↓
Ag3AsO4 + 9NH3 + 3H2O → 3Ag(NH3)2OH + (NH4)3AsO4
В. К 0,3 мл раствора соли мышьяка(V) (около 1 мг арсенат-иона) прибавляют 1 мл 10 % раствора аммония хлорида, 1 мл 10 % раствора аммиака и 1 мл 10 % раствора магния сульфата; образуется белый кристаллический осадок, растворимый в хлористоводородной кислоте разведенной 8,3 % (отличие от арсенитов).
Mg2+ + NH4OH + HAsO42- ® MgNH4AsO4 ↓+H2O
Натрий. А. К 2 мл раствора натриевой соли (7–10 мг натрий-иона) прибавляют 2 мл 15 % раствора калия карбоната и нагревают до кипения; осадок не образуется. К раствору прибавляют 4 мл раствора калия пироантимоната и нагревают до кипения. Охлаждают в ледяной воде и при необходимости потирают внутренние стенки пробирки стеклянной палочкой; образуется плотный осадок белого цвета.
Na++K[Sb(OH)6] ®Na[Sb(OH)6] ↓ +K+
Б. Соль натрия, смоченная хлористоводородной кислотой 25 % и внесенная в бесцветное пламя, окрашивает его в желтый цвет.
Нитраты. А. К лекарственному средству (около 1 мг нитрат-иона) прибавляют 2 капли раствора дифениламина; появляется синее окрашивание.
Б. К лекарственному средству (2–5 мг нитрат-иона) прибавляют по 2–3 капли воды и серной кислоты концентрированной, кусочек металлической меди и нагревают; выделяются пары бурого цвета.
2NaNO3 + H2SO4 → Na2SO4+ 2HNO3
Cu + HNO3 → Cu(NO3)2 + NO2↑ + H2O
Нитриты. А. К лекарственному средству (около 1 мг нитрит-иона) прибавляют 2 капли раствора дифениламина; появляется синее окрашивание.
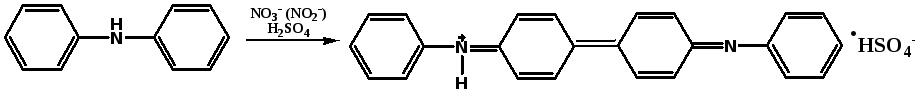
Дифенилдифенохинондиимин бензидин (сернокислая соль)
Б. К лекарственному средству (около 30 мг нитрит-иона) прибавляют 1 мл серной кислоты разведенной 16 %; выделяются желто-бурые пары (отличие от нитратов).
NaNO2 + H2SO4 → NaHSO4 + HNO2
2HNO2 → NO↑ + NO2↑ + H2O
В. Несколько кристаллов антипирина растворяют в фарфоровой чашке в 2 каплях хлористоводородной кислоты разведенной 8,3 %, прибавляют 2 капли раствора нитрита (около 1 мг нитрит-иона); появляется зеленое окрашивание (отличие от нитратов).

Ртуть(II). А. К 2 мл раствора соли ртути(II) (около 50 мг ртуть(II)-иона) прибавляют 0,5 мл 10 % раствора натрия гидроксида; образуется желтый осадок.
Hg2++2OH- → HgO +H2O
Б. К 1 мл раствора соли ртути(II) (10–30 мг ртуть(II)-иона) прибавляют осторожно по каплям 10 % раствор калия йодида; образуется красный осадок, растворимый в избытке реактива.
Hg2++2KI → HgI2 +2K+
HgI2 +2KI → K2[HgI4]
Салицилаты. К 2 мл нейтрального раствора салицилата (2–10 мг салицилат-иона) прибавляют 2 капли 3 % раствора железа(III) хлорида; появляется сине-фиолетовое или красно-фиолетовое окрашивание, которое сохраняется при прибавлении небольшого количества уксусной кислоты разведенной 30 %, но исчезает при прибавлении хлористоводородной кислоты разведенной 8,3 %. При этом образуется белый кристаллический осадок.
Сульфаты. К 2 мл раствора сульфата (5–50 мг сульфат-иона) прибавляют 0,5 мл 5 % раствора бария хлорида; образуется белый осадок, нерастворимый в разведенных минеральных кислотах.
SO42- + Ba2+ → BaSO4↓
Сульфиты. А. К 2 мл раствора сульфита (10–30 мг сульфит-иона) прибавляют 2 мл хлористоводородной кислоты разведенной 8,3 % и встряхивают; постепенно выделяется сернистый газ, обнаруживаемый по характерному резкому запаху.
SO32- + 2H+ → H2SO3 → SO2↑ + H2O
Б. К 2 мл раствора сульфита (2–20 мг сульфит-иона) прибавляют 0,5 мл 5 % раствора бария хлорида; образуется белый осадок, растворимый в хлористоводородной кислоте разведенной 8,3 % (отличие от сульфатов).
SO32- + Ba2+ → BaSO3↓
BaSO3 + 2HCI → BaCI2 + H2O + SO2↑
Тартраты. А. К 1 мл раствора тартрата (около 20 мг тартрат-иона) прибавляют кристаллик калия хлорида, 0,5 мл спирта 96 %; образуется белый кристаллический осадок, растворимый в разведенных минеральных кислотах и растворах гидроксидов щелочных металлов.
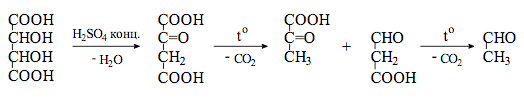
Б. 0,25 мл раствора тартрата (около 5 мг тартрат-иона) нагревают с 1 мл серной кислоты концентрированной и несколькими кристаллами резорцина; через 15–30 с появляется вишнево-красное окрашивание.
Фосфаты. А. К 1 мл раствора фосфата (10–30 мг фосфат-иона), нейтрализованного до рН около 7,0, прибавляют несколько капель 2 % раствора серебра нитрата; образуется желтый осадок, растворимый в азотной кислоте разведенной 16 % и 10 % растворе аммиака.
PO43- + 3Ag+ → Ag3PO4↓
Ag3PO4 + 6NH4OH → 3[Ag(NH3 )2]3+ + PO43-+6H2O
Б. К 1 мл раствора фосфата (10–30 мг фосфат-иона) прибавляют 1 мл 10 % раствора аммония хлорида, 1 мл 10 % раствора аммиака и 0,5 мл 10 % раствора магния сульфата; образуется белый кристаллический осадок, растворимый в разведенных минеральных кислотах.
Na3PO4 + 3NH4CI + NH3. Н2О + МgSO4 ® NH4МgPO4¯+ 3NaCl + (NH4)2SO4
MgNH4PO4 +3HCl®MgCl2+NH4Cl+H3PO4
В. К 1 мл раствора фосфата (10–30 мг фосфат-иона) в азотной кислоте разведенной 16 % прибавляют 2 мл 10 % раствора аммония молибдата и нагревают; образуется желтый кристаллический осадок, растворимый в 10 % растворе аммиака.
H3PO4 + 12(NH4)MoO4 + 21HNO3 ® (NH4)3PO4 ·12MoO3¯ + 21NH4NO3 + 12H2O
(NH4)3PO4· 12 MoO3 + 23NH4OH ® 12(NH4)2 MoO4 + (NH4)2HPO4+11H2O
Хлориды. К 2 мл раствора хлорида (2–10 мг хлорид-иона) прибавляют 0,5 мл азотной кислоты разведенной 16 % и 0,5 мл 2 % раствора серебра нитрата; образуется белый творожистый осадок, нерастворимый в азотной кислоте разведенной 16 % и растворимый в 10 % растворе аммиака. Для солей органических оснований испытание растворимости образовавшегося осадка проводят после отфильтровывания и промывания осадка водой.
Cl- + Ag+ → AgCl↓
AgCl + 2NH4OH ® [Ag(NH3)2]++ Cl- + 2H2O
Цинк. А. К 2 мл нейтрального раствора соли цинка (5–20 мг цинк-иона) прибавляют 0,5 мл 2 % раствора натрия сульфида или сероводорода; образуется белый осадок, нерастворимый в уксусной кислоте разведенной 30 % и легко растворимый в хлористоводородной кислоте разведенной 8,3 %.
Zn2+ + S2-® ZnS¯
Б. К 2 мл раствора соли цинка (5–20 мг цинк-иона) прибавляют 0,5 мл 5 % раствора калия ферроцианида; образуется белый осадок, нерастворимый в хлористоводородной кислоте разведенной 8,3 %.
3Zn2+ + 2K+ + 2[Fe(CN)6]4- ® K2Zn3[Fe(CN)6]2¯
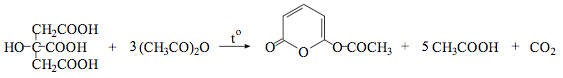
Цитраты. А. К 1 мл нейтрального раствора цитрата (2–10 мг цитрат-иона) прибавляют 1 мл 20 % раствора кальция хлорида; раствор остается прозрачным; при кипячении образуется белый осадок, растворимый в хлористоводородной кислоте разведенной 8,3 %.
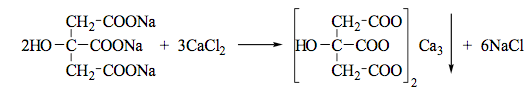
Б. К лекарственному средству (1–2 мг цитрат-иона) прибавляют 0,5 мл уксусного ангидрида и нагревают; через 20–40с появляется красное окрашивание.
При дегидратации лимонной кислоты образуется аконитовая кислота (HOOCCH=C(COOH)CH2COOH), при циклизации и декарбоксилировании которой получаются соединения фуранового и пиранового рядов. Носителем окраски, по-видимому, является 6-ацетоксипиранон-2, образующийся в результате этих превращений: