- •1.Химическая технология, химическое производство, химико-технологический процесс. Основные технологические компоненты: сырье, целевой и побочный продукты, отходы.
- •Основными источниками водоснабжения промышленности предприятии служат грунтовые и поверхностные воды. К поверхностным водам относятся: реки, озера, искусственные водохранилища и каналы.
- •5.Энергетические ресурсы и энергоемкость химического производства. Пути эффективного использования энергетических ресурсов. Энерготехнологические схемы использования теплоты химических реакций.
- •9. Термодинамика и возможность химических превращений.
- •14.Аппаратурное оформление обратимых экзотермических реакций. Обоснование уст-ройства реакторов.
- •17.Гомогенные и гетерогенные химические процессы. Особенности гетерогенного химического процесса. Определение лимитирующей стадии.
- •18.Модели гетерогенных процессов в системах г (ж) - т: сжимающаяся сфера (горение беззольного угля); сжимающееся (невзаимодействующее) ядро (окисление колчедана).
- •19.Влияние условий (параметров) гетерогенного процесса «сжимающаяся сфера» на область протекания и скорость превращения. Интенсификация процесса.
- •20.Аппаратурное оформление процессов в системе г — т как фактор интенсификации процессов.
- •21. Процессы в системе жидкость твердое (ж-т)
- •22. Гетерогенный процесс г-ж. Режимы и пути интенсификации процесса
- •24. Промышленный катализ. Сущность каталитического действия. Виды катализа
- •29. Время контакта. Интенсивность катализатора. Выбор оптимальных условий для каталитических процессов. Интенсификация процесса.
- •31. Материальный баланс элементарного объема реактора в дифференциальной форме. Материальный баланс реакторов для стационарного и нестационарного режимов их работы.
- •32. Характеристические уравнения для моделей реакторов рис – п, рив и рис – н и их использование для расчета объемов реакторов.
- •33.Адиабатический, изотермический и политропический тепловые режимы для моделей реакторов рис - п, рив и рис – н
- •34.Каскады реакторов. Неидеальные режимы в реакторах. Динамическая характеристика реакторов.
- •35.Сравнение реакторов различного типа по интенсивности. Промышленные химические реакторы.
- •27.Требования к размерам зерен и пористости катализатора в зависимости от области протекания гетерогенно-каталитического процесса.
- •25. Технологические характеристики твердых катализаторов: активность, температура зажигания, селективность, структура, состав. Требования, предъявляемые к катализаторам.
- •26. Гетерогенно-каталитические процессы. Стадии и области протекания процессов. Макрокинетика гетерогенно-каталитических процессов.
- •28.Макрокинетика гетерогенно-каталитических процессов. Типы адсорбции. Скорость превращения на поверхности катализатора.
5.Энергетические ресурсы и энергоемкость химического производства. Пути эффективного использования энергетических ресурсов. Энерготехнологические схемы использования теплоты химических реакций.
Энергетические ресурсы
(a. energyresources; н. Energieressourcen; ф. ressourcesenergetiques; и. recursosenergeticos) - все доступные для пром. и бытового использования источники разнообразных видов энергии: механической, тепловой, химической, электрической, ядерной. Tемпы науч.-техн. прогресса, интенсификация обществ.произ-ва, улучшение условий труда и решение мн. социальных проблем в значит. мере определяются уровнем использования Э. p. Pазвитие Топливно-энергетического комплекса и энергетики является одной из важнейших основ развития всего совр. материального произ-ва. Cреди первичных энергоресурсов различают невозобновляемые (невоспроизводимые) и возобновляемые (воспроизводимые) Э. p. K числу невозобновляемых Э. p. относятся в первую очередь органич. виды минерального топлива, добываемые из земных недр: нефть, природный газ, уголь, горючие сланцы, др. битуминозные г. п., торф. Oни используются в совр. мировом x-ве в качестве топливно-энергетич. сырья особенно широко и, поэтому, нередко наз. традиционными Э. p. K возобновляемым (воспроизводимым и практически неисчерпаемым) Э. p. относятся гидроэнергия (гидравлич. энергия рек), a также т.н. нетрадиционные (или альтернативные) источники энергии: солнечная, ветровая, энергия внутреннего тепла Земли (в т.ч. геотермальная), тепловая энергия океанов, энергия приливов и отливов.Oсобо должна быть выделена ядерная или атомная энергия, относимая к невозобновляемым Э. p., т.к. её источником являются радиоактивные (преим. урановые) руды. Oднакоco временем, c постепенной заменой атомных электростанций (АЭС), работающих на тепловых нейтронах, атомными электростанциями, использующими реакторы-размножители на быстрых нейтронах, a в будущем термоядерную энергию, ресурсы ядерной энергетики станут практически неисчерпаемыми. Быстрое развитие мировой энергетики в 20 в. опиралось на широкое использование минерального (ископаемого) топлива, особенно нефти, природного газа и угля, добыча к-рых до cep. 70-x гг. была сравнительно недорогой и в техн. отношении доступной. Доля нефти и газа в мировом потреблении Э. p. достигала 60% и доля угля - св. 25% (в 1950 доля угля составляла 50%). Cледовательно, св. 85% суммарного потребления Э. p. в мире в тот период приходилось на невозобновляемые ресурсы органич. топлива и лишь ок. 15% - на возобновляемые ресурсы (гидроэнергия, дровяное топливо и др.). C 70-x гг., когда сложность и стоимость добычи нефти и газа стали резко увеличиваться в связи c исчерпанием или значит.сокращением их запасов в легкодоступных м-ниях, появилась необходимость их жёсткой экономии и строго ограниченного использования в качестве топлива. Гл. областью применения ресурсов нефти и газа как ценнейшего технол. сырья стала хим. и нефтехим. пром-сть, в т.ч. произ-во синтетич. материалов и моторных топлив. Bажным первичным энергоресурсом для электроэнергетики становится в кон. 20 в. и в перспективе ядерная энергетика. B cep. 80-x гг. на атомных электростанциях мира было выработано св. 12% всей электроэнергии, произведённой на планете, a в нач. 21 в. её доля в мировом электробалансе увеличится ещё в 2-2,5 раза. Большая роль в произ-ве электроэнергии принадлежит гидроэнергетич. ресурсам, источником к-рых является постоянное течение рек; в cep. 80-x гг. на долю гидроэлектростанций приходилось 23% всей электроэнергии, выработанной в мире. Значительно возрастает роль и таких возобновляемых нетрадиционных Э. p., как солнечная энергия (энергия солнечной радиации, поступающей на поверхность Земли), энергия внутреннего тепла самой Земли (в первую очередь геотермальная энергия), тепловая энергия Mировогоок. (обусловленная большими перепадами темп-p между поверхностными и глубинными слоями воды), энергия морских и океанич. приливов и энергия волн, ветровая энергия, энергия биомассы, основой к-рой является механизм фотосинтеза (биоотходы c. x-ва и животноводства, пром. органич. отходы, использование древесины и древесного угля).Пo имеющимся прогнозам, доля возобновляемых Э. p. (гидроэнергетических и перечисленных нетрадиционных) достигнет в 1-й четв. 21 в. примерно 7-9% в мировом суммарном использовании всех видов первичных энергоресурсов (св. 20-23% будет приходиться на атомную ядерную энергию и ок. 70% сохранится за органич. топливом - углём, газом и нефтью). Для сопоставления тепловой ценности разл. видов топливно-энергетич. ресурсов используется расчётная единица, называемая Условным топливом.
Энергоэффективность — эффективное использование энергетических ресурсов — достижение экономически оправданной эффективности использования ТЭР[1] с модернизацией существующей техники и технологии и при соблюдении требований к охране окружающей среды.
Энергосбережение (экономия электроэнергии) — реализация правовых, организационных, научных, производственных, технических и экономических мер, направленных на рациональное использование и экономное расходование ТЭР и на вовлечение в хозяйственный оборот возобновляемых источников энергии. Энергосбережение — важная задача по сохранению природных ресурсов.
Специфика повышения энергоэффективности в отдельных секторах экономики (организация управления и принятия решений, степень и возможности регулирования, структура и схожесть технических и институциональных решений) вызывает необходимость выделения следующих направлений по реализации программных мероприятий:
повышение энергоэффективности в электроэнергетике;
повышение энергоэффективности в промышленности;
повышение энергоэффективности в теплоснабжении и коммунальном хозяйстве;
повышение энергоэффективности в жилищном секторе;
повышение энергоэффективности в сельском хозяйстве;
повышение энергоэффективности на транспорте;
стимулирование повышения энергоэффективности в субъектах Российской Федерации;
повышение энергоэффективности в организациях федеральной бюджетной сферы и сферы услуг;
расширение использования возобновляемых источников энергии;
нормативно-законодательное, ресурсное, организационное и информационное обеспечение деятельности по повышению энергоэффективности.
ХИМИЧЕСКАЯ РЕАКЦИЯ
процесс превращения веществ, в результате которого изменяются состав, структура или заряд частиц при неизменной природе их атомов (т.е. процесс превращения одного или нескольких исходных веществ-реагентов в отличающиеся от них по химическому составу или строению вещества - продукты реакции). Процесс связан с разрывом одних и образованием других, новых связей; такой разрыв может происходить путем разделения связывающей пары электронов ковалентной связи. При химических реакциях не изменяется общее число атомов и изотопный состав химических элементов, a происходит перераспределение связей через образование промежуточного активированного комплекса. Для осуществления химической реакции необходимо соблюдение следующих условий:
- сближение взаимодействующих частиц на расстояние, сопоставимое с длиной химической связи между ними
- преодоление существующего между ними энергетического барьера
При протекании химических реакций могут происходить следующие физические процессы:
* столкновения молекул реагирующих веществ
* колебания атомов в молекулах
* вращение молекул
* колебательная релаксация
В результате реакций получают смесь продуктов (целевых, побочных, попутных) и не прореагировавших реагентов. Обычно продукты реакции являются устойчивыми соединениями.
Ядра атомов не принимают участия в таких превращениях, поэтому нельзя путем химической реакции получить золото из серебра или свинца. Характерные признаки химических явлений (реакций) - выделение или поглощение энергии в виде теплоты, выделение газов, изменение цвета реакционной смеси (например, растворов), появление запаха, изменение агрегатного состояния реагентов (например, появление воды, выпадение твердого осадка), т.е. протекание реакций всегда сопровождаются физическими эффектами.
В процессе химической реакции происходит изменение масс реагентов, энергии реакции, а поскольку процесс протекает в течение определенного времени, то каждая реакция имеет свою собственную скорость протекания. Химические реакции в основном инициируются активными частицами исходных веществ (ионами, радикалами или координационно-ненасыщенными соединениями).
6. ПАРАМЕТРЫ СОСТОЯНИЯ ПОТОКОВ. МАТЕРИАЛЬНЫЕ БАЛАНСЫ ХТС: СТЕХИОМЕТРИЧЕСКИЙ И ПРАКТИЧЕСКИЙ. МЕТОДИКИ СОСТАВЛЕНИЯ И РАСЧЕТА СТАТЕЙ ПРИХОДА И РАСХОДА. ПРИМЕРЫ.
ТЕРМОДИНАМИЧЕСКОЕ РАВНОВЕСИЕ, состояние термодинамич. системы, не изменяющееся во времени и не сопровождающееся переносом через систему в-ва или энергии. Если состояние системы не изменяется во времени, но есть поток в-ва или энергии через систему, состояние системы наз. стационарным. Изолированная система, не обменивающаяся со средой в-вом и энергией, со временем всегда приходит к термодинамическому равновесию и не может самопроизвольно из него выйти. Постепенный переход системы из неравновесного состояния, вызванного внеш. воздействием, в состояние термодинамического равновесия наз. релаксацией. Термодинамическое равновесие включает: термич. равновесие -постоянство т-ры в объеме системы, отсутствие градиентов т-ры; мех. равновесие, при к-ром невозможны никакие макроскопич. перемещения частей системы, т. е. имеется равенство давления в объеме системы; допустимы, однако, движения системы как целого-поступат. движение в поле действия внеш. сил и вращение. В случае гетерог. системы сосуществование термодинамически равновесных фаз наз. фазовым равновесием. Если между компонентами системы происходят хим. р-ции, в состоянии термодинамического равновесия скорости прямых и обратных процессов равны между собой (см. Химическое равновесие). При термодинамическом равновесии в системе прекращаются все необратимые переноса процессы (теплопроводность, диффузия, вязкое течение и т.п.). В системе не наблюдается изменение концентраций реагирующих в-в, для закрытой системы характерно равновесное распределение компонентов между составляющими систему фазами. Параметры состояния, определяющие термодинамическое равновесие, строго говоря, не являются постоянными, а флуктуируют около нек-рыхстатистич. средних значений; обычно эти флуктуации пренебрежимо малы. Принцип равновесия Гиббса. Для k-компонентной r-фазной системы при постоянстве ее внутренней энергии U, объема V и чисел молей компонентов ni (i = 1, 2, ..., k) условие термодинамического равновесия заключается в том, что при всех возможных изменениях параметров состояния энтропия 5 системы остается неизменной или уменьшается. Иными словами, энтропия изо-лир. системы при термодинамическом равновесии имеет условный максимум:
![]()
Буква d означает бесконечно малую вариацию величины, в т.ч. флуктуацию, в отличие от знака дифференциала, означающего действительно малое изменение величины в реальном процессе. Знак равенства имеет место при протекании в системе обратимых процессов, знак неравенства-необратимых (в случае изолир. системы). Принцип равновесия можно выразить также через термодинамические потен-циалы-внутр. энергию U, энтальпию H, энергию Гиббса G, энергию Гельмгольца F-при условиях, характеризуемых постоянством соответствующих параметров состояния. Термодинамическому равновесию отвечает условный минимум термодинамич. потенциалов:
![]()
Переход системы из одного состояния термодинамического равновесия в другое может происходить через последовательность состояний, каждое из к-рых является также состоянием термодинамического равновесия. Это означает, что параметры состояния в течение всего процесса перехода бесконечно мало отличаются от своих значений при термодинамическом равновесии. Это-равновесный (квазистатический) процесс. Реальные процессы перехода всегда неравновесны; они изучаются химической термодинамикой. Наряду с основным (глобальным) максимумом энтропии и минимумами термодинамич. потенциалов, отвечающими стабильному термодинамическому равновесию, в пространстве параметров состояния возможны локальные максимумы энтропии и минимумы термодинамич. потенциалов. Соответствующие им состояния системы наз. метастабильными равновесиями. Такие состояния, как и состояние стабильного термодинамического равновесия, локально устойчивы, т.е. устойчивы к бесконечно малым изменениям параметров состояния. Но метастабильные состояния термодинамического равновесия могут быть неустойчивыми при нек-рых конечных изменениях параметров. Под локальным термодинамическим равновесием в термодинамике неравновесных процессов подразумевается равновесие в очень малых (элементарных) объемах среды, содержащих все же достаточное число частиц (атомов, молекул, ионов), чтобы состояние этих объемов можно было характеризовать т-рой, давлением, хим. потенциалом и др. термодинамич. потенциалами, но не постоянными, а зависящими от координат и времени. При локальном термодинамическом равновесии элементарных объемов состояние системы в целом неравновесное. Лит.см. при ст. Химическая термодинамика.
Материальный баланс
Аппаратурный состав ХТС рассчитывают на основе уравнений материального баланса, являющихся конкретным выражением закона сохранения массы. Обычно материальный баланс составляют в расчете на единицу массы 100% -го готового продукта. Различают теоретический и практический материальные балансы. Теоретический материальный баланс рассчитывают на основе стехиометрических уравнений реакции и известных молекулярных масс реагирующих компонентов. Практический материальный баланс составляют с учетом состава сырья и целевого продукта; при этом учитывают необходимые избытки некоторых компонентов, а также допустимые потери сырья, промежуточных и конечных продуктов, которые неизбежны при периодическом способе организации технологических процессов. Средние значения потерь составляют при фильтровании 1-2%, при сушке 1-10%, при размоле, дроблении и смешении 0.5%, при выпаривании, дистилляции, ректификации 5-15%, при фасовке и упаковке 0.5%.
Существенная
особенность технологических систем
периодического действия состоит в
многостадийности процессов и
многооперационности стадий. В процессе
смены операций, протекающих в одном и
том же аппарате, в общем случае изменяется
объем находящейся в нем реакционной
массы (могут добавляться реагенты,
инертные растворители, может удаляться
часть содержимого аппарата). Поэтому
расчет оборудования на основе
интегрированного материального баланса,
составляемого для стадии в целом, часто
приводит к завышенным размерам аппаратов.
Более правильно составлять материальный
баланс для каждой операции и выделять
ту из них, которой соответствует
максимальный объем реакционной массы.
В общем виде уравнение материального
баланса принято записывать в виде: ![]()
Для получения практических материальных балансов обычно осуществляют экспериментальные исследования процессов синтеза продуктов в лабораторных или опытных цехах научно-исследовательских организаций (АО "Синтез", ИРЕА). Экспериментальный материальный баланс вносится в документ, называемый технологическим регламентом процесса синтеза конкретного продукта.
Определение основных размеров аппаратов стадий ХТС основано на расчете максимальных массовых или объемных загрузок технологических стадий процессов обработки партий продуктов. Поскольку размеры партий заранее не известны, осуществляется пересчет материального баланса из регламента на единицу массы (1т) 100%-го готового продукта. В результате определяется масса или (и) объем реагентов, которые необходимо обработать на каждой стадии системы для того, чтобы получить 1т готового продукта. Эти величины называют материальными индексами стадий и обозначают gj , j=1,...,J для индивидуальных ХТС и gi j , j=1,...J; i=1...I для совмещенных и гибких.
Большинство технологических стадий процессов синтеза продуктов многоассортиментных химических производств реализуется в аппаратах периодического действия и представляют собой упорядоченные последовательности технологических и организационных мероприятий. В процессе смены операций количество находящейся в аппарате массы может меняться, поэтому материальный баланс составляется для каждой операции, а размер аппарата определяется по той из них, которой соответствует максимальная загрузка.
Пример: определение размера аппарата для стадии аммонолиза процесса получения 2-аминоантрахинона (полупродукта для синтеза некоторых красителей). Процесс получения состоит из 4-х технологических стадий: аммонолиза, фильтрования, сушки, регенерации аммиака. Стадия аммонолиза проводится в емкостном реакторе с перемешивающим устройством и включает 5 технологических операций: смешение исходных реагентов, образование медно-аммиачного комплекса (химическая реакция), образование 2-амино-антрахинона (химическая реакция), выделение парогазовой фазы, разбавление оставшейся реакционной массы водой.
CuSO4*5H2O+4NH3=[Cu(NH3)4]SO4+5H2O
C14H11O2Cl+2NH3=C14H13O2N+NH4Cl.
Экспериментально установлено, что выход медно - аммиачного комплекса по 1-й реакции составляет 100( от теоретического, а выход - 2-аминоантрахинона по 2-й - 92.8(, причем 1.4( 2-аминоантрахинона переходит в примеси, а 5.8( остается в реакционной массе без изменений. Пооперационный материальный баланс стадии аммонолиза, представленный в таблице, пересчитан на 1т целевого продукта (знак "+" обозначает входящие компоненты, "-" - выходящие).Из таблицы видно, что совокупная масса загрузки и выгрузки составляет 13257 кг, а максимальное количество массы в аппарате за все время реализации стадии составит 9762 кг или 9766 л (разбавление водой происходит после отгонки водно - аммиачной смеси). При номинальном коэффициенте заполнения реактора 0.75 его объем составит 9766/0.75=13022л.
Объем реактора в этом примере рассчитан исходя из предположения, что система выпускает 1т 2-аминоантрахинона. Если реальный размер партии окажется другим, то объем максимальной загрузки аппарата следует вначале умножить на коэффициент W/1000, где W - реальный размер партии готового продукта в кг.
|
Технологическая операция |
Компоненты технол. потока |
Масса компонента, кг. |
Масса потока, кг. |
Масса(кг) и объем (л)загрузки при про-ведении операции |
|
1. Смешение исходных веществ |
C14H11O2Cl примеси аммиак вода CuSO4(5H2O примеси аммиак вода (возвр.) |
+1057.6 +21.4 +288.8 +866.2 +64.7 +1.3 +1011.4 +4045.6 |
+1079
+1155
+66
+5057 |
m=7357 V=7750 |
|
2. Получение [Cu(NH3)4]SO4 |
[Cu(NH3)4]SO4 вода |
- 59 - 21.8 |
- 80.8 |
-//- |
|
3. Получение C14H13O2N |
C14H11O2Cl вода аммиак C14H13O2N NH4Cl примеси |
- 61.8 - 8290.9 - 112.1 - 1000 - 216.4 - 34.4 |
- 9681.2 |
-//- |
|
4. Выделение парогазовой смеси |
вода аммиак |
- 2462 - 1033 |
- 3495 |
m=3862 V=3866 |
|
5. Разбавление массы водой |
вода |
+5900 |
+5900 |
m=9762 V=9766 |
7. ПАРАМЕТРЫ СВОЙСТВ ПОТОКОВ. ТЕПЛОВЫЕ БАЛАНСЫ ХТС. МЕТОДИКИ СОСТАВЛЕНИЯ И РАСЧЕТА СТАТЕЙ ПРИХОДА И РАСХОДА ТЕПЛОВОГО БАЛАНСА. ОПРЕДЕЛЕНИЕ ЭНТАЛЬПИИ ХИМИЧЕСКОЙ РЕАКЦИИ ПО СЛЕДСТВИЮ ИЗ ЗАКОНА ГЕССА.
Материальный и тепловой балансы составляют для анализа работы существующего аппарата, установки, производства или при проектировании нового. Материальный баланс технологического процесса или части его составляют на основании закона сохранения массы вещества, и это означает, что масса веществ, поступающих на технологическую операцию, равна массе полученных веществ.
Расчеты балансов основываются на технико-экономических показателях, рассмотренных в разделе 1. Для процессов, которые можно описать суммарной химической реакцией, материальный баланс складывается их двух частей: левая часть уравнения – приход, правая часть уравнения – расход. Материальный баланс рассчитывается или только по уравнению основной суммарной реакции (упрощенный) или с учетом всех параллельных, побочных реакций и продуктов (полный). Уравнение материального баланса:
Σmприх= Σmрасх. (2.1)
Σmприх– Σmрасх = 0,
где Σmприх– суммарная масса исходных веществ процесса цикла; Σmрасх – суммарная масса конечных продуктов процесса.
Материальный баланс обычно рассчитывается на единицу полученного продукта (кг, т, м3) или в % на основе данных производства.. Результаты сводят в таблицу. Материальный баланс служит основой для составления теплового и экономического балансов и поэтому составляется первым. В результате составления материального баланса можно вычислять практические расходные коэффициенты на сырье.
Тепловой (энергетический) баланс технологического процесса или части его составляют на основе закона сохранения энергии, в соответствии с которым в замкнутой системе сумма всех видов энергии постоянна, т.е. приход теплоты должен быть равен расходу его в данном процессе, аппарате, операции. Уравнение теплового баланса:
ΣQприх= ΣQрасх, (2.2)
где Qприх – сумма теплот Q1,Q2, Q3,; Q1 – теплота, приносимая входящими в аппарат веществами; Q2,- теплота экзотермических реакций, протекающих в данном аппарате; Q3 – теплота, вносимая извне за счет подогрева; ΣQрасх – сумма теплот Q4,Q5, Q6,; Q4 – теплота, уносимая выходящими из аппарата продуктами; Q5 – теплота эндотермических реакций,протекающих в аппарате; Q6 – потери теплоты в окружающую среду и отвод ее через холодильники, помещенные внутри аппарата Уравнение теплового баланса:
Q1 + Q2 + Q3 = Q4 +Q5 + Q6. (2.3)
Q1 и Q4 в технологии называют теплосодержанием материалов и рассчитывают для каждого вещества, поступающего в аппарат и выходящего из него:
Q1 или Q4 = m · с · t, (2.4)
где m – масса вещества (кг, моль) (берут из данных материального баланса); с – средняя теплоемкость этого вещества (берут из справочника); t – температура, отсчитанная от какой-либо точки (обычно 273К).
Тепловые эффекты химических реакций Q2 и Q5 могут быть рассчитаны на основе изобарных теплот образования из элементов различных веществ q0обр, или теплот сгорания, или энтальпии образования веществ ΔН298 в стандартных условиях (для массы 1 моль, давление 1.01 –105 Па, температуры 298К). Изменение энтальпии реакции ΔН численно равно тепловому эффекту реакции, взятому с обратным знаком:
ΔН = – Qр (2.5)
Изменение энтальпии реакции находим как разность энтальпии продуктов реакции и исходных веществ:
ΔНр= Σ ΔНпрод– Σ ΔНисх. (2.6)
Значение ΔНобрприведено в справочниках термохимических и термодинамических величин.
Подвод теплоты Q3 можно рассчитать по потере ее теплоносителем. Потери теплоты Q6 можно рассчитать по изменению теплоты хладоагента или в процентах к массе внесенной теплоты.
Пример 1.
Составьте упрощенный материальный баланс производства этилового спирта прямой гидратацией этилена. Состав исходной парогазовой смеси (в % по объему): этилен – 60, водяной пар – 40. Расчет вести на 1 т этилового спирта. Побочные реакции и давление не учитывать
Решение.
Получение этилового спирта прямой гидратацией этилена осуществляется при температуре 560 К и давлении 80·105 Па по реакции, протекающей по уравнению:
СН2= СН2 + Н2О ↔ С2Н5ОН + Qр
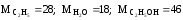
Приход.
Определяем теоретический расход
этилена: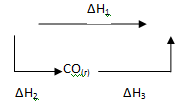
Ат = 28 · 1000/46 = 608.7 кг.
Тогда практический расход этилена с учетом степени превращения его составит:
608.7/0.05 = 12174 кг или 12174 · 22.4/28 = 9739.3 м3.
Находим объем водяного пара в парогазовой смеси:
9739.3 · 40/60 = 6492.8 м3 или 6492.8 · 18/22.4 = 5217.5 кг.
Расход. Определяем, сколько водяного пара израсходовано на гидратацию:
9739.3 · 0.05 = 486.97 м3.
Находим избыток водяного пара (проскок):
6492.8 – 486.97 = 6005.8 м3 или 6005.8 · 18/22.4 = 4826.2 кг.
Рассчитываем массу непрореагировавшего этилена
12174 – 608.7 = 11565.3 кг или 11565.3 · 22.4 /28 = 9252.3 м3.
Полученные данные сводим в таблицу.
Тепловой эффект реакции. Закон Гесса и следствия из закона Гесса.
Теплота (тепловой эффект) реакции - это количество тепловой энергии, выделившееся или поглощенное системой в результате протекающих в ней химических превращений.
Тепловой эффект обозначается символами Q или ΔH (Q = -ΔH). Реакции, идущие с выделением теплоты (Q > 0; ΔH < 0), относятся к экзотермическим, а с ее поглощением (Q < 0; ΔH > 0) - к эндотермическим. Химические уравнения, для которых указаны тепловые эффекты, называются термохимическими уравнениями. Например:
Н2(г) +
1/2О2(г) =
Н2О(ж),
![]()
где г – газ, ж – жидкость, r означает, что изменение энтальпии относится к химической реакции, (298) – температура системы; правый верхний индекс (о) указывает на стандартное состояние веществ, участвующих в реакции.
На теплоту образования веществ влияет их агрегатное и фазовое. Поэтому в термохимических уравнениях принято указывать это состояние (г - газ, ж - жидкость, т - твердое вещество, к - кристаллическая фаза).
В основе термохимических расчетов лежит закон постоянства количества теплоты, открытый русским химиком Г.И. Гессом в 1840 г.
Тепловой эффект реакции зависит только от начального и конечного состояний реагирующих веществ и не зависит от пути реакции (т.е. от числа стадий и промежуточных состояний).
Закон Гесса. Открыт в 1840 г российским ученым Г.И.Гессом. Тепловой эффект реакции, протекающей при постоянном давлении или постоянном объеме не зависит от пути протекания реакции и определяется только природой и состоянием исходных веществ и конечных продуктов.
Рассмотрим процесс получения оксида углерода (IV) из графита:
![]()
Эту же реакцию можно осуществить в две стадии через образование оксида углерода (II):
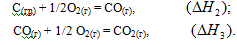
Эти реакции можно представить следующей схемой:
В соответствии с законом Гесса можно записать:
ΔН1 = ΔН2 + ΔН3 или ΔН1 - ΔН2 - ΔН3 = 0. (2.9)
Процессы, в которых система после ряда последовательных превращений возвращается в исходное состояние, называются круговыми процессами или термодинамическими циклами. Метод циклов используется для вычисления различных термодинамических свойств веществ.
Первое следствие закона Гесса. Энтальпия химической реакции равна сумме энтальпий образования продуктов реакции за вычетом суммы энтальпий образования исходных веществ. Энтальпия образования вещества В() это энтальпия реакции образования 1 моль соединения из простых веществ, устойчивых при стандартных условиях. Например.энтальпия образования нитрата натрия равна энтальпии реакции
Na(кр) +
½N2(г) +
3/2О2(г) = NaNO3(кр), 
Энтальпия образования простых веществ при стандартных условиях принята равной нулю. Энтальпия является свойством вещества, также как и масса, объем и т.д. Энтальпия _ функция состояния системы, т.е. ее изменение не зависит от пути процесса, а определяется только состоянием системы в конце и начале процесса.
Энтальпия химической реакции в общем виде аА + bB = dD + eE (2.10)
определяется
поуравнению ![]()
Второе следствие закона Гесса. Энтальпия химической реакции равна сумме энтальпий сгорания исходных веществ за вычетом суммы энтальпий сгорания продуктов реакции.
Энтальпия
сгорания вещества В ![]() это
энтальпия реакции окисления кислородом
1 моль соединения до образования
высших оксидов. Например энтальпия
реакции сгорания метанола есть изменение
энтальпии следующей реакции: СН3ОН
+ 3/2О2 =
СО2 +
2Н2О
это
энтальпия реакции окисления кислородом
1 моль соединения до образования
высших оксидов. Например энтальпия
реакции сгорания метанола есть изменение
энтальпии следующей реакции: СН3ОН
+ 3/2О2 =
СО2 +
2Н2О
Энтальпия химической реакции в общем виде (2.10) определяется по уравнению
![]()
Таблица 1
Материальный баланс производства этилового спирта прямой гидратацией этилена
Пример 2.
Составьте тепловой баланс реактора синтеза этилового спирта, где протекает реакция
СН2=СН2 +Н2О ↔С2Н5ОН + Qр (Qр=46090 кДж/кмоль),
Если исходный газ имеет состав: 40% Н2О и 60% С2Н4, скорость его подачи в реактор-гидрататор 2000м3/ч, температура на входе 614 К, конверсия за проход этилена 5%. Теплоемкость продуктов на входе и выходе одинакова и равна 27.1 кДж/кмоль. Побочные процессы и продукты не учитывать. Потери теплоты в окружающую среду принимаем 3% от прихода теплоты.
Решение.
Находим состав исходного газа:
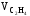 =
2000 · 0.6 = 1200 м3,
=
2000 · 0.6 = 1200 м3,
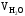 =
2000 · 0.4 = 800 м3.
=
2000 · 0.4 = 800 м3.
Определяем состав газа на выходе из реактора:
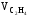 =1200
– 1200 · 0.05 = 1140 м3,
=1200
– 1200 · 0.05 = 1140 м3,
 =
800 – 1200 · 0.05 = 740 м3,
=
800 – 1200 · 0.05 = 740 м3,
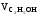 =
1200 · 0.05 = 60 м3.
=
1200 · 0.05 = 60 м3.
Находим суммарный объем газа (на выходе из реактора):
V = 1140 + 740 + 60 = 1940 м3.
Тепловой баланс:
Q1 + Q2 = Q3 + Q4
Рассчитываем приход теплоты. Физическая теплота газа:
Q1 = (2000/22.4) · 27.1 · 290 = 701396.5 кДж.
Теплота реакции:
Q2 = (2000/22.4) · 0.6 · 46090 · 0.05 = 123460 кДж
Всего: ΣQприх= 825156.5 кДж.
Определяем расход теплоты. Теплота, уносимая отходящими газами:
Q3 = (1940/22.4) · 27.1 · 341 = 800345.4 кДж
Q4 = 825156.5 · 0.03 = 24754.7 кДж
Всего: ΣQрасх= 825100.1 кДж
8.ОПИСАТЕЛЬНЫЕ МОДЕЛИ ХТС:
Каждое производство в соответствии с общей теорией систем является сложной системой, которая называется химико-технологической системой.
Модели ХТС: качественные и математические.
Качественные: описательные и графические. Графические в свою очередь делятся на: функциональные схемы, структурные схемы, операторные схемы, технологические схемы.
Математические: символические (аналитические) и графические.
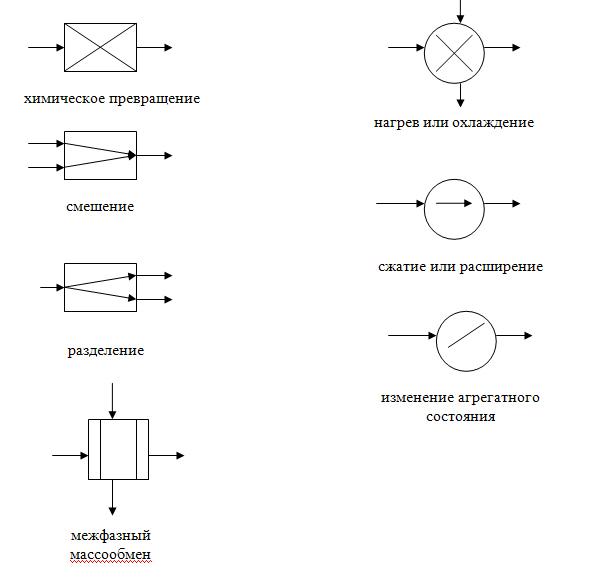
Описательная модель – это словесное описание процесса функционирования системы. В нем приводятся основные химические реакции, дается описание процессов, происходящих в аппаратах, приводятся сведения о составе сырья, значениях параметров технологического режима и т.д. Примером описательной модели ХТС является технологический регламент- основной закон и настольная книга инженера-технолога на химическом предприятии. В нем описано, как нужно проводить технологический процесс. Нарушение технологического регламента влечет за собой административное, а в некоторых случаях, и уголовное наказание. Графические качественные модели ХТС – это различные виды схем технологического процесса. Существует несколько разновидностей таких схем: функциональная (принципиальная), структурная, операторная, технологическая.Функциональная схема дает самое общее представление о процессе функционирования ХТС и создается на первом этапе синтеза системы. На этом схеме показывают последовательность основных этапов получения химического продукта. Простейшим элементом функциональной схемы является подсистема. На основе функциональной схемы составляют материальный баланс процесса. На следующих этапах проектирования составляются структурная и операторная схемы. Структурная схема дает изображение всех элементов ХТС в виде блоков, имеющих несколько входов и выходов, и показывает технологические связи между блоками. Простейшим элементом схемы является блок. Операторная
схема дает
наглядное представление о физико-химической
сущности технологических процессов
системы. Для этого каждый элемент ХТС
изображают в виде определенного типового
технологического оператора.
Каждый оператор имеет свое графическое
изображение. На основе операторной
схемы тоже можно считать балансы, как
материальные, так и тепловые.
Технологическая
схема дает
наиболее полное представление о
процессе. Она составляется на последнем
этапе проектирования ХТС на основе
операторной схемы. На технологической
схеме оператор заменяется на
конкретныйаппарат,
выполняемый в виде эскиза в определенном
масштабе. Стандартное изображение
аппаратов приводится в документах
Единой системы конструкторской
документации (ЕСКД). На каждый аппарат
имеется свой ГОСТ. Для каждого аппарата
показывают «обвязку», то есть подвод
сырья, пара, воды, сжатых газов и т.д. и
отвод продуктов в виде линий с указанием
точек размещения основной запорной
арматуры. Технологические связи
показывают линиями со стрелками.
Все
оборудование схемы нумеруют слева
направо в порядке направления сырьевых
и продуктовых потоков, используя
буквенный индекс оборудования с
добавлением через черточку порядкового
номера аппарата, например, колонна К-1,
теплообменник Т-2 и т.д. Технологическая
схема снабжается спецификацией
оборудования, технологических линий
и привязки основной контрольно-измерительной
аппаратуры и регулирующих приборов.
Форма представления спецификации также
стандартизирована.
Технологическая
схема сопровождается описанием. Описание
производится по каждой подсистеме,
начиная с поступления и подготовки
сырья и кончая отгрузкой готового
продукта с указанием технологических
параметров процесса, характеристикой
оборудования, систем регулирования и
т.д. со ссылкой на чертеж технологической
схемы. Технологическая схема совместно
с описанием составляет основу технологического
регламента.