
- •Глава 5. Структура и свойства липидов
- •5.1. Структура и свойства липидов. Строение биомембран
- •5.1.1. Классификация липидов
- •Состав и свойства жирных кислот
- •5.1.2. Свойства полярных липидов и их агрегатов
- •Толщина липидных бислоев определяется длиной углеводородных цепей, а также наличием в них двойных связей и заместителей, т. Е. Плотностью упаковки гидрофобных хвостов. Она составляет 4−5 нм.
- •5.1.3. Строение и свойства биомембран
- •5.2. Перекисное окисление липидов
- •Пути образования активных форм кислорода
- •5.3. Методы выделения и хроматографического анализа липидов
- •Элюотропные ряды органических растворителей
- •Лабораторная работа выделение липидов и изучение их свойств
- •Выполнение работы
- •1. Выделение липидов из растительного материала
- •2. Качественный анализ липидов методом тонкослойной хроматографии
- •3. Исследование процесса перекисного окисления липидов
- •Вопросы для самоконтроля
Лабораторная работа выделение липидов и изучение их свойств
Цель работы – освоение методов выделения липидов из растительного материала и их качественного анализа с помощью тонкослойной хроматографии; исследование процесса перекисного окисления липидов и влияния антиоксидантов на интенсивность окисления липидов.
Реактивы, материалы и оборудование: семена льна масличного; оксид алюминия; гексан; изопропиловый спирт; физиологический раствор (0,85%-ный раствор NaCl); сульфат натрия (безводный); дистиллированная вода; этанол (96 об.%); 1 · 10−2 М растворы маннита, глутатиона, ионола, -токоферола; 2 · 10−2 М раствор FeSO4; 0,2 М раствор Н2О2; 1%-ный раствор тритона Х-100; 0,6 М раствор НСl; 0,06 М раствор тиобарбитуровой кислоты в 50%-ном этаноле с 1% тритона Х-100; 1%-ный раствор тритона Х-100 в 50%-ном этаноле; 5 мМ раствор трилона Б; шпатели; фильтровальная бумага; ступки; пипетки на 1, 2, мл; автоматические пипетки на 200 и 1000 мкл; химически чистые пробирки; пробирки с пришлифованными стеклянными пробками; стеклянные воронки; кюветы для фотоэлектроколориметра; штативы для пробирок; электронные весы; ультратермостат; суховоздушный термостат; фотоэлектроколориметр.
Выполнение работы
1. Выделение липидов из растительного материала
Небольшое количество (~0,5 г) семян льна масличного взвешивают, добавляют 1−2 мл смеси гексан + изопропиловый спирт (1 : 1 об.) и растирают в фарфоровой ступке с 0,5−1,0 г окиси алюминия (Аl2O3) в течение 10 мин. Затем приливают еще 3 мл экстрагента и снова растирают содержимое на протяжении 1−2 мин.
Полученную суспензию фильтруют через фильтровальную бумагу. Осадок на фильтре промывают 5 мл экстрагента, которым предварительно ополаскивают ступку и пестик. Для более полного удаления экстракта осадок на фильтре необходимо слегка (очень осторожно, чтобы не порвать фильтр) отжать. Затем экстракт липидов промывают физиологическим раствором (0,4 объема от объема липидного экстракта) для удаления нелипидных примесей. Смесь тщательно перемешивают встряхиванием.
После расслоения фаз верхнюю органическую фазу аккуратно при помощи пипетки переносят в отдельную пробирку и добавляют к ней 0,3−0,5 г безводного сульфата натрия до просветления экстракта. Полученный липидный экстракт сливают с осадка сульфата натрия в небольшую колбочку или пробирку с пришлифованной стеклянной пробкой (резиновые пробки использовать нельзя!) и хранят в холодильнике.
2. Качественный анализ липидов методом тонкослойной хроматографии
Проводят, как описано выше.
3. Исследование процесса перекисного окисления липидов
0,2 мл полученного липидного экстракта помещают в пробирку и выпаривают растворитель при комнатной температуре. Затем к экстракту добавляют 1,1 мл 96%-ного этилового спирта и 0,3 мл дистиллированной воды. Пробирку интенсивно встряхивают для максимальной дезинтеграции и полного эмульгирования капель липидов.
К липидной эмульсии добавляют 0,2 мл 1 · 10−2 М раствора исследуемого антиоксиданта (маннит, глутатион, -токоферол (см. примечание) или ионол). Реакцию перекисного окисления липидов запускают добавлением 0,2 мл 2 · 10−2 М раствора FeSO4 и 0,2 мл 0,2 М раствора Н2О2 (реакция Фентона).
Параллельно готовят две контрольных пробирки для проверки:
перекисного окисления липидов в отсутствие антиоксиданта (к липидной эмульсии добавляют растворы FeSO4 и Н2О2, а вместо раствора антиоксиданта дистиллированную воду);
самопроизвольного или автоокисления липидов (к липидной эмульсии вместо растворов антиоксиданта, FeSO4 и Н2О2 добавляют дистиллированную воду).
Пробирки помещают в термостат и выдерживают при температуре 37°С в течение 24 ч.
Затем к 0,5 мл содержимого каждой пробирки последовательно вносят:
0,5 мл 1%-ного раствора тритона Х-100;
0,2 мл 0,6 М раствора НСl;
0,8 мл 0,06 М раствора 2-тиобарбитуровой кислоты (ТБК) в 50%-ном этаноле с 1% тритона Х-100.
Пробирки нагревают в кипящей водяной бане в течение 10 мин. Затем их охлаждают при температуре 15°С на протяжении 30 мин. Для стабилизации окраски после охлаждения пробирок к смеси добавляют 0,2 мл 5 мМ раствора трилона Б и 5 мл 96%-ного этанола.
Измеряют экстинкцию растворов при 532 нм в кюветах (l = 0,5 см) на фотоэлектроколориметре против контрольной пробы, содержащей растворы тритона Х-100, НСl и 1%-ный раствор тритона Х-100 в 50%-ном этаноле вместо раствора ТБК.
Каждое определение проводят 3 раза и за результат измерения принимают среднее арифметическое значение экстинкции.
Сравнивают между собой интенсивности окрашивания растворов, содержащих разные антиоксиданты и без них и рассчитывают количество малонового диальдегида в каждой пробе, используя коэффициент молярной экстинкции окрашенного триметинового комплекса:
![]()
![]() (5.2)
(5.2)
где СМА – молярная концентрация малонового диальдегида, М; Е532 – поглощение или экстинкция раствора при 532 нм; коэффициент молярной экстинкции триметинового комплекса, равный 1,56 · 105 М1·см1; l – толщина кюветы, см.
Делают вывод о степени окисленности липидов и влиянии антиоксидантов на интенсивность перекисного окисления.
Примечание. При использовании в качестве антиоксиданта -токоферола последний получают путем гидролиза фармакопейного -токоферола ацетата непосредственно перед использованием.
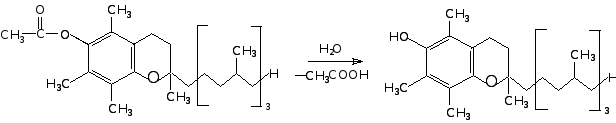
-токоферола ацетат -токоферол
Для этого 21,5 мг -токоферола ацетата смешивают с 25 мл этанола (96 об.%). К 8 мл этой смеси добавляют 2 мл дистиллированной воды и 1−2 капли 1 н раствора NaOH. Содержимое перемешивают на магнитной мешалке при комнатной температуре в течение часа. Концентрация -токоферола в растворе составляет 1,6 · 10−3 М.
