
Богомазова_Коррозия и защита металлов
.pdf3. КОРРОЗИЯ И ЗАЩИТА МАТЕРИАЛОВ
Лекция № 13 3.1. Общие положения теории коррозии
Коррозией металлов называют самопроизвольное разрушение металлов и сплавов вследствие их взаимодействия с окружающей средой. В основе этого взаимодействия лежат химические и электрохимические реакции, в которых металл окисляется, а иногда и механическое воздействие внешней среды. Металл, подвергающийся коррозии, называется корродирующим металлом, а среда, в которой протекает коррозионный процесс, – коррозионной средой. Химические соединения, образующиеся в результате взаимодействия металла и коррозионной среды, называют продуктами коррозии. В общем виде процесс коррозии металла можно представить схемой:
Ме + окислитель → продукты коррозии (Меn+, MexOy, Me(OH)n, соли)
Коррозия является физико-химическим процессом, закономерности которых определяются законами термодинамики и кинетики гетерогенных систем. Количественно скорость коррозии отражают пока-
затели коррозии, среди которых различают весовой, токовый и глу-
бинный показатели. Весовой показатель Кm коррозии показывает изменение веса образца на единицу поверхности в единицу времени
|
Кm = |
m − m0 |
, |
(3.1) |
|
|
|||
|
|
S ×τ |
|
|
где m – конечная масса испытуемого образца, г; |
|
|||
m0 – масса образца до коррозии, г; |
|
|||
S – |
площадь корродирующей поверхности, м2; |
|
||
τ – |
продолжительность коррозии, ч. |
|
||
Если m > m0, имеем положительный показатель коррозии, (продукты коррозии остаются на поверхности образца), если m < m0, то показатель коррозии – отрицательный (металл растворяется).
Весовой показатель коррозии связан с токовым:
i= |
Km |
= |
Km × n × F |
, |
(3.2) |
qме |
|
||||
|
|
М |
|
||
где i – анодная плотность тока коррозии металла, А/м2; n – число моль электронов, моль e/моль;
F – число Фарадея, F = 26,8 А·ч/моль (96485 Кл/моль); qме – электрохимический эквивалент металла, г/А·ч; М – молярная масса металла, г/моль;
70
Для равномерной коррозии металла на основании данных весового метода или электрохимических исследований можно получить глубинный показатель коррозии. Глубинный показатель коррозии связан с объемом разрушившегося металла и характеризует глубину проникновения коррозионного разрушения в течение определенного времени. Глубинный показатель П (мм/год) рассчитывается по формуле
П= |
Кm |
×8,76 , |
(3.3) |
ρ |
где 8,76 – коэффициент, учитывающий перевод единиц измерения; ρ – плотность корродирующего металла, г/см3.
Одна и та же потеря массы на единицу площади легкого металла, например, алюминия, соответствует большей глубине проникновения коррозии, чем для тяжелых металлов, например, свинца.
По глубинному показателю коррозии оценивают коррозионную стойкость металла, пользуясь десятибалльной шкалой (табл.3.1, ГОСТ
13819–68).
Cвязь весового, глубинного и токового показателей электрохими-
ческой коррозии следует из уравнений (3.2) и (3.3):
Km |
= |
П × ρ |
= i × q . |
(3.4) |
|
||||
|
8,76 |
|
|
|
Для некоторых металлов (табл. 3.2), плотность которых лежит в интервале ρ = 7–9 г/см3, а электрохимический эквивалент близок к 1 (q ≈ 1 г/А·ч), из (3.8) следует:
Km [г/м2·ч] ≈ П [мм/год] ≈ i [А/м2].
По скоростям коррозии и областям применения металлы, корродирующие равномерно, могут быть разделены на три группы:
1)скорость коррозии не превышает 0,15 мм/год: металлы обладают высокой коррозионной стойкостью, они пригодны для изготовления ответственных изделий (например, валы и поршни, пружины);
2)скорость коррозии от 0,15 до 1,5 мм/год: металлы при отсутствии повышенных требований к коррозионной стойкости могут применяться для изготовления емкостей, трубопроводов, корпусов вентилей, болтов;
3)скорость коррозии больше 1,5 мм/год: такие металлы в технике не используются.
71
|
|
|
|
|
|
|
|
|
|
Таблица 3.1 |
|
Десятибалльная шкала оценки коррозионной устойчивости металлов |
|
||||||||
|
|
и коррозионной активности сред по ГОСТ 13819 – 68 [6] |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
Глубина корро- |
|
Скорость коррозии, г/(м2·ч) |
|
|
Характеристика |
Коррозионная |
|||
Балл |
зионного про- |
|
медь, |
свинец |
|
алюминий |
магний |
|||
черные |
|
устойчивости |
активность |
|||||||
стойкости |
никновения, |
никель |
и |
|
и |
|
и |
|||
металлы |
|
|
металла |
среды |
||||||
|
мм/год |
и сплавы |
сплавы |
|
сплавы |
сплавы |
||||
|
|
|
|
|
||||||
1 |
менее 0,001 |
менее |
менее |
менее |
|
менее |
|
менее |
Совершенно |
Отсутствует |
0,0009 |
0,001 |
0,0013 |
|
0,0003 |
0,0002 |
стойкие |
||||
|
|
|
|
|||||||
2 |
0,001–0,005 |
0,0009– |
0,001– |
0,0013– |
|
0,0003– |
0,0002– |
|
|
|
0,0045 |
0,005 |
0,0065 |
|
0,0015 |
0,0010 |
|
|
|||
|
|
|
Весьма стойкие |
Низкая |
||||||
3 |
0,005–0,010 |
0,0045– |
0,005– |
0,0065– |
|
0,0015– |
0,001– |
|||
|
|
|
||||||||
0,0090 |
0,010 |
0,0130 |
|
0,0030 |
|
0,002 |
|
|
||
|
|
|
|
|
|
|||||
4 |
0,01–0,05 |
0,009– |
0,01–0,05 |
0,013– |
|
0,003– |
0,002– |
|
|
|
0,045 |
0,065 |
|
0,025 |
|
0,010 |
|
|
|||
|
|
|
|
|
Стойкие |
Средняя |
||||
5 |
0,05–0,10 |
0,045– |
0,05–0,10 |
0,065– |
|
0,025– |
0,01–0,02 |
|||
|
|
|
||||||||
0,090 |
0,130 |
|
0,030 |
|
|
|||||
|
|
|
|
|
|
|
|
|||
6 |
0,1–0,5 |
0,090– |
0,10–0,50 |
0,13–0,65 |
|
0,03–0,15 |
0,02–0,10 |
Понижено- |
|
|
0,045 |
|
Повышенная |
||||||||
|
|
|
|
|
|
|
|
стойкие |
||
7 |
0,5–1,0 |
0,45–0,90 |
0,5–1,0 |
0,65–1,30 |
|
0,15–0,31 |
0,1 |
–0,2 |
|
|
|
|
|
||||||||
8 |
1,0–5,0 |
0,9–4,5 |
1,0–5,0 |
1,3–6,5 |
|
0,31–1,54 |
0,2–1,0 |
Малостойкие |
Высокая |
|
9 |
5,0–10,0 |
4,5–9,0 |
5,0–10,0 |
6,5–13,0 |
|
1,54–3,10 |
1,0– |
2,0 |
||
|
|
|
||||||||
10 |
свыше |
свыше |
свыше |
свыше |
|
свыше |
свыше |
Нестойкие |
Очень |
|
10,0 |
9,0 |
10,0 |
13,0 |
|
3,1 |
|
2,0 |
высокая |
||
|
|
|
|
|||||||
72
Первопричиной коррозии металлов является термодинамическая неустойчивость металлов в различных коррозионных средах при данных внешних условиях. Возможность осуществления коррозионного процесса при изменении внешних параметров можно оценить знаком изменения изобарно-изотермического потенциала реакции. Если ∆G < 0, то протекание коррозионного процесса термодинамически возможно.
В природных условиях большинство металлов находятся в связанном состоянии в виде оксидов или солей. Следовательно, для них это состояние является термодинамически наиболее устойчивым. Для того чтобы из природных соединений получить металлы или сплавы, которые используются как конструкционные материалы, нужно затратить энергию. Таким образом, в промышленных условиях большинство металлов и сплавов находятся в термодинамически неустойчивом состоянии. Стремление металлов перейти из металлического в ионное состояние характеризуется величиной уменьшения изобарно-изотермического потенциала реакции (или свободной энергии Гиббса – ∆G).
Наименее коррозионно-устойчивыми металлами являются электроотрицательные металлы (К, Ca, Na, Мg). Реакция ионизации этих металлов сопровождается убылью свободной энергии и вероятность перехода их в окисленное состояние тем больше, чем значительнее уменьшение ∆G. Эти металлы в природе встречаются в виде руд и солей. Наиболее коррозионно-устойчивые металлы − Pd, Ir, Pt, Au. Положительное значение изменения свободной энергии для их окисления указывает на невозможность самопроизвольного протекания реакций ионизации. В природных условиях золото, платина, иридий и палладий являются термодинамически устойчивыми. Они, как правило, встречаются в самородном состоянии. В зависимости от условий эксплуатации устойчивость металла может в значительной степени меняться. Например, в растворах азотной кислоты алюминий и хром устойчивее меди. А в растворах щелочей магний более стоек, чем алюминий или цинк, что объясняется образованием поверхностных защитных пленок, то есть с кинетическим торможением процесса окисления.
Кинетические закономерности коррозии могут быть описаны основным постулатом химической кинетики, уравнением Аррениуса. В общем случае выделяют 3 основных стадии коррозионных процессов:
1)подвод компонентов коррозионной среды к поверхности металла (диффузионная);
2)химическая реакция на поверхности металла (кинетическая);
73

3) отвод продуктов коррозии от поверхности металла (диффузионная).
Коррозионные процессы, как и другие химические процессы, могут протекать с диффузионным или кинетическим контролем.
Классификация коррозионных процессов По механизму процесса различают химическую и электрохимиче-
скую коррозию металлов. Химическая коррозия – это процесс взаимодействия металла с коррозионной средой, при котором окисление металла и восстановление окислительного компонента среды протекают единовременно в одном акте. Например, окисление магния при нагревании на воздухе.
Mg + 2H2O = Mg(OH)2 + H2− |
(3.5) |
Электрохимическая коррозия – это процесс взаимодействия металла с коррозионной электропроводящей средой, при котором окисление атомов металла и восстановление окислительного компонента коррозионной среды протекают не в одном акте, а разделены во времени и в пространстве. При этом скорости процессов зависят от электродного потенциала металла. В этом случае собственно коррозия, то есть окисление металла, протекает на анодных участках корродирующего металла, а восстановление окислителя коррозионной среды – на катодных участках. В примере с магнием суммарный процесс коррозии бу-
дет описываться таким же уравнением (3.6). |
|
|||
А: Mg – 2e |
= Mg 2+ |
|
||
K: 2H2O + |
2e = H2 |
+ OH− |
H2− |
(3.6) |
Mg + 2H2O = Mg(OH)2 + |
|
|||
Таким образом, условием протекания коррозии по электрохимическому механизму является, во-первых, достаточная электропроводность коррозионной среды и, во-вторых, неоднородность поверхности металла, что приводит в возникновению анодных, более электроотрицательных, и катодных, более электроположительных, участков. Заметим, что неоднородность корродирующей поверхности может быть связана с самим металлом, с коррозионной средой, а также с условиями процесса (температура, давление, освещенность и др.). Если анодные и катодные участки закреплены во времени на определенных поверхностях, то выделяют гетерогенно-электрохимическую корро-
зию. Если они мигрируют по поверхности во времени, говорят о гомо- генно-электрохимической коррозии. В природных условиях электрохимическая коррозия встречается повсеместно, поскольку реальные коррозионные среды содержат воду и ионы, то есть являются электролитами. Это, например, атмосферная, морская, подземная коррозия.
74
По условиям протекания процесса коррозии выделяют газовую, жидкостную (в жидких реактивных средах), морскую (по ватер-
линии), атмосферную, подземную или почвенную, контактную (при контакте разнородных металлов), радиационную (при облучении), щелевую (в дезаэрированных зонах) коррозию, а также биокоррозию (при воздействии продуктов жизнедеятельности живых организмов), корро-
зию внешним и блуждающим током, коррозию под напряжением (ме-
ханическим), кавитационную коррозию (при воздействии кавитации), фреттинг-коррозию (при взаимном колебательном движении) и др.
По характеру разрушений выделяют сплошную (равномерная, неравномерная и избирательная) и местную или локальную коррозию. Среди видов локальной коррозии можно отметить коррозию пятнами,
язвами и точечную или питтинг-коррозию (наиболее опасная, т.к. очень глубокая), подповерхностную и сквозную коррозию, межкристаллитную и транскристаллитную, ножевую (по сварным швам) и
послойную (в направлении пластической деформации).
а) |
б) |
|
в) |
г) |
|
д) д)
а) – контактная; б) – щелевая; в) – кавитационная; г) – фреттинг; д) – питтинг; е) – межкристаллитная коррозия
Рис. 3.1. Схемы протекания некоторых видов коррозии металлов
75
3.2. Электрохимическая коррозия
Лекция № 14
Термодинамические аспекты электрохимической коррозии связаны с возникновением на границе раздела фаз металл-электролит электродного потенциала, под которым понимают разность потенциалов, возникающую на границе раздела двух проводящих фаз в результате образования двойного электрического слоя (ДЭС). Различают равно-
весный, стационарный и токовый (рабочий) потенциалы.
Равновесный потенциал соответствует равенству скоростей процесса окисления и обратного ему процесса восстановления на электроде. Ток через электрод в этом случае не протекает.
Величина равновесного потенциала металла зависит от температуры и активности реагирующих веществ и может быть рассчитана по уравнению Нернста:
|
|
|
= Е° + |
RT |
ln |
a |
n + |
, |
(3.7) |
|
Е |
|
|
Ме |
|
||||
|
р |
nF |
aме |
||||||
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|||
где Е° – стандартный электродный потенциал металла, В; |
|
||||||||
R – |
универсальная газовая постоянная, Дж/моль·К; |
|
|||||||
Т – |
абсолютная температура, К; |
|
|
|
|
|
|||
аМеn+, аМе – активность ионов и атомов металла соответственно; n – число моль электронов, участвующих в реакции, моль e/моль; F – число Фарадея, F = 26,8 А·ч/моль ( 96485 Кл/моль); Стандартный электродный потенциал представляет собой част-
ный случай равновесного потенциала при активности ионов металла в растворе равной единице.
Причиной электрохимической коррозии, как уже отмечалось, является термодинамическая неустойчивость металлов в среде электролита. Процесс электрохимической коррозии представляет собой совокупность двух сопряженно протекающих реакций.Металл является донором электронов и на его поверхности протекает реакция окисления:
Me – ne → Меn+.
Катодная реакция, которую называют катодной деполяризующей реакцией, протекает с участием компонентов электропроводящей среды. Окислителями (или деполяризаторами) коррозионной среды могут быть либо водород в виде ионов Н+ или молекул Н2О (водородная деполяризация):
76
Н3О+ + е = ½Н2 + Н2О в кислых растворах, 2Н2О + 2е = Н2 + 2ОН– в щелочных растворах,
либо кислород в виде молекул О2 (кислородная деполяризация):
О2 + 2Н2О + 4е = 4ОН– в нейтральных и щелочных растворах,
О2 + 4Н+ + 4е = 2Н2О в кислых растворах.
Для электрохимических реакций свободная энергия Гиббса рассчитывается по уравнению
G = – n·F· E |
(3.8) |
где ∆Е – разность равновесных потенциалов катодной и анодной |
|
реакции: |
|
E = Epк – Epa |
(3.9) |
Электрохимическая коррозия термодинамически возможна, если |
|
∆G < 0 или ∆Е > 0, т. е. если равновесный потенциал катодного про- |
|
цесса положительнее равновесного потенциала анодного |
процесса |
(ионизации металла) Еpк > Epa. Таким образом, по термодинамической устойчивости в водных средах металлы можно разделить на несколько групп (таблица 3.2).
Таблица 3.2
Термодинамическая устойчивость металлов в водных средах
Стандартный элек- |
Характеристика термодина- |
Вероятные процессы кор- |
|||||
тродный потенциал |
мической устойчивости ме- |
||||||
|
розии |
|
|||||
металла, E°, В |
таллов |
|
|
||||
|
|
|
|
||||
Отрицательнее |
Пониженная |
устойчивость |
Коррозия |
с |
водородной |
и |
|
Ер(Н2 ) (–0,415 при |
металлов Zn, Mn, Fe и др. |
кислородной |
деполяриза- |
||||
рН=7 и РН2 =1атм) |
|
|
цией во всех среах |
|
|||
|
|
|
|
|
|
||
|
|
|
|
|
|
||
−0,415–0 |
Недостаточная |
термодина- |
Коррозия |
в |
нейтральных |
||
|
мическая устойчивость ме- |
средах только при наличии |
|||||
|
таллов – Cd, Ni, Sn |
кислорода и окислителей |
|
||||
0–0,815 |
Промежуточная |
стабиль- |
Коррозионно-устойчивы |
в |
|||
|
ность (полублагородные ме- |
отсутствии |
кислорода |
в |
|||
|
таллы) – Cu, Bi, Ag |
кислых, нейтральных рас- |
|||||
|
|
|
творах |
|
|
|
|
Положительнее |
Высокая термодинамическая |
Устойчивы в нейтральных |
|||||
Ер(О2 ) (0,815 при |
устойчивость (благородные |
средах при наличии кисло- |
|||||
рН=7 и РО =1атм) |
металлы) – Au, Pt, Pd |
рода, окислителей или |
|||||
|
|
комплексообразователей |
|
||||
2 |
|
|
|
||||
|
|
|
|
|
|
|
|
Некоторые металлы (железо, алюминий, титан, хром, никель) относительно устойчивы благодаря переходу в пассивное состояния.
77
В реальных условиях коррозии металла в реакциях обмена на границе металл/электролит участвуют не только ионы металла, но и другие компоненты раствора. В этих случаях устанавливаются стационарные или необратимые электродные потенциалы, которые не подчиняются уравнению Нернста. Измерить абсолютное значение электродного потенциала невозможно. Он может быть замерен только по отношению к какому-то электроду сравнения. В качестве основного электрода сравнения принят стандартный водородный электрод. Наиболее часто в качестве электрода сравнения применяют каломельный и хлорсеребряный электроды.
Современная теория электрохимической коррозии металлов исходит из возможности протекания процесса как гомогенно-
электрохимическим, так и гетерогенно-электрохимическим путем, из которых второй путь в практических случаях преобладает.
Согласно теории локальных элементов катодное восстановление окислителя (например, выделение водорода) может происходить только на некоторых участках поверхности корродирующего металла
– катодных участках, а растворение металла возможно на других – анодных участках. Происходит пространственное разделение катодной и анодной реакций, позволяющее рассматривать коррозионный процесс как функционирование большого числа «короткозамкнутых гальванических элементов». Эти отличающиеся по своим свойствам физическим и химическим свойствам участки корродирующей поверхности металла являются в зависимости от их размеров короткозамкнутыми макрогальваническими (с размерами хорошо различимыми невооруженным глазом) или микрогальваническими (обнаруживаемыми при помощи микроскопа) элементами.
Рассмотрим три основных типа гальванических элементов, принимающих участие в коррозионных процессах.
1.К элементам c разнородными электродами относится металл, имеющий электропроводящие включения на поверхности, или гетерогенный многофазный сплав (рис. 3.2), а также металл или сплав, контактирующий с другим металлическим материалом. Защитные пленки на металле могут являться неоднородными или пористыми, тогда металл в порах является анодом.
2.В концентрационных элементах два одинаковых электрода контактируют с растворами разных составов. Существуют два типа концентрационных элементов. Первый называется солевым концентрационным элементом. При замыкании такого элемента, раство-
78
ряться будет металл с электрода, находящегося в разбавленном растворе (анод) и осаждаться на другом электроде (катоде).
Рис.3.2. Элемент с разнородными электродами: К – катодные участки, А – анодные участки.
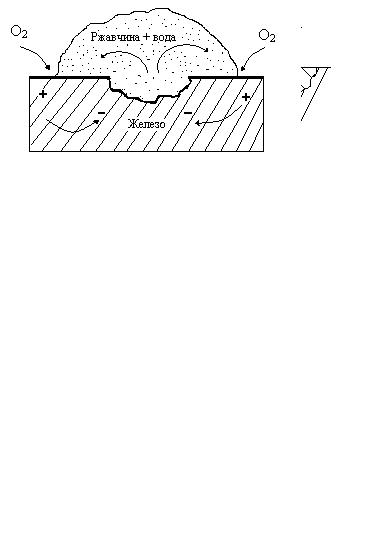
Другой тип концентрационного элемента, имеющий большое практическое значение, – элемент дифференциальной аэрации. Воз-
никновение элемента этого вида вызывает разрушения в щелях (щелевая коррозия), образующихся на стыках труб или в резьбовых соединениях, поскольку концентрация кислорода в щелях ниже, чем снаружи. Этим также объясняется язвенное разрушение под слоем ржавчи-
ны (рис. 3.3).
Рис.3.3 Элемент дифференциальной аэрации на железе со ржавчиной
3. Физические гальванические элементы возникают при неодно-
родности физических условий – различие температуры, облучения, неравномерное наложение электрического поля.
В термогальванических элементах электроды из одного и того же металла, имеющие разную температуру, погружены в электролит одинакового состава. При замыкании элемента металл осаждается на горячем электроде и растворяется с холодного.
Современная теория электрохимической коррозии металлов не противопоставляет два пути (гомогенный и гетерогенный) протекания
79
