
- •Учреждение образования
- •Введение
- •Условные обозначения
- •1. Основные технологические показатели и их расчет
- •1.1. Способы выражения концентраций и составов газообразных, жидких и твердых растворов и их смесей
- •1.2. Показатели химико-технологического процесса
- •1.3. Примеры расчетов
- •Решение.
- •1.4. Задания
- •2. Материальный баланс химико-технологических процессов
- •2.1. Стехиометрический материальный баланс
- •2.2. Примеры составления стехиометрических балансов
- •2.3. Практический материальный баланс
- •Материальный баланс процесса получения фосфора из апатитовой руды
- •1 330 Кг
- •Часовой материальный баланс окисления аммиака
- •Материальный баланс производства сн3он
- •Материальный баланс производства сульфида натрия
- •Материальный баланс процесса кристаллизации СuSо4 5н2о
- •Материальный баланс процесса получения негашеной извести
- •2.5. Задания
- •3. Тепловой баланс химико-технологических процессов
- •3.1. Примеры расчета тепловых балансов
- •Тепловой баланс процесса газификации твердого топлива
- •3.2. Задания
- •Молярные массы некоторых элементов и веществ
- •Удельная теплоемкость с [кДж/(кг к)] газов и паров
- •Удельная теплоемкость с [кДж/(кг к)] жидкостей и водных растворов
- •Основные термодинамические константы некоторых неорганических веществ в стандартных условиях
- •Литература
- •Содержание
- •Общая химическая технология
- •220050. Минск, Свердлова, 13а.
- •220050. Минск, Свердлова, 13.
2.2. Примеры составления стехиометрических балансов
Пример 1.
Сожжено 100 м3 газовой смеси, содержащей 50 об. % пропана и 50 об. % бутана. Избыток воздуха по отношению к теоретически необходимому для сгорания составляет 20%. Составить материальный баланс процесса горения и рассчитать состав продуктов сгорания (об. %).
Решение.
При расчете принимаем, что воздух является смесью одного объема кислорода и 3,76 объема азота (т. е. молярное отношение О2:N2составляет 1 : 3,76). Объем 1 кмоль О2,N2при н. у. равен 22,4 м3.
Уравнения реакций горения имеют следующий вид:
С3Н8+ 5О2= 3СО2+ 4Н2О;
С4Н10+ 6,5О2= 4СО2+ 5Н2О.
Исходя из состава воздуха и с учетом его избытка при сжигании газовой смеси, запишем общее уравнение реакции, принимая во внимание, что молярное соотношение пропана и бутана в смеси такое же,
как объемное соотношение (т. е. 1 : 1):
воздух для воздух для избыток воздуха
сжигания пропана сжигания бутана
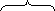
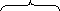
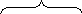
С3Н8+ 5О2+ 18,8N2+ С4Н10+ 6,5О2+24,4N2+ 0,2(11,5О2+ 43,2N2) =
= 7CО2+ 9Н2О + 43,2N2+ 2,3О2+ 8,7N2.
Данное уравнение можно записать в следующем виде:
С3Н8+ С4Н10 + 13,8О2+ 51,9N2= 7CО2+ 9Н2О + 2,3О2+ 51,9N2.
Результаты материального баланса представлены в табл. 1. Стехиометрические балансы могут быть представлены в виде уравнений, согласно которым можно рассчитать степень превращения реагентов и их концентрацию в данный момент времени (табл. 2).
Так, например, общий вид уравнения реакции
а А +b В + … + i I+j J +k K… =r R+s S, (31)
где стехиометрический коэффициент; абсолютное значение стехиометрического коэффициента (для исходных веществ< 0, для продуктов > 0).
Обозначим количество исходных веществ (в моль) перед началом реакции через na 0,nb 0, …,ni 0, …, а количество исходных веществ в данный момент реакцииna,nb, …,ni, … . Когда исходные реагенты берутся в стехиометрическом соотношении, степени превращения каждого из них одинаковы. Если же исходные реагенты вступают в реакции не в стехиометрическом соотношении, то значение степени превращенияхзависит от того, для какого вещества эта величина рассчитывается. Следовательно, так как соотношения количеств исходных реагентов могут быть нестехиометрическими, расчет будем вести по степени превращения одного, произвольно выбранного, исходного реагента, напримерK.
хk=![]() .
.
В соответствии со стехиометрическим уравнением (31), когда превращению подвергается 1 моль исходного вещества K, одновременно превращение претерпевает число молей исходного веществаI, равное
ni 0ni =![]() nk 0хk.
nk 0хk.
Мгновенное значение концентрации исходного вещества J(мольной долиNj) равно отношению числа молейJ, содержащихся в данный момент в системе, реагирующей согласно уравнению (31), к числу всех молей, находящихся в данный момент в системе (сумма в четвертой графе табл. 2):
Nj=
 .
(32)
.
(32)
В числителе и знаменателе выражения (32) написан знак «+», так как вместо i использованоi (для исходных веществi < 0).
Разделив
числитель и знаменатель правой части
уравнения (32) на сумму чисел молей
введенных исходных веществ
![]() (сумма
во втором столбце табл. 2) и приняв во
внимание, что
(сумма
во втором столбце табл. 2) и приняв во
внимание, что
Nj
0=
![]() илиNk
0=
илиNk
0=
![]() ,
,
получим зависимость молярной доли Njисходного веществаJот молярных долей компонентов исходной смеси:
Nj=
 .
(33)
.
(33)
Когда известен состав исходной смеси, можно с помощью выведенного уравнения быстро рассчитать концентрацию каждого исходного вещества, которая соответствует данной, отнесенной к одному из реагентов (K) степени превращенияхk.
Мольная доля Njравна объемной доле, если в реакции участвуют газы, свойства которых близки к свойствам идеального газа, следовательно, в этом случае уравнение (33) можно использовать и для расчета объема реагирующих газов.
Если известен состав смеси вводимых в реакцию исходных веществ и аналитически определена мольная доля одного из компонентов в некоторый момент времени, можно рассчитать для этого момента значение степени превращения, отнесенное к указанному компоненту. После преобразования уравнения (33) степень превращения хkбудет равна
хk=
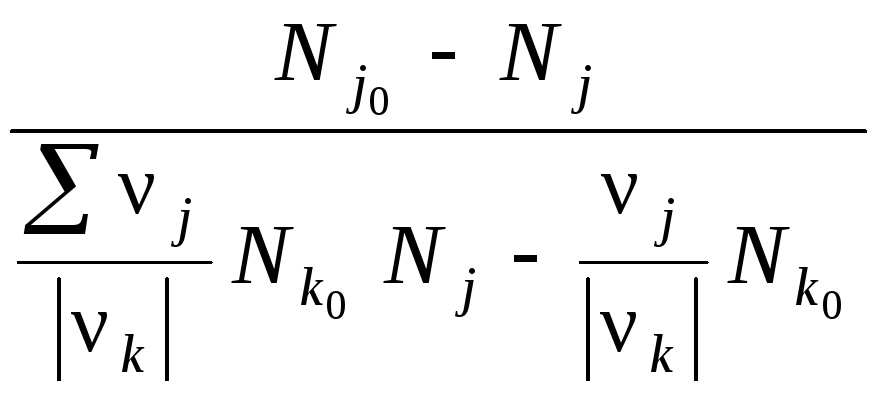 .
(34)
.
(34)
В случае одновременного протекания двух параллельных реакций, например
![]()
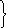 ,
,
![]() ,
,
аналогично уравнению (33) получается
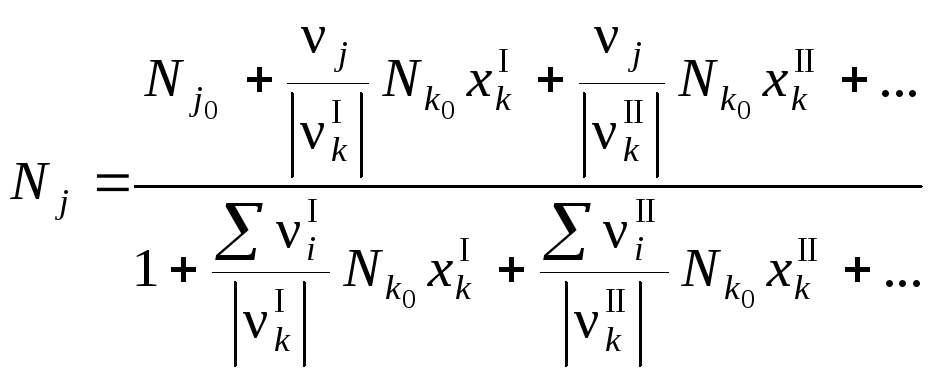 .
(35)
.
(35)
Пример 2.
В реакторе для окисления аммиака на катализаторе из платиновой сетки используется воздух, обогащенный кислородом.
Газовая смесь, поступающая на окисление, содержит (об. %): NH3 – 11,30; O2 – 23,14; N2 – 63; Н2О – 2,56. Реакция протекает в двух направлениях:
4NH3 + 5O2 = 4NO + 6H2O;
4NH3 + 3O2 = 2N2 + 6H2O.
Степени
превращения аммиака:
![]()
Рассчитать концентрацию кислорода в газах после реакции, приняв, что реагенты ведут себя как идеальный газ.
Решение.
Используем уравнение (35).
Исходным веществом K, для которого определяется степень превращения, будем считать аммиак. В качестве реагента J примем кислород. В соответствии со стехиометрическими уравнениями и условиями задания получаем:
 ;
;

![]() =
4
5 + 4 + 6 = 1;
=
4
5 + 4 + 6 = 1;
![]() =
4
3 + 2 + 6 = 1.
=
4
3 + 2 + 6 = 1.
Подставив эти значения в уравнение, имеем
N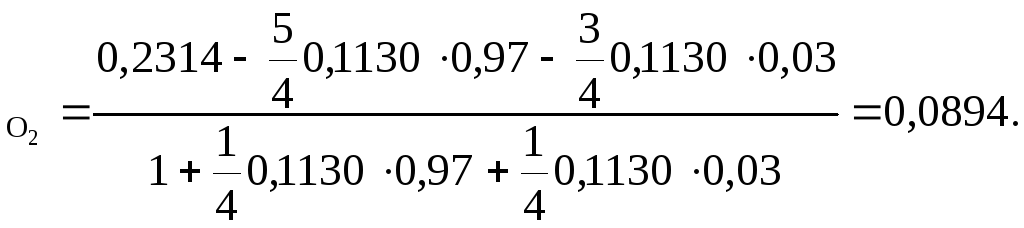
Газы после реакции будут содержать 8,94 об. % кислорода. Использование уравнения (35) дало возможность решить задачу значительно быстрее, чем при составлении полного стехиометрического баланса.
Пример 3.
В установке для производства серной кислоты контактным способом происходит реакция окисления
2SO2 + O2 2SO3.
Газ, подводимый к контактному реактору окисления оксида серы (IV), имеет состав (об. %): SO2 – 10; O2 – 11; N2 – 79. Газ, покидающий реактор, содержит 6,8 об. % О2. Рассчитать степень превращения оксида серы (IV) и концентрации SO3, SO2 и N2 в газах после реакции.
Решение.
Для вычисления значения степени превращения оксида серы (IV) используем уравнение (34).
Исходным веществом K будем считать SO2, за исходное вещество J примем О2. Имеем
![]()
![]()

Для
расчета концентраций SO3,
SO2
и N2
в газе после реакции используем уравнение
(33), помня, что
![]() :
:

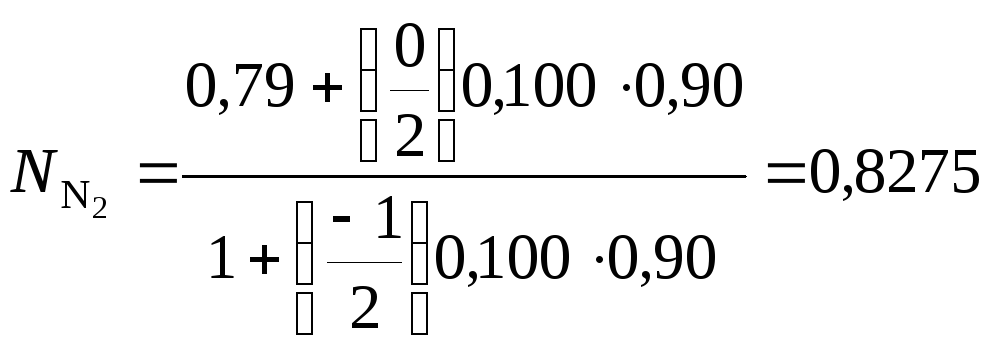
(второе
слагаемое в числителе равно нулю,
поскольку
![]() );
);
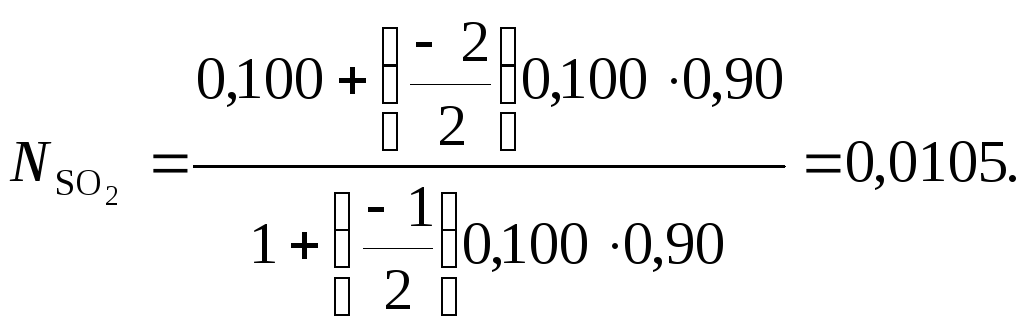
Степень
превращения оксида серы (IV)
![]() =
0,90. Концентрации SO3,
SO2
и N2
в газах после реакции, об. %: SO3
– 9,4; SO2
– 1,05; N2 –
82,75.
=
0,90. Концентрации SO3,
SO2
и N2
в газах после реакции, об. %: SO3
– 9,4; SO2
– 1,05; N2 –
82,75.
Ниже приведен пример более сложного расчета для системы, в которой протекает несколько параллельных обратимых реакций.
Пример 4.
Известны следующие значения константы равновесия Кр
|
Т, С |
50 |
100 |
150 |
|
Кр |
17,29 |
0,9042 |
0,0948 |
реакции получения хлористого изопропила из стехиометрической смеси пропилена и хлористого водорода по уравнению
СН3СН=СН2 + HCl СН3СНClСН3.
Общее давление Р = 1 атм.
Рассчитать
степень превращения пропилена ![]() =
x.
=
x.
Решение.
Принимаем, что в реакцию вступают 1 моль пропилена и 1 моль хлористого водорода. После установления равновесия будет (1 – x) моль пропилена, (1 – x) моль хлористого водорода и x моль хлористого изопропила. Всего
2 – 2x + x = 2 – x моль.
Парциальные давления реагентов
![]()
Константа равновесия
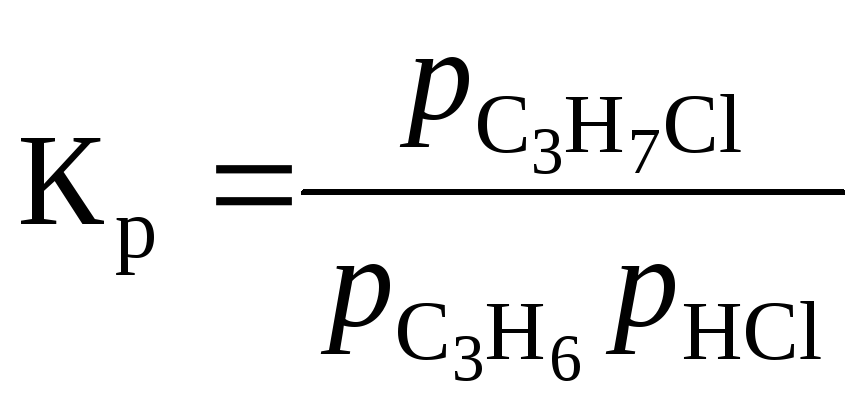
при Р = 1 атм равна
![]()
Решив это уравнение, имеем
![]()
(перед квадратным корнем знак «», так как x < 1). Рассчитываем значения x:
|
Т, С |
Кр |
Кр + 1 |
|
x |
Степень превращения, % |
|
50 |
17,29 |
18,29 |
4,275 |
0,766 |
76,6 |
|
100 |
0,9042 |
1,9042 |
1,380 |
0,275 |
27,5 |
|
150 |
0,0948 |
1,0948 |
1,046 |
0,045 |
4,5 |
