
- •Введение
- •Содержание отчета
- •Лабораторная работа № 1 Карбонизация аммиачно-солевого раствора
- •Литература.
- •Лабораторная работа № 2 Никелирование металлов
- •Литература.
- •Лабораторная работа № 3 Сухая перегонка древесины
- •Цель работы
- •Литература
- •Лабораторная работа № 4 Поликонденсация дихлорэтана и тетрасулфида натрия
- •Теоретические сведения
- •Литература.
- •Лабораторная работа № 5. Поликонденсация фенола с формальдегидом.
- •Теоретические сведения.
- •5.4 Методика выполнения работы.
- •5.5 Методика обработки экспериментальных данных
- •Литература.
- •Лабораторная работа» № 6 Ионообменное умягчение воды
- •Контрольные вопросы
- •Литература
- •Лабораторная работа» № 7 Определение влажности материалов
- •Литература
Литература.
Мухленов И,П. и др. Общая химическая технология, ч. 2. – М.: Высшая школа, 1984, с.213 – 222.
Мухленов И.П. и др. Практикум по общей химической технологии. - М.: Высшая школа, 1973, с.174 – 185.
Николаев А.Ф. Технология пластических масс. – Л.: Химия, 1977, с. 418 – 430.
Лабораторная работа» № 6 Ионообменное умягчение воды
Цель работы
Ознакомиться с процессом ионообменного умягчения воды, определить эффективность умягчения.
Теоретические сведения
Вода чрезвычайно широко используется в различных производствах химической промышленности. В ряде производств она является сырьем и реагентом, непосредственно участвующим в основных химических реакциях, например, в производстве водорода, серной и азотной кислот, щелочей, в реакциях гидратации и гидролиза. В некоторых производствах вода образуется в качестве побочного продукта, например, при пиролизе топлива, сжигании топлива, окислении аммиака и др. Во многих производствах вода используется в качестве растворителя. Во всех этих случаях вода применяется непосредственно для технологических целей.
В еще больших количествах вода используется как теплоноситель или хладоагент, т.е. для подогрева исходных реагентов, подвода или отвода тепла из химических реакторов, охлаждения продуктов реакций.
Вода является хорошим растворителем, поэтому природные воды обычно содержат различные примеси. Природные воды по происхождению делятся на три вида, сильно отличающиеся по содержанию примесей.
Атмосферная вода – вода, выпадающая на поверхность земли в виде атмосферных осадков, в основном в виде дождя и снега. Это наиболее чистая вода, содержащая в растворенном виде газы, присутствующие в воздухе: кислород, азот, углекислый газ. В промышленных районах атмосферная вода может содержать также газы промышленного происхождения, например, сероводород, оксиды азота, серы, а также органические соединения.
Поверхностные воды – воды рек, озер, морей и других природных водоемов. Кроме примесей, содержащихся в атмосферной воде, они содержат различные соли, главным образом сульфаты, хлориды, карбонаты щелочных и щелочноземельных металлов, а также органические соединения, которые являются продуктами жизнедеятельности живых организмов. Органические примеси часто придают воде желтоватую окраску.
Подземные воды – воды, образующиеся при просачивании атмосферных и поверхностных вод через водопроницаемые слои горных пород и скапливающиеся в подземных резервуарах. Они могут выходить на поверхность земли в виде источников, ключей или добываться из колодцев, артезианских скважин. Подземные воды характеризуются разнообразием состава растворенных солей, высокой прозрачностью и практически полным отсутствием органических примесей. Подземные воды с высокой концентрацией растворенных солей (так называемые минеральные воды) используются как сырье для химической промышленности, а также в лечебных целях.
Воды всех видов содержат также различные количества микроорганизмов.
На крупных химических предприятиях расход воды измеряется миллионами кубических метров в сутки, при этом каждое предприятие предъявляет свои требования к качеству воды, которое определяется наличием в ней растворенных, коллоидных и механических примесей.
Вредность примесей связана с их химическим составом, дисперсным состоянием, а также с технологией производства, использующего воду. Грубодисперсные механические взвеси засоряют трубопроводы и аппараты. Коллоидные примеси засоряют диафрагмы электролизеров, вызывают вспенивание воды и перебросы воды в котлах и аппаратах. Растворенные соли образуют накипь на теплообменных поверхностях, усиливают коррозию металлов.
В большинстве случаев основным качественным показателем является жесткость воды, обусловленная присутствием в воде растворенных солей кальция и магния. Жесткость воды подразделяется на временную и постоянную.
Временная (или карбонатная) жесткость обусловлена присутствием в воде гидрокарбонатов кальция и магния, которые при кипячении воды переходят в нерастворимые нормальные или основные карбонаты, выпадающие в осадок.
![]() ,
(6.1)
,
(6.1)
![]() .
(6.2)
.
(6.2)
Постоянная жесткость создается всеми другими растворимыми солями кальция и магния, чаще всего сульфатами и хлоридами, которые остаются при кипячении воды в растворенном состоянии.
Сумма временной и постоянной жесткости дает общую жесткость.
Жесткость воды выражается в миллиэквивалентах ионов кальция и магния, содержащихся в 1 дм3 воды (мэкв/дм3).
Принята следующая классификация природных вод по жесткости:
жесткость воды класс жесткости
0 – 1,5 очень мягкая
1,5 – 3 мягкая
3 – 6 умеренно жесткая
6 – 10 жесткая
>10 очень жесткая
Промышленная водоподготовка представляет собой комплекс операций, обеспечивающих очистку воды от механических, коллоидных и растворенных примесей.
От механических примесей вода освобождается отстаиванием или фильтрацией через слой песка или гравия. Удаление коллоидных примесей и осветление воды достигается коагуляцией при добавлении коагулянтов, например, сульфата алюминия или сульфата железа.
Умягчение воды, т.е. удаление из нее солей кальция и магния, осуществляется химическими и физико-химическими методами. Сущность химических методов заключается в добавлении к воде реагентов, переводящих ионы кальция и магния в нерастворимые соединения.
Известковый метод (добавление извести) используется для устранения временной жесткости.
![]() ,
(6.3)
,
(6.3)
![]() .
(6.4)
.
(6.4)
Содовый метод (добавление соды) используется для устранения постоянной жесткости.
![]() .
(6.5)
.
(6.5)
![]() .
(6.6)
.
(6.6)
Так как в воде обычно присутствует как временная, так и постоянная жесткость, то используется чаще всего сочетание этих методов. Известково-содовый метод однако позволяет производить лишь грубое умягчение воды примерно до 0,3 мэкв/дм3.
Более тонкую очистку (до 0,03 мэкв/дм3) обеспечивает фосфатный метод (добавление фосфата натрия). Это объясняется меньшей растворимостью фосфатов кальция и магния по сравнению с карбонатами.
![]() .
(6.7)
.
(6.7)
![]() .
(6.8)
.
(6.8)
Из физико-химических методов умягчения воды широко используется ионообменный метод.
Иониты – это твердые вещества, способные обменивать свои ионы на ионы, содержащиеся в воде. В зависимости от знака заряда обменивающихся ионов иониты делятся на катиониты и аниониты.
В
качестве катионитов могут использоваться
сульфоуголь или высокомолекулярные
смолы, содержащие активные группы с
ионами
![]() В основе катионного процесса умягчения
воды лежат реакции обмена ионов
В основе катионного процесса умягчения
воды лежат реакции обмена ионов![]() или
или![]() ,
входящих в состав катионита, на ионы
,
входящих в состав катионита, на ионы![]() или
или![]() ,
содержащиеся в воде.
,
содержащиеся в воде.
![]() (6.9)
(6.9)
![]() (6.10)
(6.10)
![]() (6.11)
(6.11)
![]() (6.12)
(6.12)
Таким же образом извлекаются из воды ионы других металлов.
В
качестве анионитов используются
высокомолекулярные смолы, содержащие
активные группы с ионами
![]() Пропуская через слой анионита воду,
предварительно освобожденную от
катионов, можно извлечь из нее анионы,
полностью обессоливая воду.
Пропуская через слой анионита воду,
предварительно освобожденную от
катионов, можно извлечь из нее анионы,
полностью обессоливая воду.
![]() (6.13)
(6.13)
![]() (6.14)
(6.14)
Реакции
ионного обмена обратимы и для восстановления
обменной способности ионитов проводится
процесс регенерации. Регенерация
![]() катионитов
осуществляется раствором
катионитов
осуществляется раствором![]() ,
а
,
а![]() катионитов
растворами кислот. Аниониты регенерируются
растворами щелочей, гидрокарбоната или
карбоната натрия.
катионитов
растворами кислот. Аниониты регенерируются
растворами щелочей, гидрокарбоната или
карбоната натрия.
Схема экспериментальной установки
Экспериментальная установка для ионообменного умягчения воды (рис. 6.1) состоит из стеклянной трубки (1) диаметром 2,5 – 3,5 см, в нижней части которой впаяна стеклянная перфорированная пластинка (2). Трубка заполняется катионитом (3) с таким расчетом, чтобы высота его слоя составляла 20 – 40 см. Внизу трубка заканчивается отводом с краном (4) для регулирования скорости протекания воды или раствора, которые подаются в верхнюю часть колонки через воронку (5). Жидкость, прошедшая через колонку, собирается в сборнике (6). Отдельные элементы установки крепятся на штативе (7).

Рис. 6.1 Схема установки для ионообменного умягчения воды
1 – стеклянная трубка,
2 – перфорированная пластинка,
3 – катионит,
4 – кран,
5 – воронка с краном,
6 – сборник воды,
7 – штатив.
Методика выполнения работы
Для
регенерации катионита и насыщения его
ионами
![]() через колонку пропускается 500 см3
раствора хлорида натрия с концентрацией
6 – 8 % (масс.). Скорость пропускания
раствора должна быть такой, чтобы время
прохождения раствора через катионит
составляло 25 – 30 мин. Затем катионит
промывается дистиллированной водой
для удаления хлорида натрия. Промывка
продолжается до полного исчезновения
ионов хлора из промывной воды (проба
раствором нитрата серебра). Обычно при
этом расходуется 700 – 1000 см3
дистиллированной воды.
через колонку пропускается 500 см3
раствора хлорида натрия с концентрацией
6 – 8 % (масс.). Скорость пропускания
раствора должна быть такой, чтобы время
прохождения раствора через катионит
составляло 25 – 30 мин. Затем катионит
промывается дистиллированной водой
для удаления хлорида натрия. Промывка
продолжается до полного исчезновения
ионов хлора из промывной воды (проба
раствором нитрата серебра). Обычно при
этом расходуется 700 – 1000 см3
дистиллированной воды.
После промывки катионита через колонку пропускается подлежащая умягчению вода в количестве 220 – 250 см3 в течение 30 – 40 минут. Скорость пропускания воды регулируется кранами (5) и (4 ). Исходная и умягченная вода анализируется на карбонатную и общую жесткость.
О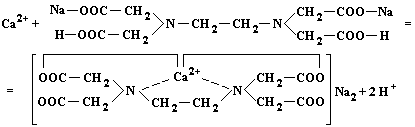 бщая
жесткость определяется комплексонометрическим
методом – титрованием раствором трилона
Б в присутствии индикатора хромогена
черного в аммиачной среде (рН = 9 – 10).
Этот метод основан на связывании ионов
кальция и магния с трилоном Б в комплексные
соединения.
бщая
жесткость определяется комплексонометрическим
методом – титрованием раствором трилона
Б в присутствии индикатора хромогена
черного в аммиачной среде (рН = 9 – 10).
Этот метод основан на связывании ионов
кальция и магния с трилоном Б в комплексные
соединения.
(6.15)
О конце реакции судят по изменению окраски индикатора хромогена черного от розового до синевато-серого. Появление синевато-серой окраски свидетельствует об отсутствии ионов кальция и магния в растворе, т.е. о полном связывании их трилоном Б.
Для выполнения анализа в коническую колбу емкостью 250 см3 вносят 100 см3 исследуемой воды, добавляют 5 см3 аммиачного буферного раствора, 6 – 7 капель раствора индикатора хромогена черного и титруют 0,1 н. раствором трилона Б до перехода розовой окраски в серовато-синюю.
Карбонатная жесткость определяется титрованием 0,1 н. раствором соляной кислоты в присутствии индикатора метилового оранжевого.
В коническую колбу емкостью 250 см3 вносят 100 см3 исследуемой воды, добавляют 4 – 5 капель раствора индикатора метилового оранжевого и титруют 0,1 н. раствором соляной кислоты до перехода желтой окраски в оранжевую.
Методика обработки экспериментальных данных
Общая жесткость воды определяется по формуле:
![]() (6.16)
(6.16)
где
![]() общая
жесткость воды (мэкв/дм3),
общая
жесткость воды (мэкв/дм3),
![]() объем
0,1 н. раствора трилона Б, израсходованного
на титрование пробы воды (см3),
объем
0,1 н. раствора трилона Б, израсходованного
на титрование пробы воды (см3),
![]() нормальность
раствора трилона Б (экв/дм3),
нормальность
раствора трилона Б (экв/дм3),
![]() объем
пробы исследуемой воды (см3).
объем
пробы исследуемой воды (см3).
Карбонатная жесткость воды определяется по формуле:
![]() (6.17)
(6.17)
где
![]() карбонатная
жесткость воды (мэкв/дм3),
карбонатная
жесткость воды (мэкв/дм3),
![]() объем
0,1 н. раствора соляной кислоты,
израсходованного на титрование пробы
воды (см3),
объем
0,1 н. раствора соляной кислоты,
израсходованного на титрование пробы
воды (см3),
![]() нормальность
раствора соляной кислоты (экв/дм3),
нормальность
раствора соляной кислоты (экв/дм3),
![]() объем
пробы исследуемой воды (см3).
объем
пробы исследуемой воды (см3).
Некарбонатная жесткость воды определяется по разности:
![]() (6.18)
(6.18)
По результатам анализа рассчитывается эффективность ионообменного умягчения воды, или степень умягчения, которая определяется по формуле:
![]()
![]() (6.19)
(6.19)
где
![]() степень
умягчения воды (в долях единицы),
степень
умягчения воды (в долях единицы),
![]() общая
жесткость умягченной воды (мэкв/дм3),
общая
жесткость умягченной воды (мэкв/дм3),
![]() общая
жесткость исходной воды (мэкв/дм3).
общая
жесткость исходной воды (мэкв/дм3).
Техника безопасности
Соблюдать осторожность при приготовлении растворов и работе с ними, избегать попадания химических реактивов и растворов на поверхность кожи.
