
- •Лекция 1 Биоорганическая химия (бох), ее значение в медицине
- •Органическая химия
- •Структурная изомерия
- •Пространственная изомерия (стереоизомерия)
- •Формулы Ньюмена
- •Конфигурационные изомеры
- •Лекция 2 Сопряженные системы
- •Ароматичность
- •Индуктивный эффект
- •Мезомерный эффект
- •Классификация органических реакций
- •Лекция 3 Кислотность и основность
- •Кислоты Бренстеда
- •Основания Бренстеда
- •Монофункциональные соединения Спирты
- •Физические св-ва
- •Химические св-ва
- •Карбокатион
- •Простой эфир
- •Бутен-2
- •Этилфосфат
- •Этаналь
- •Многоатомные спирты
- •Лекция 4 Фенолы
- •Химические свойства
- •Тиоспирты и тиоэфиры
- •Химические св-ва
- •Роль в организме
- •Номенклатура
- •Изомерия
- •Физические св-ва
- •Строение молекулы амина
- •Химические св-ва
- •Алкиламид
- •Замещенный имин
- •Лекция 5 Альдегиды и кетоны
- •Номенклатура
- •Изомерия
- •Физические св-ва
- •Химические свойства
- •Лекция 6 Карбоновые кислоты (кк)
- •Классификация
- •Номенклатура
- •Физические св-ва
- •Химические св-ва
- •Трихлоруксусная Хлороформ
- •Угольная к-та и ее производные
- •Мочевина
- •Химические св-ва
Изомерия
Для альдегидов характерна изомерия цепи, для кетонов – цепи и положения карбонильной группы.
Физические св-ва
Низшие альдегиды имеют резкий запах, растворимы в воде, высшие альдегиды имеют приятный запах (парфюмерия), не растворимы в воде, но растворимы в органических растворителях.
Строение
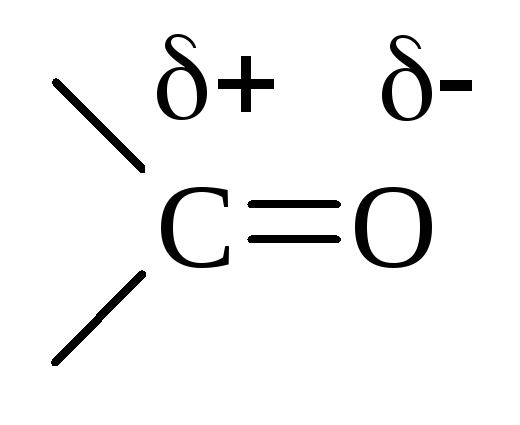
Двойная связь
![]() поляризована вследствии различной ЭО
атомов С и О и смещена к О. Поэтому атом
С карбонильной группы всегда имеет
избыточный+ заряд,
а О –-:
поляризована вследствии различной ЭО
атомов С и О и смещена к О. Поэтому атом
С карбонильной группы всегда имеет
избыточный+ заряд,
а О –-:
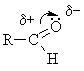
Характерными
р-циями для карбонильных соединений
являются р-ции нуклеофильного
присоединения АN.
При этом, чем больше величина +
на атоме С группы ![]() ,
тем выше реакционная способность
соединения в реакциях АN.
В кетонах +
заряд меньше (за счет +I),
чем в альдегидах, следовательно,
альдегиды более реакционноспособны.
,
тем выше реакционная способность
соединения в реакциях АN.
В кетонах +
заряд меньше (за счет +I),
чем в альдегидах, следовательно,
альдегиды более реакционноспособны.
![]()
(Для увеличения + заряда р-ции часто проводят в слабокислой среде).
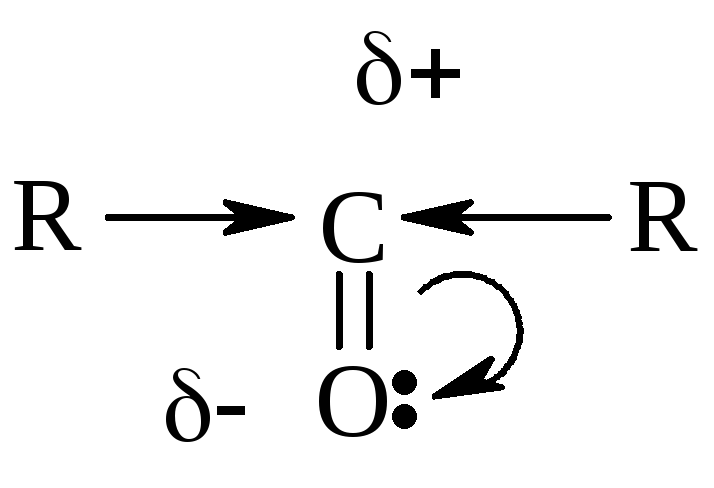
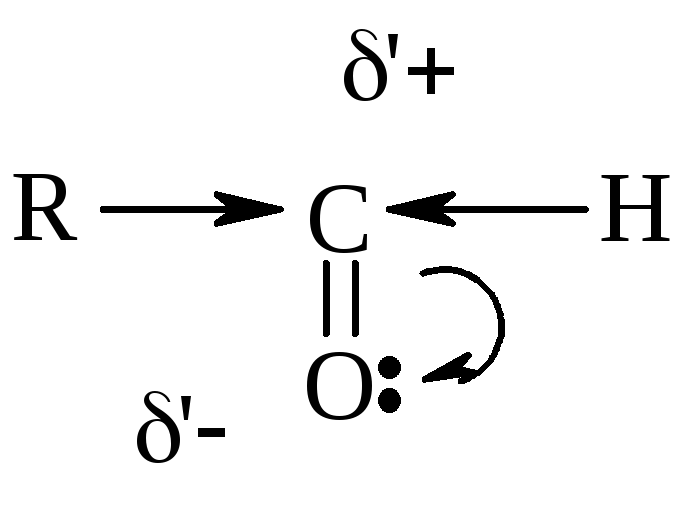
Смещение
-электронной
плотности в группе ![]() вызывает, в свою очередь, смещение
электронной плотности у соседних С –
С связей, что увеличивает подвижность
и реакционную способность атомов Н в
-положении
атома С.
вызывает, в свою очередь, смещение
электронной плотности у соседних С –
С связей, что увеличивает подвижность
и реакционную способность атомов Н в
-положении
атома С.
Химические свойства
Типы химических р-ций для альдегидов и кетонов:
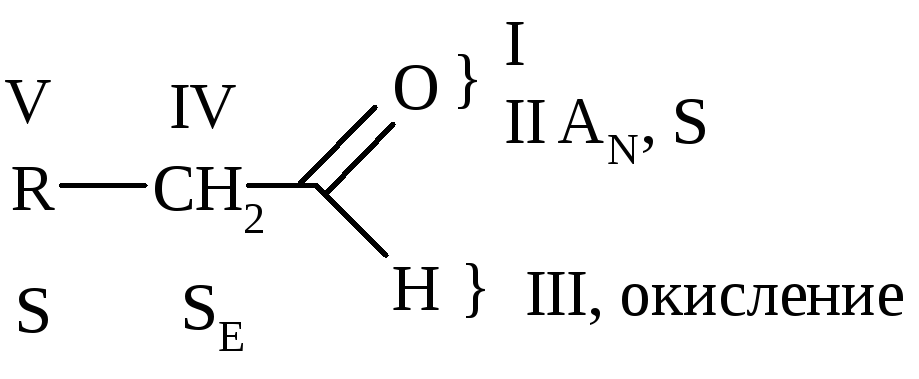
I. Р-ции АN [НОН (кроме кетонов), Н2, ROH, НСN, NaHSO3, Li[A1H4], НX].
II. Р-ции S(AN+E) 2ROH, H2N-X, PC15.
III. Р-ции окисления [Ag2O, Cu(OH)2] (Правило Попова – для кетонов).
IV. Р-ции по радикалу (р-ции с участием атома Н в -положении, р-ции дисмутации и полимеризации).
I. Р-ции АN
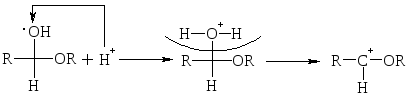
Общим для этих р-ций является наличие атома Н в реагенте. Если обозначить строение этих реагентов как Н – Х, тогда общую схему р-ции нуклеофильного присоединения можно записать так:
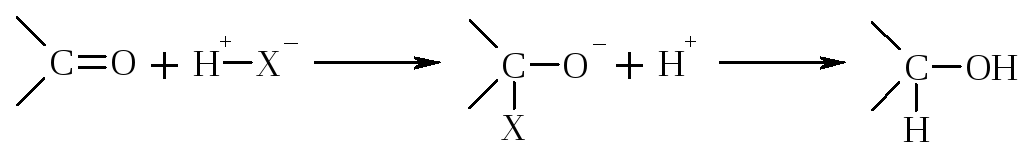
Если нуклеофил Nu – сильный реагент (LiH), то р-ция идет без катализатора, если – слабый, то в присутствии катализатора, чаще всего Н+, создающего целый «+» заряд на атоме С карбонила.
Реакционная способность карбонильных соединений в р-циях АN зависит: 1) от величины «+» заряда на атоме С карбонила; 2) пространственной доступности; 3) кислотности среды.
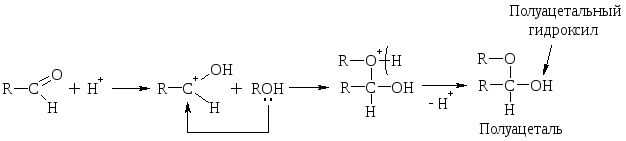
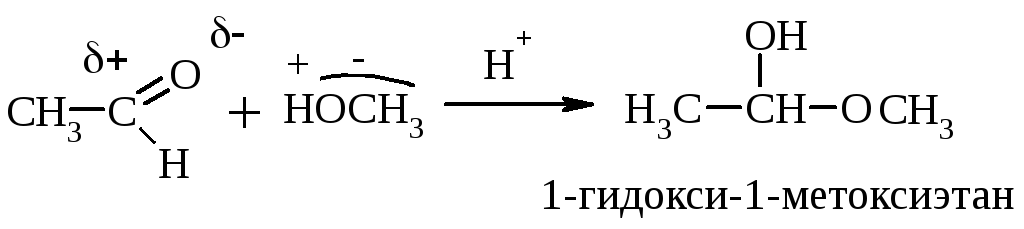
Полуацетали – это соединения, содержащие при одном атоме С гидроксильную (–ОН) и алкоксильную (–ОR) группы.
В гетерофункциональных соединениях, содержащих одновременно альдегидную и гидроксильную группы, возможно образование внутренних полуацеталей:
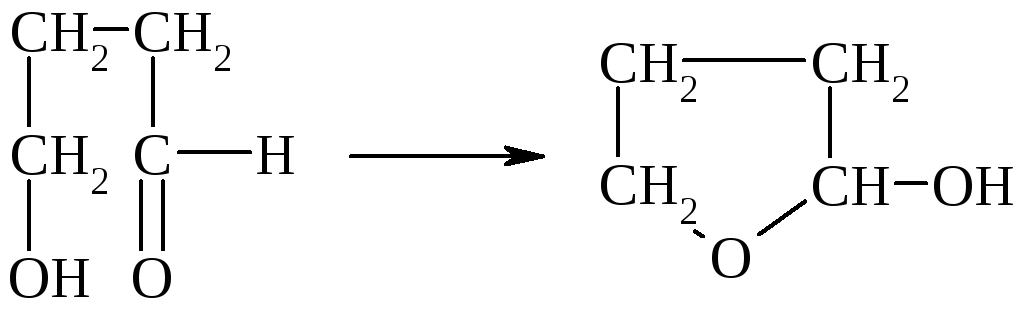
Моносахариды в клетке на 99,5% существуют в виде полуацеталей.
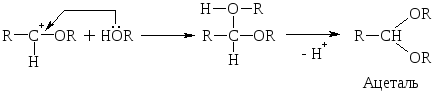
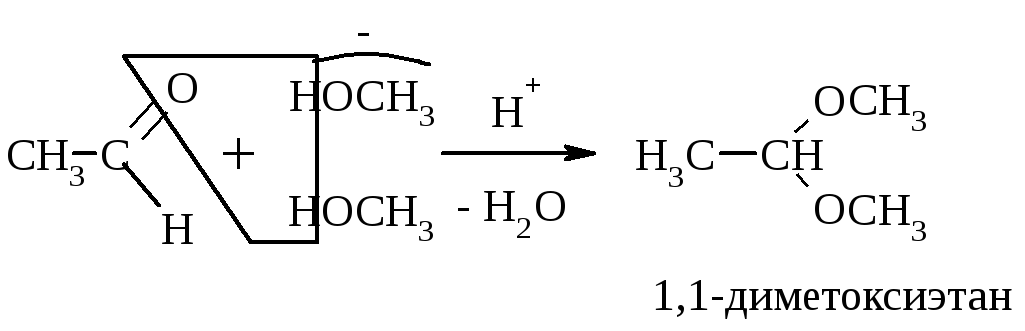
При избытке спирта образуется ацетали. Ацетали – это соединения, содержащие при одном атоме С две алкоксильных (–ОR) группы.
![]()
Конкретно эти р-ции можно записать так:
Р-ция с НСN протекает обычно в щелочной среде, т.к. НСN – слабая к-та и атом С не имеет неподеленной электронной пары. При действии щелочи образуется сильный нуклеофил – анион СN–.
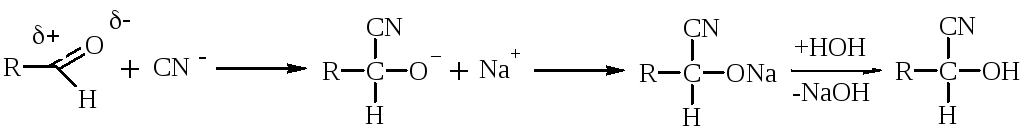
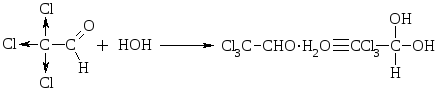
Альдегиды при взаимодействии с Н2О образуют нестойкие гидратные формы, т.к. + на атоме карбонильной группы невелик и Н2О – слабый Nu. Устойчивую гидратную форму образует трихлоруксусный альдегид за счет – I атомов С1, повышающего + на атоме С.
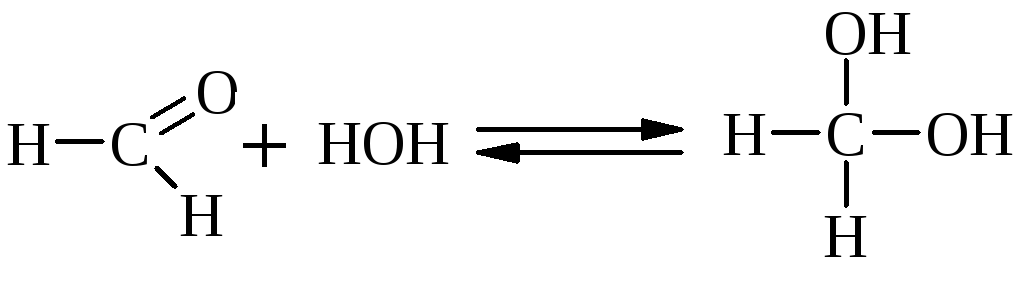
Кетоны не взаимодействуют c Н2О и не образуют полуацеталей. В более жестких условиях они образуют кетали с двумя молекулами спирта.
II.
Р-ции замещения кислорода в группе
![]() (АN+Е)
(АN+Е)
Реагентами
в этом случае могут быть соединения
аминного типа, содержащие группу –NН2.
В этих р-циях аналогично рассмотренному
выше идет р-ция АN,
а затем происходит отщепление молекулы
воды с образованием двойной связи ![]() :
:
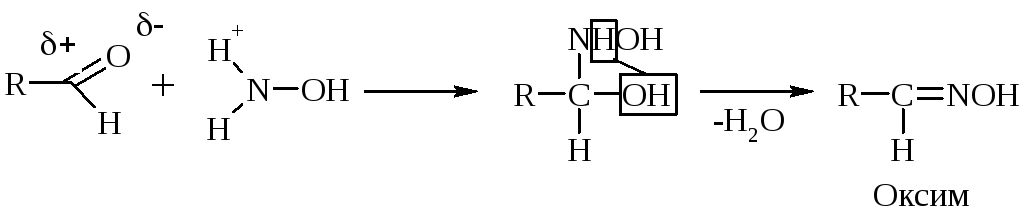
К аминным реагентам относятся: Н2N–ОН гидроксиламин образует оксим, Н2N–NН2 гидразин образует гидразон, Н2N–NН–С6Н5 фенилгидразин образует фенилгидразон, Н2N–R амин образует имин (основание Шиффа).
В общем виде:
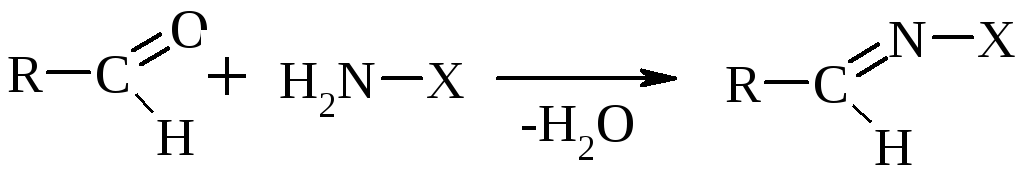
По такому же принципу протекает р-ция с РС15 и р-ция с двумя молекулами спирта.
III. Р-ции окисления
Альдегиды легко окисляются даже слабыми окислителями такими, как Аg2О и Сu(ОН)2. Эти р-ции используются как качественные р-ции. Кроме этого качественной р-цией на альдегиды является р-ция с фуксинсернистой к-той:
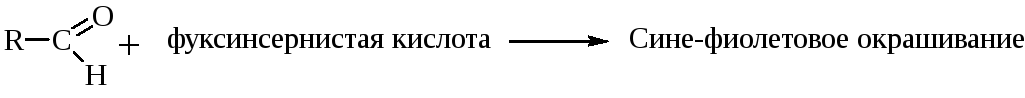
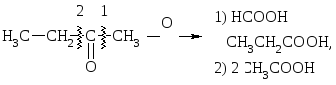
Кетоны окисляются только сильными окислителями. При этом образуется 2 – 4 карбоновые к-ты:
IV.
Наличие в молекуле альдегидов и кетонов
ЭА группы ![]() приводит к повышению реакционной
способности атомов Н в -положении
по отношению к группе
приводит к повышению реакционной
способности атомов Н в -положении
по отношению к группе ![]() .
Они довольно легко замещаются при
действии некоторых реагентов.
.
Они довольно легко замещаются при
действии некоторых реагентов.
Замещение на галоген:
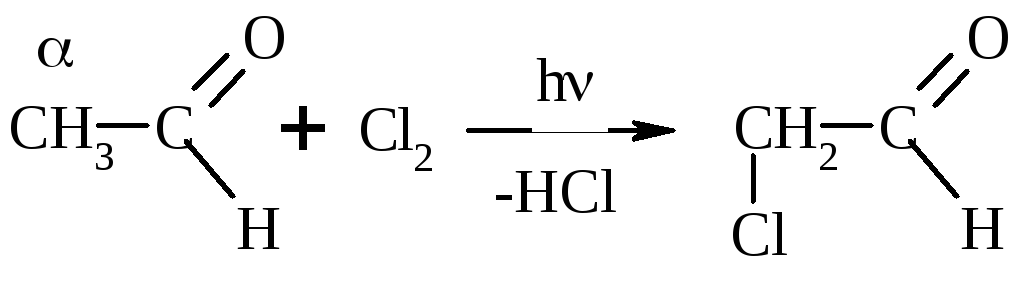
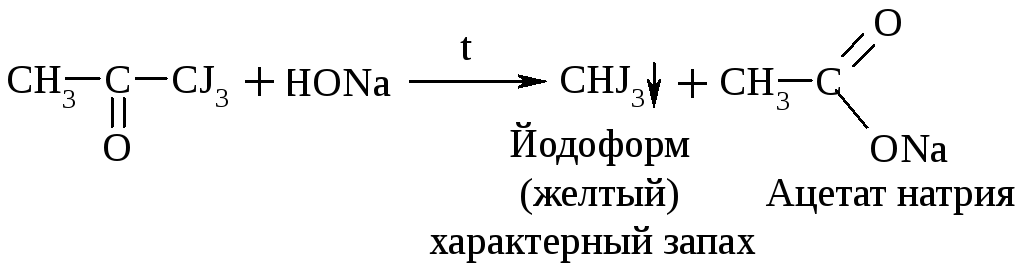
Галоформная р-ция
В щелочной среде при действии галогенов (I2, Cl2) альдегиды и кетоны, содержащие R = СН3, образуют йодоформ или хлороформ. Р-ция образования йодоформа используется в клинике для обнаружения ацетона в моче:
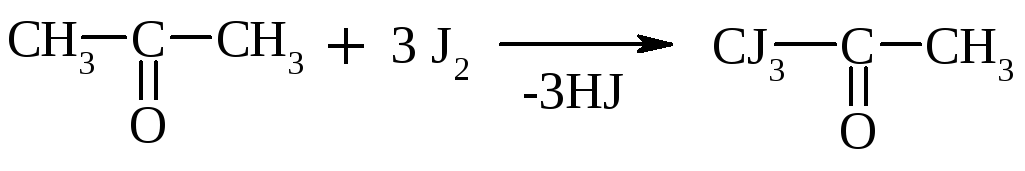
Ацетон Трийодацетон

Высокой подвижностью атомов Н в -положении объясняется также способность альдегиов вступать в р-цию альдольной конденсации:
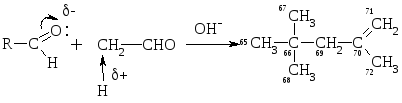
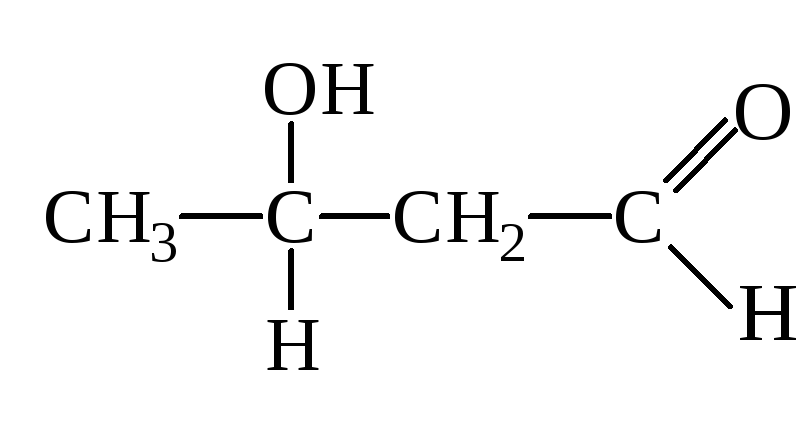 Альдоль
Альдоль
Впервые наблюдали эту р-цию А. Бородин (композитор, врач по образованию, 1872) и Ш. Вюрц.
Этим путем образуется в организме лимонная к-та, углеводы.
Механизм р-ции:
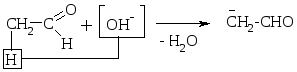
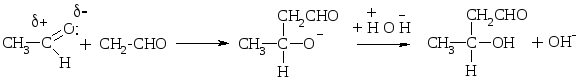
Если альдегид не имеет атома Н у -углеродного атома, то он в такую р-цию не вступает, но легко вступает в р-цию дисмутации (окисления - восстановления). Эта р-ция наз-ся еще р-цией диспропорционирования, или р-цией Канницарро-Тищенко:
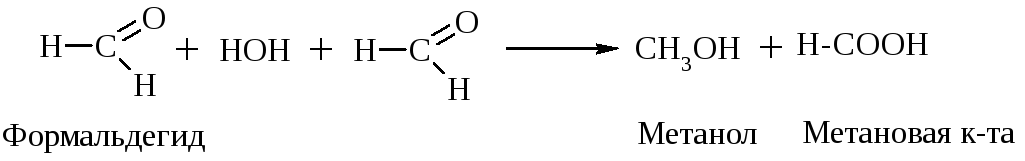
2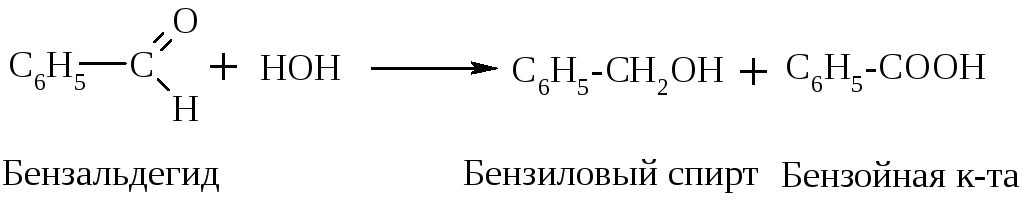
В связи с увеличением подвижности атомов Н в -положении по отношению к карбонильной группе для кетонов характерно также явление кето-енольной таутомерии. Таутомерия – это вид изомерии, происходящей путем перемещения атома Н в молекуле. Образующиеся изомеры находятся в динамическом равновесии и переходят друг в друга за счет внутримолекулярного перемещения атома Н. Этот вид изомерии наз-ся также прототропной:
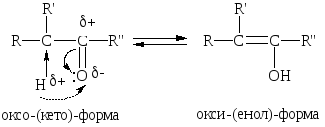
Обычно процент енольной формы невелик и соответсвует 10-5 – 10-6%. Увеличение цепи сопряжения, введение ЭА заместителей способствует увеличению содержания енольной формы. Так, в ацетилацетоне енольной формы больше, чем в самом ацетоне:
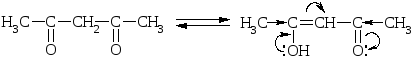
Сопряжения нет! Сопряжение есть!
Пентафторпропенол-2 существует преимущественно в енольной форме:
![]()
Замещение Н в енольном гидроксиле на алкилрадикал или ацил- – исключает превращение енола в кето-форму, т.к. не остается подвижного атома Н. На содержание енола оказывает влияние также температура, природа растворителя и др. факторы.
Р-ции, характерные для углеводородных радикалов (R), – SR, для непредельных R – АЕ, для ароматических R – SЕ.
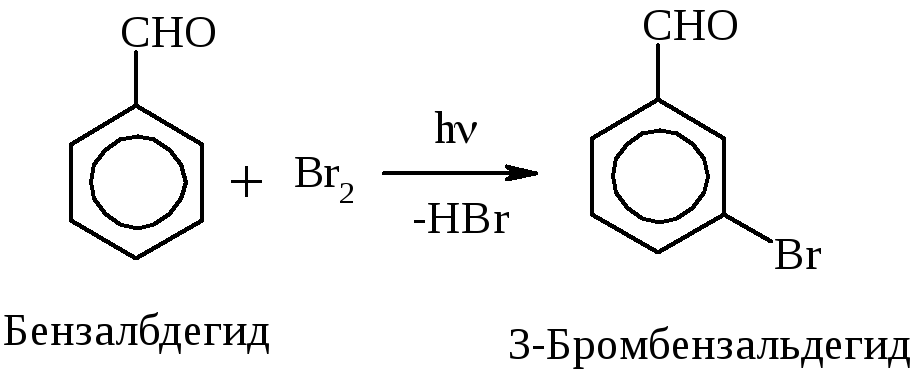
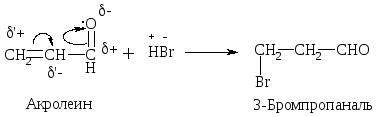
Присоединение НВr происходит против правила Марковникова.
Механизм:
-
1) образование -комплекса
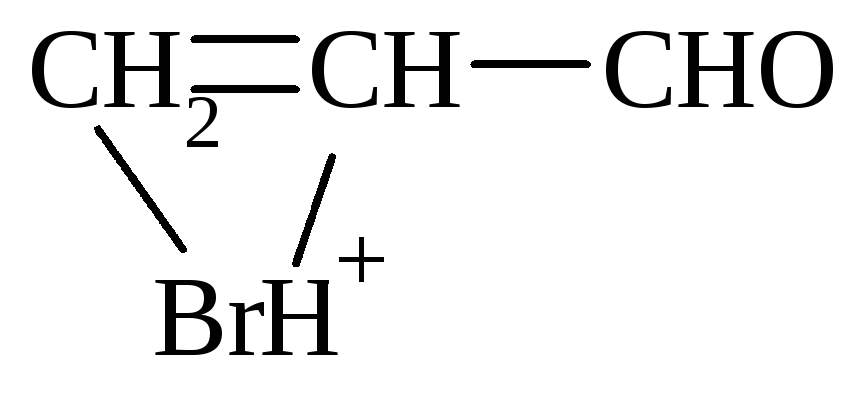
2) образование -комплекса
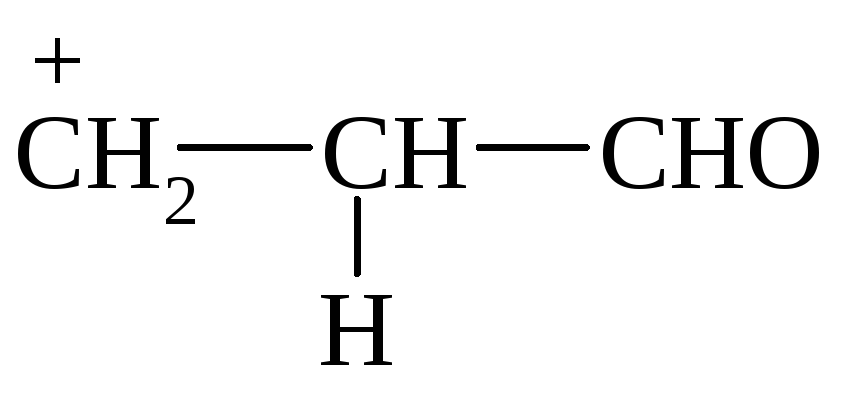
3) присоединение Вr
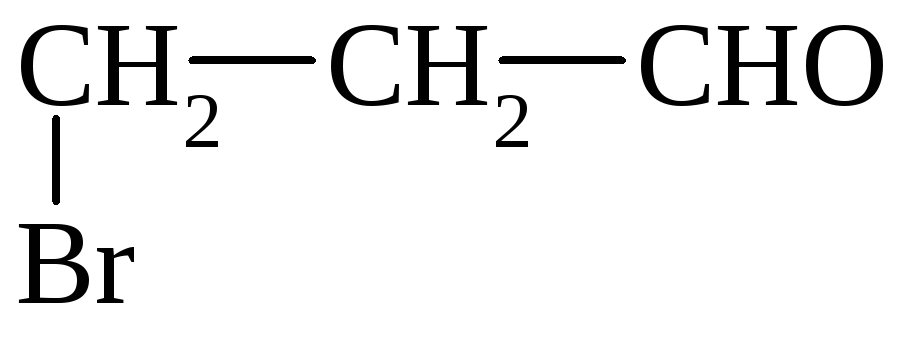
Р-ции уплотнения (полимеризации и поликонденсации)
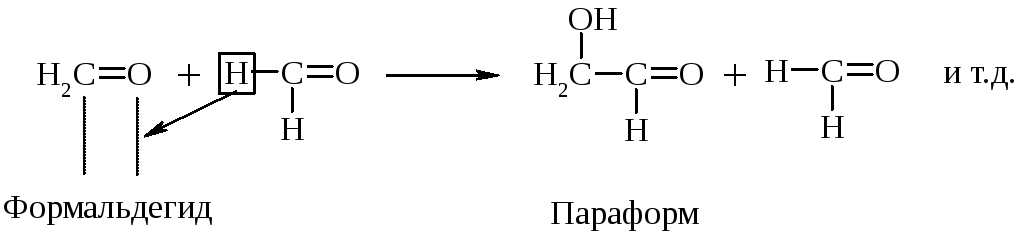
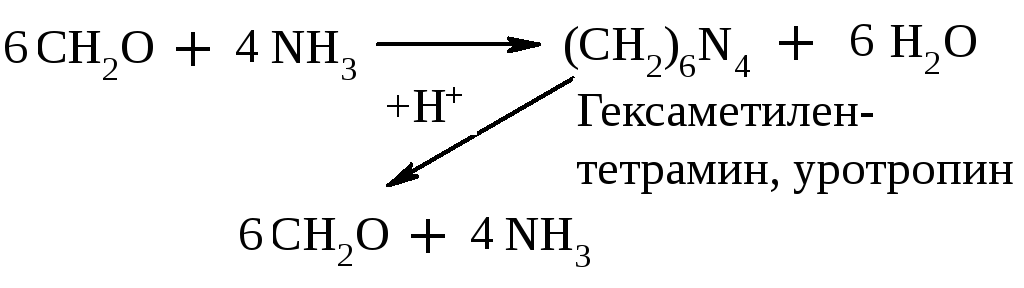
Уротропин – дезинфицирующее средство при воспалении мочевых путей. Его действие основано на способности в кислой среде за счет обратимости приведенной выше р-ции расщепляться с выделением формальдегида.
Смесь уротропина + СаС12 Кальцекс.
