
- •Государственное бюджетное образовательное учреждение высшего
- •Влияние температуры на скорость химической реакции
- •Теоретические представления о механизме химических реакций. Понятие о теории активных соударений.
- •Понятие о теории активированного комплекса (переходного состояния)
- •Катализ
- •Гомогенный катализ
- •Гетерогенный катализ
- •Ферментативный катализ
Ферментативный катализ
Ферментативными реакциями называются такие химические процессы в биологических системах, скорость которых регулируется веществами биологического происхождения. Это белковые молекулы, называемые ферментами или энзимами.
Ферментативный катализ играет огромную роль в жизнедеятельности организма. Широкое применение получили ферментные препараты при нарушениях функции желудочно-кишечного тракта, связанных с недостаточной выработкой пищеварительных ферментов (пепсин, панкреатин). При ожогах, гнойных ранах, гнойно-воспалительных заболеваниях легких, когда необходимо разрушить накопившиеся в большом количестве белковые образования, применяются протолитические ферменты, приводящие к быстрому гидролизу белков и способствующие рассасыванию гнойных скоплений. Для лечения инфекционных заболеваний используются препараты лизоцина, которые разрушают оболочку некоторых болезнетворных бактерий. Очень важные ферменты, которые рассасывают тромбы (сгустки крови внутри кровеносных сосудов) – плазмин, трипсин, химотрипсин, на их основе с разными добавками созданы различные лекарственные препараты – стрептокиназа, стрептаза, и т.п., широко применяемые в медицине.
Выделения ферментов в особый класс катализаторов обусловлен особыми свойствами этих веществ:
1) высокая специфичность;
2) эффективность действия;
3) биологические катализаторы образуются и разрушаются в процессе жизнедеятельности организма.
По своей каталитической активности биологические катализаторы в тысячи раз превышают неорганические. Специфичность действия связана с особенностями структуры фермента и субстрата. Одни части каталитической системы выполняют функции, главным образом связанные с пространственной организацией системы, другие в этой организационной системе осуществляют собственно катализ. Т.е., как и при неферментативном катализе, в каталитической реакции участвует не вся белковая молекула в целом, а лишь определенные ее участки – активные центры фермента.
Простейшая схема ферментативного катализа включает обратимое образование промежуточного комплекса фермента (Е) с реагирующим веществом (субстратом S) и разрушение этого комплекса с образованием продуктов реакции (Р):
![]() .
.
При условии, что k3>>k1 , с учетом уравнения материального баланса [E]=[E0]-[ES] (индекс «0» означает начальную концентрацию) получаем уравнение Михаэлиса-Ментен. В уравнении скорость образования продукта выражена через начальную концентрацию фермента и текущую концентрацию субстрата:
![]() ,
,
где wmax=k2[E0] – максимальная скорость реакции;
![]() -
это константа
Михаэлиса.
-
это константа
Михаэлиса.
Анализ уравнения Михаэлиса-Ментен
Константа Михаэлиса равна концентрации субстрата, при которой скорость реакции равна половине максимальной скорости. Она характеризует специфичность фермента по отношению к субстрату (чем меньше, тем специфичнее). Типичные значения KM от 10-6 до 10-1 моль/л.
Константу скорости k3 иногда называют числом оборотов фермента.
Число оборотов фермента - число молекул субстрата, которые превращаются на активном центре фермента в единицу времени (обычно от 10 до 108 мин-1).
Уравнение Михаэлса можно записать в линейных координатах:
![]() .
.
Для определения параметров уравнения KM и wmax проводят серию измерений начальной скорости реакции от начальной концентрации субстрата и представляют экспериментальные данные в координатах 1/w0 – 1/[S0].
Течение химических реакций может быть заторможено присутствием некоторых веществ. Ингибиторы ферментативного катализа, способны образовывать комплексы с ферментом или фермент-субстратным комплексом.
Приложение 3: Тренировочный тест
Какое уравнение позволяет математически точно описать влияние температуры на скорость химической реакции?
а) Аррениуса;
б) Гиббса;
в) Вант-Гоффа;
г) Ньютона.
Какие реакции называют сложными?
а) реакции, которые сложно понять;
б) реакции, протекающие в несколько стадий;
в) реакции, протекающие в одну стадию;
г) реакции, которые идут с малой скоростью.
Схема, описывающая метаболизм лекарства в организме в фармакокинетике.
а) моча→желудок→кровь
б) кровь→желудок→моча
в) желудок→кровь→моча
г) желудок→ моча
Что такое субстрат?
а) это продукт реакции;
б) это вещество, образующееся в промежуточных стадиях;
в) это вещество, вступающее в реакцию;
г) это вещество, вступающее в реакцию только при наличии химической индукции.
Что такое параллельные реакции? Схема их записи.
а) это сложные реакции, в которых продукт первой стадии вступает в реакцию второй стадии и т.д. до образования конечного продукта. А→В→С
б)
это сложные реакции, которые протекают
в прямом и обратном направлении с
соизмеримыми скоростями ![]()
в) это реакции, одна из которых вызывает протекание другой реакции, не осуществляемой в отсутствие первой
г)
это сложные реакции, в которых одно и
то же вещество участвует в нескольких
одновременно протекающих реакциях
![]() .
.
Ответы 1а, 2б, 3в, 4в, 5г
Приложение 4: Ситуационные задачи
Задачи на правило Вант-Гоффа
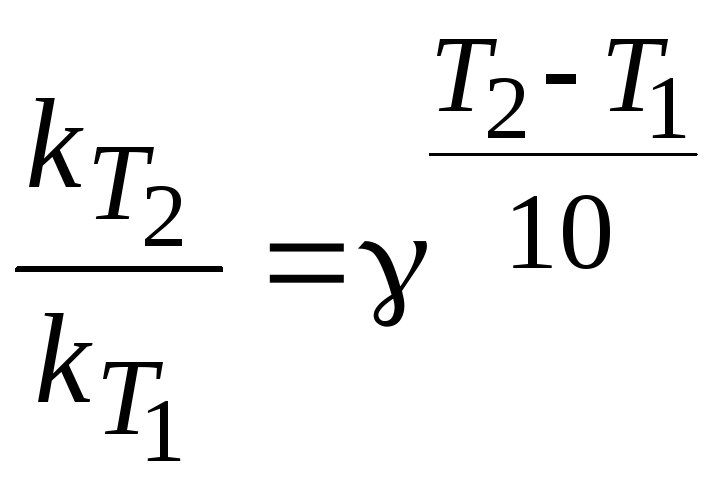
Задача №1.
С помощью правила Вант-Гоффа вычислить при какой температуре реакция закончится через 15 минут, если при температуре 293 К реакция идёт в течение 2 часов. Температурный коэффициент Вант-Гоффа реакции равен 3. Константа скорости обратно пропорциональна времени.
Ответ: 312 К.
Задача №2.
Температурный коэффициент реакции равен 3,5. Константа скорости kI при температуре ТI=15°С равна 0,2 с-1. Найти kII при температуре TII=40°С.
Ответ: 0,009 с-1.
Задачи на уравнение Аррениуса
![]() .
.
![]()
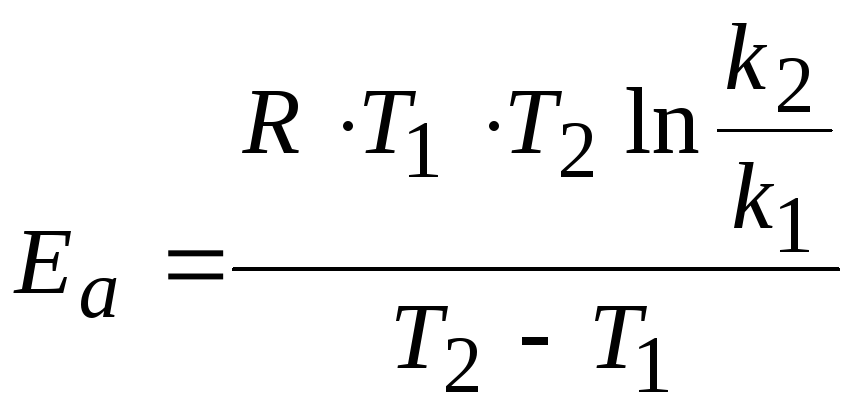 .
.
Задача №3.
Скорость бактериального гидролиза мышц рыб удваивается при переходе от Т1= -1,1°С до Т2= 2,2°С. Рассчитать энергию активации этой реакции.
Ответ: 130,6 кДж.
Задача №4.
Константа скорости гидролиза новокаина при Т=313 К равна 6,6∙10-7 с-1. Энергия активации этой реакции 55,2 кДж/моль. Сколько процентов новокаина разложится при Т=293 К за 10 дней?
Ответ: 12,5%.
Задача №5.
Срок годности лекарственного препарата при 40°С составляет 1 год. Определить срок годности при температуре 20°С, если предположить, что разложение является реакцией первого порядка, а температурный коэффициент Вант-Гоффа равен 2.
Ответ: 4 года.
Задача №6.
Для определения срока годности порошка папаверина гидрохлорида проведено исследование по методике «ускоренного старения» при температурах 50 и 80°С. Рассчитаны следующие константы: k50=0,52∙10-3сут-1 k80=1∙10-3сут -1. Определите срок годности порошка при температуре 20°С.
Ответ: 342,8 суток.
Задачи для решения на занятии.
1) Константа скорости гидролиза новокаина при 313 К равна 0,66 мин-1, энергия активации реакции равна 55,2 кДж/моль. Какая массовая доля (%) новокаина разложится за 10 дней хранения при 193К?
2)
Появление изотопа йода ![]() имеет место при авариях на АЭС. Период
его полураспада 8 суток. За какое время
этот изотоп распадается на 99% ?
имеет место при авариях на АЭС. Период
его полураспада 8 суток. За какое время
этот изотоп распадается на 99% ?
3) Во сколько раз увеличится скорость реакции взаимодействия водорода и кислорода 2H2 + O2 = 2H2O, если концентрации исходных веществ увеличить в два раза?
4) Константа скорости химической реакции при 200С равна 1 моль/(л∙сек). Вычислите константу скорости при 600С, если температурный коэффициент реакции равен 3. По размерности Константы скорости определить порядок реакции.
5) Константа скорости распада радиоактивного вещества составляет 0, 00507 (день)−1. Определите по размерности константы скорости, порядок химической реакции и, воспользовавшись соответствующим кинетическим уравнением, определите время (в днях), в течение которого вещество расходуется на 90%.
6) Во сколько раз увеличится скорость реакции при увеличении температуры на 250С, если γ = 3?
7) Вычислите по правилу Вант-Гоффа, во сколько раз увеличится скорость химической реакции при увеличении температуры на 200С, если γ = 2,8.
8) Константа скорости реакции при 300К равна 0,02, а при 350К равна 0,6. Определите энергию активации этой реакции?
9) Для реакции:
C5H5N + CH3I → [C5H5NCH3] I При 315К k = 0,035 (моль /л)−1 мин−1 При 323К k = 0,059 (моль /л)−1 мин−1 Вычислите энергию активации?
10) Константа скорости необратимой реакции 1-го порядка равна k = 2,06 ∙10−3 мин−1. Определите, сколько % исходного вещества разложится за 25 минут?
11) Для реакции разложения N2 O5 при разных температурах получены следующие данные: T0C 45 65 kI, с-1 4, 98 ∙10-4 4,87 ∙ 10-3 Рассчитайте величину kI при t = 500С.
12) Константа скорости реакции
При t1 = 9,40с k1 = 2,37;
При t2 = 14,40С k2 = 3,204. Рассчитайте температурный коэффициент скорости реакции.
13) Для необратимой реакции 2-го порядка: CH3COOC2H5 + CH3COONa + C2H5OH KII = 5,4 (моль/л)-1 * мин-1. Исходные концентрации эфира и щелочи одинаковы и равны 0,02 моль/л. Какова будет концентрация исходных веществ через 10 минут после начала опыта?
14) При хранении таблеток амидопирина было установлено, что при 80°С и 90°С константы скорости разложения соответственно равны 1,61∙10-6с-1, 4,2∙10-6с-1. Определите срок хранения таблеток (время разложения 10-ти % вещества) при 20°С.
15) Константа скорости химической реакции при 200С равна 1 моль/л∙сек. Вычислите константу скорости при 600С, если температурный коэффициент реакции равен 3. По размерности Константы скорости определить порядок реакции.
16) Для определения срока годности порошка папаверина гидрохлорида проведено исследование по методике «ускоренного старения» при температурах 50 и 80°С. Рассчитаны следующие константы: k50°С=5,2∙10-4 сут -1, k80°С. =1,0∙10-3 сут -1. Определите срок годности порошка при температуре 23°С.
17) Для реакции разложения N2O5 при разных температурах получены следующие данные:
T0C 45 65
kI, с-1 4, 98 ∙10-4 4,87 ∙ 10-3
Рассчитайте величину kI при t = 500С.
18) Константа скорости реакции при 300К равна 0,02, а при 350К равна 0,6. Определите энергию активации этой реакции?
19) Вычислите по правилу Вант-Гоффа, во сколько раз увеличится скорость химической реакции при увеличении температуры на 200С, если γ = 2,8.
20) Для реакции:
C5H5N + CH3I → [C5H5NCH3] I
При 315К k = 0,035 (моль /л)−1 мин−1
При 323К k = 0,059 (моль /л)−1 мин−1
Вычислите энергию активации?
21) Константа скорости реакции
при t1 = 9,40С k1 = 2,37;
при t2 = 14,40С k2 = 3,204.
Рассчитайте температурный коэффициент скорости реакции.
При температуре 0°С гранула железа растворяется в соляной кислоте за 20 минут. Если температурный коэффициент γ = 2, то такой же кусочек железа растворится при t=20°С за 5 минут.
Уравнение Аррениуса может быть записано в виде к=к0е-(Ea/RT).
