
- •Государственное бюджетное образовательное учреждение высшего
- •Влияние температуры на скорость химической реакции
- •Теоретические представления о механизме химических реакций. Понятие о теории активных соударений.
- •Понятие о теории активированного комплекса (переходного состояния)
- •Катализ
- •Гомогенный катализ
- •Гетерогенный катализ
- •Ферментативный катализ
Влияние температуры на скорость химической реакции
Скорость химической реакции увеличивается с повышением температуры. Приблизительно оценить влияние температуры на скорость реакции можно по правилу Вант-Гоффа:
при повышении температуры на каждые 10 градусов скорость реакции увеличивается в 24 раза.
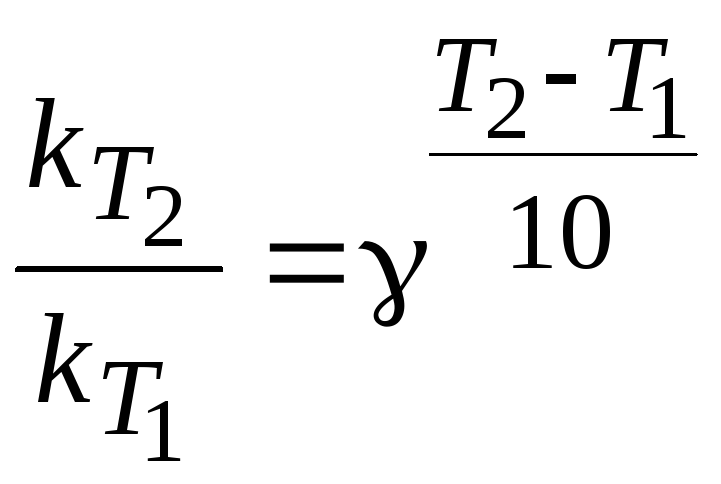 ,
,
где - температурный коэффициент Вант-Гоффа.
k (T1) и k (T2) – константы скорости реакции при температурах Т1 и Т2 .
Для биологических процессов важен определенный температурный интервал, вне которого процесс прекращается. В этом интервале увеличение температуры активизирует протекание жизненно важных процессов до оптимального, а последующее повышение температуры быстро снижает скорость процесса вплоть до прекращения жизнедеятельности организма. Это связано с необратимой тепловой денатурацией белков биологических тканей, а также с инактивацией ферментов (биологических катализаторов).
Более точно зависимость скорости реакции от температуры выражается уравнением Аррениуса. Уравнение Аррениуса в дифференциальной форме:
![]()
где kск константа скорости реакции
Т- температура
R – универсальная газовая постоянная: R=8,314 Дж/моль∙К
Е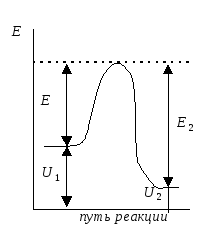 а
- энергия активации.
а
- энергия активации.
Энергия активации - та избыточная энергия (по сравнению со средней энергией молекул), которой должны обладать сталкивающиеся молекулы, чтобы быть способными к химической реакции (рис.)
Рис.
Энергетический профиль реакции. Е1
и Е2
энергии активации прямой и обратной
реакций.
ΔU=U2
– U1
- тепловой эффект реакции.
Активация вызывается повышением температуры, действием электрического поля, действием квантов света и т.д. Энергия активации Еа постоянна в данном температурном интервале и определяется механизмом реакции. Её можно определить графически по уравнению Аррениуса в линейной форме.
ln
k=![]() или к=к0е-(Ea/RT).
или к=к0е-(Ea/RT).
где k0 – предэкспоненциальный множитель.
В
координатах ln
k
– 1/T
данное уравнение представляет собой
прямую линию с угловым коэффициентом,
равным
![]()
Определенный интеграл в интервале температур Т1 Т2 даёт следующее выражение:
![]() .
.
Это уравнение дает возможность, зная энергию активации и константу скорости при одной температуре, определить константу скорости при другой температуре. Или же, зная величины констант скоростей при двух температурах, можно рассчитать значение энергии активации.
![]()
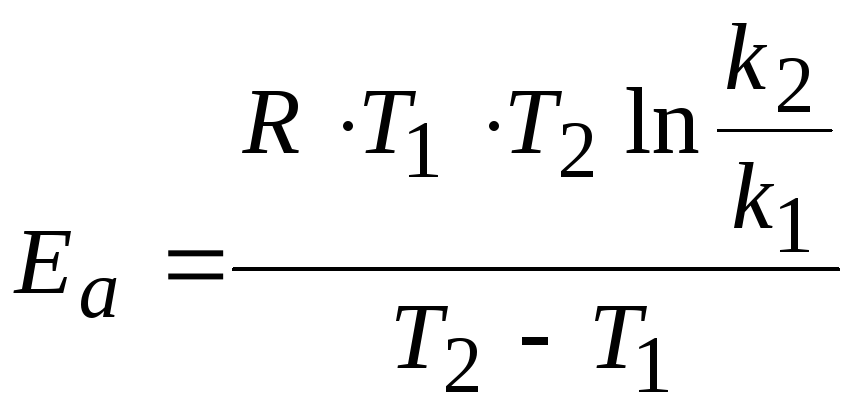 .
.
Теоретические представления о механизме химических реакций. Понятие о теории активных соударений.
Для того чтобы произошла химическая реакция, необходимо, чтобы частицы столкнулись. Скорость реакции пропорциональна общему числу двойных столкновений в единицу времени в единице объема
w=qzобщ,
где q – коэффициент пропорциональности.
В теории соударений используются следующие допущения:
Частицы бесструктурны – это шары с радиусом r;
В момент соударения молекулы ведут себя как упругие шары. Т.е. суммарная энергия молекул до и после соударения остается постоянной, но может перераспределяться между молекулами.
Реагируют только молекулы, которые обладают энергией активации.
Число двойных активных столкновений определяется соотношением:
![]() ,
,
где zобщ – общее число столкновений,
zакт – число активных столкновений,
![]() - доля активных
столкновений, равная множителю Больцмана
- доля активных
столкновений, равная множителю Больцмана
![]() .
Он тем меньше, чем больше энергия
активации.
.
Он тем меньше, чем больше энергия
активации.
Процесс превращения исходных веществ в продукты происходит мгновенно в момент соударения активных молекул.
Скорость реакции А+В=С определяется выражением
![]() ,
,
где Р – стерический фактор.
Он определяется опытным путем из соотношения опытной и теоретической скорости. Р<1.
Роль стерического фактора:
Стерический фактор
характеризует вероятность реакции
между молекулами, энергия которых
![]() и
учитывает необходимость определенной
ориентации реакционноспособных молекул
в момент столкновения.
и
учитывает необходимость определенной
ориентации реакционноспособных молекул
в момент столкновения.
Сравнивая два выражения для скорости реакции, получаем уравнение:
![]() ,
,
совпадающее с уравнением Аррениуса
![]() ,
,
откуда предэкспоненциальный множитель А=Рz0.
Общее число всех двойных соударений в секунду в единице объема равно:
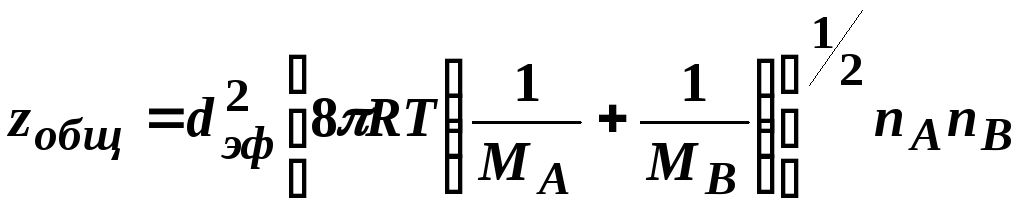
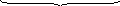 ,
,
z0
где: МА и МВ – молярные массы веществ А и В,
dэф.- эффективный диаметр столкновений, равный в общем случае rA+rB;
при межмолекулярном отталкивании dэф< rA+rB;
при межмолекулярном притяжении dэф> rA+rB.
По теории соударений можно рассчитать константу скорости реакции k, зная размеры и молекулярные массы частиц.
Недостатки теории активных соударений.
бесструктурность частиц – они рассматриваются как шары
элементарный акт рассматривается как мгновенный, в действительности это сложный процесс перераспределения связей, требующий определенного времени.
Теория активных соударений объясняет много разнообразных факторов, но не объясняет влияния на скорость реакции растворителя, давления, добавок инертных газов, не позволяет сделать теоретическую оценку стерического фактора.
