
- •Комплексные соединения
- •Основные положения и понятия координационной теории.
- •Классификация и номенклатура комплексных соединений.
- •Комплексообразующая способность s-, р- и d- элементов
- •Характер химической связи в комплексных соединениях.
- •Внешнеорбитальные и внутриорбитальные комплексы
- •Устойчивость комплексных соединений в растворах
Внешнеорбитальные и внутриорбитальные комплексы
Для катионов d- элементов характерны октаэдрические комплексы. При их образовании возможны два типа гибридизации: d2sр3 и sр3d2, в зависимости от того, какие d-орбитали комплексообразователя доступны для лиганд.
Гибридизация d2sр3 осуществляется в том случае, если в образовании σ связей участвуют s и р орбитали внешнего уровня и две d-орбитали предпоследнего уровня. Этот вид гибридизации называется внутренней гибридизацией, а образующиеся комплексы внутриорбитальными.
Например: [Cr(NH3)6]3+
Cr3+
![]()
![]() гибридизирующиеся
орбитали
гибридизирующиеся
орбитали
[Cr(NH3)6]3+
![]()
![]() электронные
пары от лигандов
электронные
пары от лигандов
При внутренней гибридизации лиганды прочно связаны с комплексообразователем, поэтому внутриорбитальные комплексы отличаются высокой устойчивостью.
Если на образование σ-связей комплексообразователь поставляет только орбитали внешнего внешнего уровня, то осуществляется sр3d2 гибридизация. Её называют внешней, а образующиеся комплексы внешнеорбитальными. Такие комплексы образуют d-элементы с полностью заселёнными d подуровнями. Например: [Cd(Cl)6]4-
Cd2+![]()
![]() гибридизирующиеся
орбитали
гибридизирующиеся
орбитали
[Cu(Cl)6]4-
![]()
![]() электронные
пары от лигандов
электронные
пары от лигандов
Энергия связей, образованных при внешней гибридизации орбиталей комплексообразователя ниже, чем при внутренней гибридизации, поэтому внешнеорбитальные комплексы обладают меньшей прочностью по сравнению с внутриорбитальными.
Если у катиона d- элемента d подуровень заселен неспаренными электронами, то тип гибридизации определяется природой лиганда. Лиганды, обладающие достаточной электронодонорной способностью, могут «вытеснить» электроны с двух орбиталей d подуровня и заставить их спариться на остальных двух орбиталях. При этом нарушается правило Гунда. Такой способностью обладают, например:
цианид-ионы, поэтому они образуют внутриорбитальные комплексы. Например: [Fe(CN)6]4-:
Fe2+![]()
[Fe(CN)6]4-
![]()
Если же лиганд не обладает достаточной электронодонорной способностью, то образуется внешнеорбитальный комплекс, например: [Fe(Н2О)6]2+
[Fe(Н2О)6]2+
![]()
Число неспаренных электронов в процессе комплексообразования в этом случае не меняется.
Устойчивость комплексных соединений в растворах
Ионы внешней сферы соединены с комплексом ионной связью, поэтому в водных растворах они легко отщепляются: [Fe(Н2О)6]SO4 ↔ SO42- + [Fe(Н2О)6]2+.
Этот процесс называется первичной диссоциацией. Внутренняя сфера в зависимости от прочности также способна диссоциировать на комплексообразователь и лиганды:
[Fe(Н2О)6]2+
↔ Fe2+
+ 6 Н2О
– это вторичная
диссоциация.
Она аналогична диссоциации слабых
электролитов и характеризуется константой
равновесия: Крав.
=

константа равновесия может служить мерой прочности комплекса: чем менее стоек комплекс, тем больше концентрация простых ионов или молекул Fe2+ и Н2О, тем больше численное значение константы. Поэтому константу равновесия,
называют константой нестойкости комплекса. Величина, обратная константе нестойкости, называется константой устойчивости:
Куст.=
![]() =
=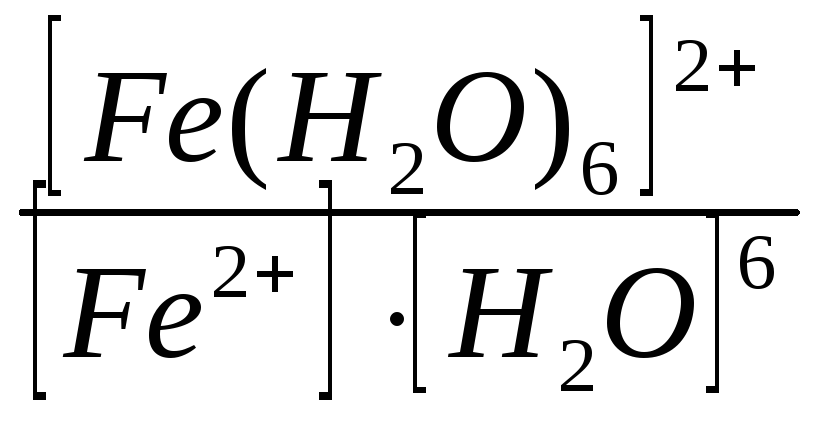 .
.
