
- •Министерство сельского хозяйства Российской Федерации
- •Введение.
- •Лекция 1 механика
- •1.1 Предмет физики.
- •1.2. Основные математические понятия
- •Приращение функции – изменение функции.
- •Градиент функции.
- •Международная система единиц «си»
- •1.3. Основы теории погрешности
- •1.4. Кинематика. Основные параметры простейших видов движения
- •Характеристики колебательного движения
- •Вопросы для самоконтроля
- •Список литературы Основная
- •Лекция 2 динамика
- •1.1.Основные динамические характеристики
- •Физическая природа сил.
- •1.2.Основные законы динамики.
- •Закон сохранения импульса
- •Закон изменения импульса
- •Работа. Мощность. Энергия.
- •Закон сохранения энергии (для изолированной системы).
- •Закон сохранения энергии (для неизолированной системы).
- •1.3. Динамика вращательного движения.
- •Энергия вращательного движения.
- •Основной закон динамики вращательного движения.
- •1.4.Динамика колебательного движения.
- •Полная энергия гармонических колебаний.
- •Вопросы для самоконтроля.
- •Список литературы Основная
- •Лекция 3 гидростатика. Гидродинамика
- •1.1.Основные законы гидростатики
- •1.2. Основные понятия и законы гидродинамики.
- •Закон Ньютона для внутреннего трения.
- •Закон Стокса.
- •Закон Пуазейля.
- •Принцип аэрации почвы.
- •Поверхностное натяжение.
- •1.2. Жидкость в капиллярах.
- •Вопросы для самоконтроля
- •Основные уравнения мкт.
- •1.3. Основные процессы и понятия.
- •Экспериментальные газовые законы.
- •Понятие идеального газа .
- •Изотермы Ван-дер-Ваальса
- •Вопросы для самоконтроля
- •Список литературы Основная
- •Лекция 6
- •1.4.Уравнение переноса в общем виде.
- •Лекция 7 термодинамика
- •1.1.Понятие числа степеней свободы
- •1.2.Основные понятия термодинамики
- •1.3.Основные законы термодинамики
- •Вопросы для самоконтроля
- •Список литературы Основная
- •Лекция 8 работа при термодинамических процессах
- •1.1.Работа при термодинамических процессах.
- •Работа при изотермическом процессе.
- •Работа при изобарическом процессе.
- •Работа при адиабатическом процессе.
- •1.2.Тепловая машина. Цикл Карно
- •Свойства энтропии.
- •Вопросы для самоконтроля.
- •Список литературы Основная
- •Лекция 9
- •Теорема Остроградского – Гаусса.
- •Принцип суперпозиции.
- •1.2.Работа электрического поля. Потенциал электрического поля.
- •Связь напряженности и потенциала.
- •Теорема Ирншоу.
- •1.3.Проводники и диэлектрики в электрическом поле.
- •Диэлектрики в электрическом поле.
- •1.4.Электрическая емкость. Конденсатор.
- •Вопросы для самоконтроля
- •Список литературы Основная
- •Лекция 10 электрический ток
- •1.1.Понятие электрического тока и условия его существования.
- •1.2.Параметры электрического тока.
- •1.3.Основные законы Закон Ома для участка цепи.
- •Закон Ома в дифференциальной форме.
- •Закон Ома для замкнутой цепи.
- •Вопросы для самоконтроля
- •Список литературы Основная
- •Лекция 11 электрический ток в различных средах
- •Электрический ток в электролитах
- •1.2.Электрический ток в полупроводниках. Полупроводниковые приборы.
- •Полупроводниковый диод p-n переход.
- •Полупроводниковый триод
- •1.3.Электрический ток в газах.
- •Вольт-амперная характеристика газового разряда.
- •1.4. Термоэлектронная эмиссия. Электровакуумные приборы.
- •Полупроводниковый триод.
- •Вопросы для самоконтроля
- •Список литературы Основная
- •Лекция 12 магнетизм
- •1.1.Параметры магнитного поля.
- •1.2.Основные формулы и законы.
- •Закон Ампера.
- •1.3. Действие магнитного поля на проводник с током.
- •1.4 Виды магнетиков. Гистерезис.
- •Вопросы для самоконтроля.
- •Список литературы Основная
- •Лекция 13
- •1.3.Явление взаимной индукции и самоиндукции.
- •Вопросы для самоконтроля
- •Список литературы Основная
- •Лекция 14
- •1.2.Резонанс в цепи переменного тока.
- •1.3.Колебательный контур
- •1.4.Электромагнитные волны
- •Вопросы для самоконтроля
- •Список литературы Основная
- •Лекция 15 геометрическая и волновая оптика
- •1.1. Природа света.
- •1.2.Геометрическая оптика.
- •Закон отражения.
- •1.3.Элементы волновой оптики Дисперсия
- •Интерференция свойства света.
- •Дифракция.
- •Условия интерфракционного максимума и минимума.
- •Поляризация.
- •Основные фотометрические характеристики.
- •Вопросы для самоконтроля
- •Список литературы Основная
- •Лекция 16 квантовая оптика
- •1.1.Фотоэффект и законы внешнего фотоэффекта
- •1.2.Люминесценция
- •Правило Стокса.
- •1.3.Световое давление
- •1.4. Излучение и поглощение света вещества.
- •1.5.Законы излучения абсолютно черного тела.
- •Вопросы для самоконтроля
- •Список литературы Основная
- •Лекция 17 основы ядерной физики
- •1.1.Строение ядра атома
- •1.2.Виды радиоактивного излучения
- •1.3.Энергия связи. Дефект массы атомного ядра.
- •1.4.Виды ядерных реакций
- •Применение ядерной энергии.
- •Вопросы для самоконтроля
- •Список литературы Основная
- •Содержание
Экспериментальные газовые законы.
З акон
Бойля-Мариотта
(изотермический процесс, T=const)
акон
Бойля-Мариотта
(изотермический процесс, T=const)
При постоянной T давление изменяется
обратно пропорционально объему
![]()
рис.22
Закон Гей-Люссака (изобарический процесс, P=const)
При увеличении температуры, скорость молекул
 увеличивается
и они разлетаются на большие расстояния
увеличивается
и они разлетаются на большие расстояния
![]()
рис.23
При постоянном давлении объем газа изменяется линейно с температурой.
Закон Шарля (изохорический процесс, V=const)
П ри
увеличении температуры молекулы сильнее
ри
увеличении температуры молекулы сильнее
ударяются о стенки сосуда.
![]()
рис.24
Молекулы газа движутся с различными скоростями.
Получим среднюю квадратическую скорость молекул
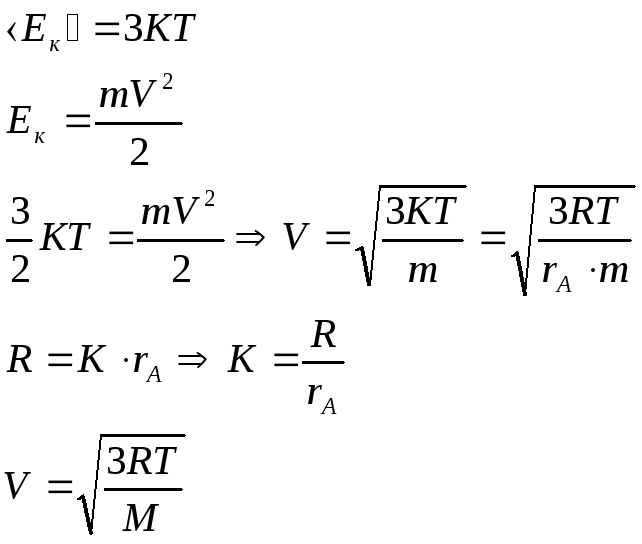
Средняя квадратическая скорость поступательного движения молекул пропорциональна корню квадратному из термодинамической температуры.
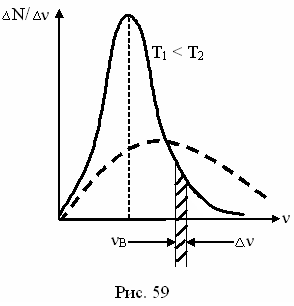 рис. 25
рис. 25
Распределение молекул газа по скоростям (по Максвеллу).
Наибольшее число молекул обладают
средней скоростью, а большой и маленькой –
обладает незначительное количество молекул.
 наиболее вероятная
скорость молекул
наиболее вероятная
скорость молекул
Понятие идеального газа .
Идеальным газом называется воображаемая модель газа, молекулы которого представляют собой материальные точки и силами взаимодействия, между молекулами можно пренебречь.
Получим уравнение состояния идеального газа.
( Менделеева- Клапейрона).
![]()
![]() -
концентрация молекул
-
концентрация молекул
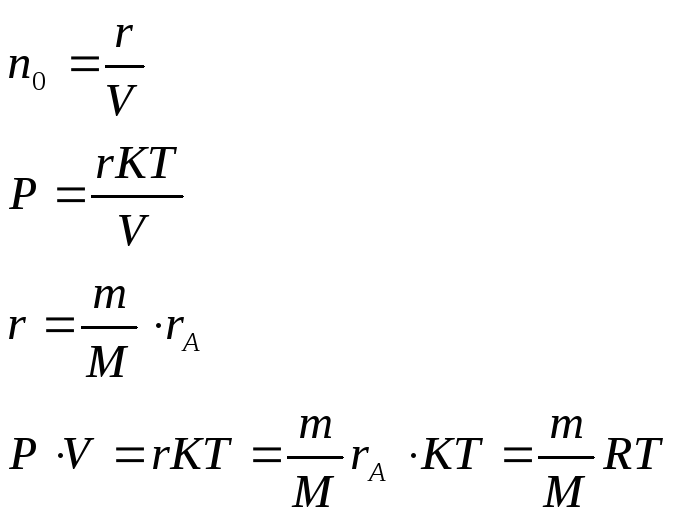
Получаем:
![]() уравнение состояния идеального газа
уравнение состояния идеального газа
Реальный газ – при рассмотрении реальных газов учитывают размеры, форму и силы взаимодействия между молекулами.
Уравнение состояния реального газа.
(Ван-Дер-Ваальса)
![]()
![]() давление
реального газа
давление
реального газа
![]() -
объем самих
молекул
-
объем самих
молекул

![]() некоторый
коэффициент
некоторый
коэффициент
Изотермы Ван-дер-Ваальса
Изотермы реального газа в отличии от изотерм идеального газа имеют некоторую неоднородность, которая едва проявляется при температуре, равной критической, и все явственнее видна при температурах более низких (рис.26). Таким образом на графике выделяется область(заштрихованная) переходного состояния пар-жидкость. Область, соответствующая меньшим значениям объема и большим значениям давления, показывает жидкое агрегатное состояние. А область с большими значениями объема и меньшими значениями давления соответствует газообразному агрегатному состоянию.
Критическая температура – это некоторое пороговое значение, если газ находится при температуре выше критической, то его никаким давлением нельзя перевести в жидкое состояние, если - ниже критической, то его можно перевести в жидкое состояние.

рис.26
Вопросы для самоконтроля
Назвать основные положения МКТ?
Какой газ называется идеальным?
В чем заключается физический смысл температуры и давления?
Какие изопроцессы вы знаете?
В чем заключается физический смысл критической температуры?
Список литературы Основная
Грабовский Р.И. Курс физики. 6-е изд. – СПБ. : Издательство «Лань», 2002.- 608 с - / Учебники для вузов. Специальная литература. Формирование научных понятий в условиях глобализации образования (монография). Монография. Саратов: Изд-во ФГОУ ВПО «Саратовский ГАУ», 2004. 232 с.
Пронин В.П. – краткий курс физики. Саратов. СГАУ. 2007 г., 200с.
Дополнительная
Основы физики и биофизики. А.И. Журавлев и др. М. : Мир. 2005. – 384 с.
Пронин В.П. Практикум по физике : уч. пособия / В.П. Пронин.- 2-е изд. Пронин В.П. – краткий курс физики. Саратов. СГАУ. 2007 г., 200с.
