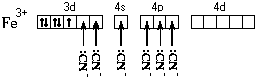- •Кафедра «Моделирование систем и информационные технологии»
- •1. Комплексные соединения
- •1.1.Комплексы
- •1.2. Комплексообразователи
- •1.3. Лиганды
- •2. Номенклатура комплексных соединений
- •3. Химическая связь в комплексных соединених и их строение
- •4. Диссоциация комплексных соединений
- •5. Экспериментальная часть
- •6. Индивидуальные задания
- •Варианты заданий
- •Литература
2. Номенклатура комплексных соединений
В названиях комплексных соединений первыми приводят анион, а затем катион.
В названии комплексного иона на первом месте записывается комплексообразователь, а за ним – лиганды. Число лигандов отмечается цифрой в нижнем индексе. Формулу комплексного иона (внутренняя сфера) заключают в квадратные скобки, и тогда заряд комплексного иона записывается в верхнем индексе за скобками.
K4[Fe(CN)6] – гексацианоферрат (II) калия.
Названия наиболее распространенных лигандов:
|
H2O – аква |
Cl ─– хлоро |
SO42─ – сульфато |
OH─ – гидроксо |
|
CO – карбонил |
Br─– бромо |
CO32─ – карбонато |
H─ – гидридо |
|
NH3 – аммин |
NO2─ – нитро |
CN─ – циано |
NO─ – нитрозо |
|
NO – нитрозил |
O2─ – оксо |
NCS─- – тиоцианато |
H+I – гидро |
В формуле комплексной соли (или соединения) частицы внешней сферы записывают перед скобками, если ионы имеют положительный заряд (катионы), и после скобок, если их заряд отрицателен (анионы). Числа ионов внешней сферы отмечаются нижним индексом при формуле иона.
Например: K4[Fe(CN)6] – гексацианоферрат(II) калия,
[Cu(NH3)4]Cl2 – дихлорид тетраамминмеди(II).
Формула комплексного соединения читается в обратной последовательности ее написания, т.е. справа налево.
Если комплексный ион является катионом и после квадратных скобок записаны анионы, то сначала дают их название в именительном падеже, а затем (в записи словами делается промежуток) переходят к числу лигандов и их названию и наконец говорят о комплексообразователе в родительном падеже с указанием римской цифрой в круглых скобках его заряда.
Например: [Cu(NH3)4](OH)2 – гидроксид тетраамминмеди(II), [Pt(H2O)(NH3)2OH]NO3 – нитрат гидроксодиамминакваплатины(II).
Примеры названий комплексных катионов:
|
[Zn(H2O)4]2+ – ион тетрааквацинка |
[Fe(H2O)5Cl]2+ – ион хлоропентаакважелеза(III) |
|
[Ag(NH3)2]+ – ион диамминсеребра(I) |
[Al(H2O)4(OH)2+ – ион дигидроксотетраакваалюминия |
|
[Cr(H2O)6]3+ – ион гексааквахрома(III) |
[Co(NH3)5SO3]+ – ион сульфитопентаамминкобальта(III) |
Если комплексный ион является анионом и катионы внешней сферы записаны перед квадратными скобками, то название начинается с числа лигандов, затем указываются лиганды, далее комплексообразователь с его зарядом и наконец катионы внешней сферы в родительном падеже.
Например: K4[Fe(CN)6] – гексацианоферрат(II) калия.
Примеры названий комплексных анионов:
[Zn(OH)4]2- – тетрагидроксоцинкат-ион
[Ag(S2O3)2]3- – ди(тиосульфато)аргентат(I)-ион
[Cr(CN)6]3- – гексацианохромат(III)-ион
[Al(H2O)2(OH)4] - – тетрагидроксодиакваалюминат-ион
[Co(NH3)2(NO2)4] - – тетранитродиамминкобальтат(III)-ион
[Fe(H2O)(CN)5]3- – пентацианоакваферрат(II)-ион
Примеры названий нейтральных комплексных частиц:
|
[Fe(CO)5] – пентакарбонилжелезо |
[Cr(C6H6)2] – дибензолхром |
|
[Co(NH3)Cl3] – трихлороамминкобальт |
[Pt(NH3)2Br2] – дибромодиамминплатина |
3. Химическая связь в комплексных соединених и их строение
В кристаллических комплексных соединениях с заряженными комплексами связь между комплексом и внешнесферными ионами – ионная, связи между остальными частицами внешней сферы – межмолекулярные (в том числе и водородные). В молекулярных комплексных соединениях связь между комплексами межмолекулярная.
В большинстве комплексных частиц между центральным атомом и лигандами связи ковалентные. Все они или их часть образованы по донорно-акцепторному механизму. В наименее прочных комплексах (например, в аквакомплексах щелочных и щелочноземельных элементов, а также аммония) лиганды удерживаются электростатическим притяжением. Связь в комплексных частицах часто называют донорно-акцепторной или координационной связью.
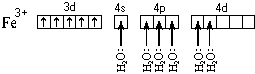
Рассмотрим ее образование на примере аквакатиона железа(II). Этот ион образуется по реакции:
FeCl2кр + 6H2O = [Fe(H2O)6]2+ + 2Cl_
Электронная формула атома железа – 1s22s22p63s23p64s23d6. Составим схему валентных подуровней этого атома:
![]()
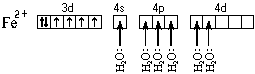
При образовании двухзарядного иона атом железа теряет два 4s-электрона:
![]()
Ион железа акцептирует шесть электронных пар атомов кислорода шести молекул воды на свободные валентные орбитали:
Образуется комплексный катион, химическое строение которого можно выразить одной из следующих формул:
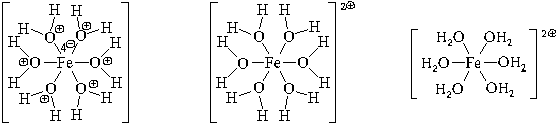
Пространственное строение этой частицы выражается одной из пространственных формул:
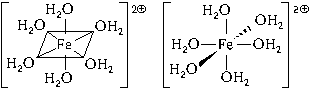
Форма координационного полиэдра – октаэдр. Все связи Fe-O одинаковые. Предполагается sp3d2-гибридизация АО атома железа. Магнитные свойства комплекса указывают на наличие неспаренных электронов.
Если FeCl2 вводить в раствор, содержащий цианид-ионы, то протекает реакция
FeCl2кр
+ 6CN![]() = [Fe(CN)6]4
= [Fe(CN)6]4![]() + 2Cl
+ 2Cl![]() .
.
Тот же комплекс получается и при добавлении к раствору FeCl2 раствора цианида калия KCN:
[Fe(H2O)6]2+ + 6CN- = [Fe(CN)6]4- + 6H2O .
Это говорит о том, что цианидный комплекс прочнее аквакомплекса. В цианидном комплексе отсутствуют неспаренные электроны у атома железа. Все это связано с несколько иным электронным строением этого комплекса:

Более
«сильные» лиганды CN![]() образуют более прочные связи с атомом
железа, выигрыша в энергии хватает на
то, чтобы «нарушить» правило Хунда и
освободить 3d-орбитали
для неподеленных пар лигандов.
Пространственное строение цианидного
комплекса такое же, как и аквакомплекса,
но тип гибридизации другой – d2sp3.
образуют более прочные связи с атомом
железа, выигрыша в энергии хватает на
то, чтобы «нарушить» правило Хунда и
освободить 3d-орбитали
для неподеленных пар лигандов.
Пространственное строение цианидного
комплекса такое же, как и аквакомплекса,
но тип гибридизации другой – d2sp3.
"Сила" лиганда зависит прежде всего от электронной плотности облака неподеленной пары электронов, то есть, она увеличивается с уменьшением размера атома, с уменьшением главного квантового числа, зависит от типа гибридизации и от некоторых других факторов. Важнейшие лиганды можно выстроить в ряд по возрастанию их «силы» (своеобразный «ряд активности» лигандов), который называется спектрохимическим рядом лигандов:
|
I─; Br─; :SCN─ , Cl─, F─, OH─, H2O; :NCS─ NH3; SO3S:2─; :CN─, CO |
Для
комплексов [Fe(H2O)6]3![]() и [Fe(CN)6]3
и [Fe(CN)6]3![]() схемы образования выглядят следующим
образом:
схемы образования выглядят следующим
образом:
|
|
|
Для комплексов с координационным числом = 4 возможны две структуры: тетраэдр (в случае sp3-гибридизации), например, [Zn(H2O)4]2+, и плоский квадрат (в случае dsp2-гибридизации), например, [Cu(NH3)4]2+.