
- •Реферат на тему:
- •Глава 1. Развитие представлений об электролитической диссоциации
- •Основные положения теории Аррениуса
- •1.2. Недостатки классической теории электролитической диссоциации
- •1.3. Спектроскопические методы исследования строения растворов электролитов
- •Глава 2. Ион-дипольное взаимодействие в растворах электролитов.
- •2.1. Механизмы образования растворов электролитов
- •2.2. Энергия кристаллической решетки
- •2.3. Энергия сольватации
- •2.4. Корреляционные подходы к сравнению свойств растворителей
- •2.5. Состояние ионов в растворах
- •Глава 3. Ион-ионное взаимодействие в растворах электролитов.
- •3.1. Термодинамическое описание равновесий в растворах электролитов
- •3.2. Распределение ионов в растворе электролита и потенциал ионной атмосферы
- •3.3. Теория Дебая-Хюккеля
- •3.4. Ионная ассоциация в растворах электролитов
- •3.5. Эмпирические и полуэмпирические методы описания термодинамических свойств растворов
- •3.6. Современное состояние и перспективы развития теории растворов электролитов
- •Список литературы
Глава 2. Ион-дипольное взаимодействие в растворах электролитов.
2.1. Механизмы образования растворов электролитов
Термин электролитическая диссоциация подразумевает образование ионов в растворе из нейтральных молекул растворяемого вещества. Однако часто ионы существуют уже до растворения (вещества, содержащие ионы в исходном состоянии, иногда называют ионофорами, или истинными электролитами). Например, твердый хлорид натрия представляет собой кристалл, построенный из ионов Na+ и Cl–. При растворении NaCl происходит разрушение кристалла за счет взаимодействия ионов с диполями растворителя. Чтобы доказать это, нужно рассчитать энергию, необходимую для разрушения кристаллической решетки, и сопоставить ее с энергией сольватации, т.е. с выигрышем энергии за счет взаимодействия ионов с растворителем. Если эти энергии окажутся близкими, то вывод о разрушении кристаллической решетки соли за счет ион-дипольного взаимодействия можно считать правильным.
В ряде случаев раствор электролита действительно получается при растворении вещества, состоящего из нейтральных молекул (вещества, образующие ионы лишь при растворении, называют ионогенами, или потенциальными электролитами). Так, например, при растворении в воде газообразного HCl получается раствор сильного электролита — соляной кислоты. Однако и здесь дело сводится не к диссоциации молекул НCl, а к их химическому взаимодействию с молекулами воды
НCl + Н2О → Н3О+ + Сl–,
при котором протон переходит от молекулы НCl к молекуле H2O с образованием иона гидроксония. Кроме того, образовавшиеся ионы Н3O+ и Cl– вступают в ион-дипольное взаимодействие с избыточными молекулами воды. Таким образом, при образовании раствора соляной кислоты энергия, необходимая для разрыва химической связи Н–Cl (она составляет 432 кДж/моль), компенсируется энергией связи протона с молекулой воды в ионе гидроксония и энергией гидратации ионов Н3O+ и Cl–.
Таковы два основных механизма образования растворов электролитов.
2.2. Энергия кристаллической решетки
Энергия кристаллической решетки представляет собой работу, которую нужно затратить для разрушения решетки, т.е. для разведения составляющих ее ионов на бесконечно большое расстояние в вакууме. Энергию кристаллической решетки рассчитывают на моль исследуемого вещества. Для оценки этой энергии воспользуемся модельным методом, который был предложен М. Борном (1920 г.). Рассмотрим два противоположно заряженных иона, составляющих данную кристаллическую решетку, которые имеют абсолютные заряды z1e0 и z2e0 (e0— элементарный заряд) и находятся друг от друга на расстоянии r. Силу электростатического взаимодействия (притяжения) между этими ионами можно определить по закону Кулона:
 ,
(2.2.1)
,
(2.2.1)
где ε0 — диэлектрическая постоянная вакуума, равная 0,88542•10–11 Ф/м.
Можно предположить, что первый ион закреплен в положении r = 0, а сила Fэл действует на второй ион в направлении первого иона (рис. 2.1). Поскольку направление силы Fэл противоположно направлению оси r, то Fэл < 0. Одновременно на ионы действует сила отталкивания Fот, обусловленная взаимодействием электронных оболочек и не позволяющая ионам бесконечно близко подойти друг к другу.
Предположим, что сила Fот также приложена ко второму иону. Поскольку направление этой силы совпадает с направлением оси r, то Fот > 0. Силу Fот можно представить в виде
 (2.2.2)
(2.2.2)
где В и n - константы, причем n > 1.
Таким образом, суммарная сила взаимодействия ионов равна
 .
(2.2.3)
.
(2.2.3)
По определению,
 ,
где U—потенциальная энергия системы.
Поэтому, интегрируя величину Fот
равновесного расстояния (r0)
между ионами в кристаллической решетке
до r = ∞, находим изменение потенциальной
энергии ∆U, соответствующее удалению
двух рассматриваемых ионов на бесконечно
большое расстояние (см. рис. 2.1):
,
где U—потенциальная энергия системы.
Поэтому, интегрируя величину Fот
равновесного расстояния (r0)
между ионами в кристаллической решетке
до r = ∞, находим изменение потенциальной
энергии ∆U, соответствующее удалению
двух рассматриваемых ионов на бесконечно
большое расстояние (см. рис. 2.1):
 .
(2.2.4)
.
(2.2.4)

Константу В можно рассчитать по уравнению (2.2.3), так как в равновесном состоянии, когда r=r0, F=0. Следовательно,
 ,
,
а уравнение (2.2.4) можно переписать в виде
 .
(2.2.5)
.
(2.2.5)
Формула (2.2.5) получена для одной пары ионов. Чтобы перейти к энергии кристаллической решетки, рассчитываемой на моль вещества, необходимо умножить ∆U на число Авогадро NA и учесть взаимодействие между всеми ионами, которое определяется их взаимным расположением в объеме решетки. Последняя поправка эквивалентна введению еще одного множителя А - так называемой константы Маделунга, которая зависит от типа кристаллической решетки. Например, для хлорида натрия
A = 1,7476.
Таким образом, модель Борна, связывающая свободную энергию кристаллической решетки с потенциальной энергией взаимодействия образующих ее ионов, приводит к формуле
 . (2.2.6)
. (2.2.6)
Рентгеноструктурный анализ позволяет установить геометрию кристаллов и определить параметры А и r0. Константа n обычно рассчитывается из данных по сжимаемости кристаллов.
Для NaCl n=7,5; для других солей значение n колеблется от 5 до 12.
Расчет по формуле (2.2.6) показывает, что для хлорида натрия энергия кристаллической решетки составляет

Столь же значительные величины получаются и для других солей.
Для оценки точности формулы
(2.2.6) представляет интерес сопоставить
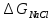 с изменением энтальпии в ходе разрушения
кристаллической решетки хлорида натрия
с изменением энтальпии в ходе разрушения
кристаллической решетки хлорида натрия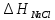 .
Величину
.
Величину можно определить при помощи следующего
термодинамического цикла:
можно определить при помощи следующего
термодинамического цикла:

Значение ∆H1 в первом приближении можно приравнять потенциалу ионизации натрия, взятому с обратным знаком. Изменение энтальпии ∆H2 приближенно определяется сродством к электрону атома хлора. Величина ∆H3 соответствует тепловому эффекту при конденсации газообразного натрия, а ∆H4— тепловому эффекту при рекомбинации атомов хлора. Наконец, ∆H5 равно тепловому эффекту при сжигании металлического натрия в атмосфере газообразного хлора. Экспериментально было найдено, что ∆H1 = –496, ∆H2 = 365, ∆H3 = –109, ∆H4 = –121 и ∆H5 = –411 кДж/моль. Поскольку в замкнутом термодинамическом цикле по закону Гесса Σ∆Hi =0, то

Учитывая данные по теплоемкости
хлорида натрия, можно оценить произведение
T∆S, которое при 25°С составляет
приблизительно 15 кДж/моль.
Таким образом, для энергии кристаллической
решетки NaCl получаем
 ,
что хорошо согласуется с величиной,
рассчитанной по формуле (2.2.6).
,
что хорошо согласуется с величиной,
рассчитанной по формуле (2.2.6).
Итак, образование ионов при разрушении кристаллической решетки требует затраты очень большой энергии. Если бы эта энергия не компенсировалась энергией сольватации, то степень диссоциации практически равнялась бы нулю. Константа диссоциации NaCl в водном растворе при этом составила бы

и, следовательно, согласно формуле (1.2.4), степень диссоциации
для 0,01M раствора была бы равна

Этот результат показывает, что возражения критиков теории Аррениуса, игнорировавшей ион-дипольное взаимодействие, были вполне обоснованными.
