
Модуль 2
.pdf
Молекулярная (Модуль 2.1)
32. Предмет молекулярної фізики. Експериментальні закони ідеального газу. Рівняння Клайперона-Менделєєва.
Ответ: Молекулярная физика изучает физ. Свойства вещества в разных агрегатных состояниях в зависимости от строения и особенностей молекулярного движения.
Основные вопросы: 1) Молекулярное строение и связь его со свойствами. 2) Особенности перехода из одного агрегатного состояния в другое. 3) Явление на границах агрегатных состояний.
Два метода: 1) Термодинамический; 2) Статистический.
Три постулата: 1) Все тела состоят из мельчайших частичек – атомов. 2) Все частички взаимодействуют, и силы взаимодействия зависят от расстояния. 3) Все атомы находятся в хаотичном движении.
32.1 Закон Бойля-Мариотта. |
|
|
|
|
|
|||||
Ответ: Если взять газ и не менять температуру, то отношение: |
|
; |
; |
|||||||
|
||||||||||
|
|
|
|
; |
; |
|
. |
|
|
|
|
|
|
|
|
|
|||||
Давление некоторой массы газа при неизменной температуре обратно пропорционально объёму газа.
32.2 Закон Гей-Люссака.
Ответ: Пропорциональная зависимость объёма газа от абсолютной температуры при постоянном
давлении. |
|
; |
; – коф. сжатия.; – объём при нуле градусов. |
|
32.3 Закон Шарля.
Ответ: ; – давление при нуле градусов.; – температура в Кельвинах. - коф. (зависит от свойств)
32.4 Закон Авогадро. Закон Дальтона.
Ответ: Закон Дальтона: Давления смеси газов равны смеси парциальных давлений этих газов.
Закон Авогадро: Если взять какие-то два газа, которые имеют равные объёмы, температуру, давление, то это возможно тогда, когда число молекул в этих газах одинаковое.
32.5 Объединённый газовый закон, формула Клайперона-Менделеэва.
Ответ: |
; R – универсальная газовая постоянная. |
Формула Клайперона-Менделеэва:
(число Авогадро) (постоянная Больцмана)
33. Барометрична формула
Ответ:
Формула Больцмана:
; n – концентрация молекул.; – концентрация при нулевой высоте. Число Лашмидта =
34. Основное уравнение кинетической теории газов.
Ответ: 5 видов записи: 1) |
|
; 2) |
|
|
|
|
|
; 3) |
; |
|
|
|
|
4); 5)
35. 5 видов из основного уравнения МКТ.
Ответ: 1) закон Шарля; 2) закон Бойля-Мариотта; 3) закон Авогадро; 4) закон Дальтона; 5) закон Гей-Люссака
36. Распределение Максвелла по скоростям. Опыт Штерна.
Ответ: (36.1 – 36.2)
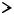 V
V
V
Кривая несимметричная выходит из нуля и стремится к нулю при скорости стремящейся к бесконечности.
Первое преобразование:


 ; – масса одной молекулы.; U – скорость молекулы.; T – температура; К – постоянная Больцмана; n – число молекул.
; – масса одной молекулы.; U – скорость молекулы.; T – температура; К – постоянная Больцмана; n – число молекул.
Второе преобразование:
Третье преобразование:
36.4 Понятие наиболее вероятной скорости, средней квадратической скорости, средней арифметической скорости.
Ответ: Наиболее вероятная скорость: |
√ |
|
|
|
|
|
|
|
|
|
|||
Средняя арифметическая скорость: |
|
|
√ |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
||
Средняя квадратическая скорость: |
√ |
|
|
|
||
|
|
|
|
|
||
|
|
|||||
36.5 Опыт Штерна.
Ответ: Из прибора Штерна выкачаем воздух, и в нем поддерживается очень низкое давление. При нагревании серебра в печке, оно нагреется, и из печки вылетают молекулы серебра движущиеся со скоростью их молекулярного движения. Схема цилиндра специально охлаждается, чтобы попадающие на них молекулы «прилипали» к ней, образуя налет серебра. Теперь предположим, что весь прибор привели во вращение. В этом случае молекулы будут попадать в другую точку, лежащую позади 1-ой точки, и налет серебра будет образовываться на ней.
37. Понятие флуктуации. Длина свободного пробега молекул.
37.1 Мера флуктуации. Относительная флуктуация.
Ответ: Флуктуация – отклонение реального чисел молекул от среднего числа молекул в этом объёме.
–относительная флуктуация.
37.2Формула для среднего числа столкновений молекул.
Ответ: – среднее число столкновений молекул.
37.3Формула для средней длины свободного пробега молекул.
Ответ: Средняя длина свободного пробега молекул – среднее постоянное между двумя последовательными столкновениями молекулы.
√
37.4 Понятие эффективного диаметра молекулы.
Ответ: Эффективный диаметр молекулы – то расстояние, на которое могут, сблизится две
молекулы. √√
38. Явления переноса. Стационарная теплопроводность.
Ответ: Явления переноса: 1) Диффузия; 2) Теплопроводность; 3) Внутренние трение. Диффузия – процесс выравнивания концентрации молекул.
Теплопроводность – процесс выравнивания температуры за счет хаотического движения молекул.
Внутреннее трение – свойство твердых тел необратимо превращать в теплоту механическую энергию, сообщенную телу в процессе его деформации.
39. Вычисление коф. теплопроводности газов.
39.1 Выражение коф. теплопроводности через молекулярно-кинетические параметры.
Ответ: ; k – коф. теплопроводности; n – концентрация молекул; – средняя скорость молекул; K – постоянная Больцмана.

39.2 Понятие стационарной теплопроводности.
Ответ: Стационарная теплопроводность – это когда температура на текущих сред. поддерживается одинаковой.
40. Внутреннее трение в газах.
40.2 Выражение коф. внутреннего трения через молекулярно-кинетические параметры.
Ответ: ; η – коф. внтр. трения; λ – сре. длина свободного пробега молекул;
–плотность; – сре. скорость молекул.
41.Молекулярная теория диффузии в газах.
41.1Какая физическая величина переносится при диффузии.
Ответ: При диффузии переносится концентрация молекул.
41.2Выражение коф. диффузии через молекулярно-кинетические параметры. Ответ:
41.3Взаимосвязь между коф. диффузии, теплопроводности и внутреннего трения.
Ответ: Во всех трех случаях принимают участие параметры и λ.
42. Распределение энергии молекул идеального газа по степеням свободы.
Ответ: Степени свободы – число независимых параметров, которые необходимы, для того чтобы однозначно определить положение тела.
42.1Число степеней вольности многоатомной молекулы. Ответ:
1) Одноатомная молекула – 3
2) Двухатомная молекула – 5
3) Трёхатомная молекула – 6
4) Многоатомная любая молекула – 6
5) Линейная трёхатомная молекула – 4
42.2Зависимость энергии многоатомной молекулы от числа степени свободы.
Ответ: На одну степень свободы в поступательном и вращательном движении находится энергия равная . На одну степень движения в колебательном движении приходится энергия равная
KT.
42.3 Энергия 1-го моля многоатомного идеального газа при высоких и низких температурах. Ответ:
43. Теплоемкость газов.
43.1 Понятие малярной и удельной теплоемкости.
Ответ: Теплоемкость – количество теплоты поглощаемого телом при нагревании его на 1 градус. Удельная теплоемкость – кол. Тепловой энергии, необходимой для повышения температуры, 1 кг. вещества, на 1 градус.
Молярная теплоемкость – это теплоемкость одного моля вещества.

43.2 Уравнение Майэра. |
|
|
Ответ: |
; |
– удельная теплоемкость при постоянном давлении; – удельная |
теплоемкость при постоянном объёме; R – универсальная газовая постоянная.
44. Внутренняя энергия как функция состояния. Работа расширения газов при изопроцессах.
44.1 Работа газа при изотермическом, изобарном и изохорном процессе.
Ответ: Изотермический - термодинамический процесс, происходящий при постоянной температуре.
График – гипербола.
T – const
Изобарный – термодинамический процесс, происходящий при постоянном давлении и постоянной массе идеального газа.
График – прямая. P- const
Изохорный – термодинамический процесс, который происходит при постоянном объёме. Работа равна нулю.
График – прямая. V – const
W=0
44.2 Панятие параметры состояния, функции состояния.
Ответ: Параметры состояния – внутренняя энергия, энтропия, температура, давление, объём. Функция состояния – функция независимых параметров, определяющих равновесное состояние термодинамической системы.
45. Первое начало термодинамики. Ответ:
1)Внтр. энергия термодинамической системы является однозначной функцией состояния.
2)Изм. внтр. энергии при переходе из одного состояния в другое не зависит от пути перехода, а зависит только от начального и конечного состояния.
3)Теплота, проходящая к системе, идет на увеличение внтр. энергии плюс работы.
4)Вечный двигатель невозможен, так как нельзя совершить работу, не подводя теплоты и не меняя внтр. энергии.
46. Адиабатный процесс. Работа адиабатного расширения идеального газа.
46.1 Понятие адиабатного процесса.
Ответ: Адиабатный процесс – термодинамический процесс, при котором нет обмена с окружающей средой.
График – гипербола. dQ=0
46.2 Уравнение Пуассона в параметрах P – T; T – V.
Ответ: Уравнение Пуассона в параметрах давление-температура:

Уравнение Пуассона в параметрах температура-объём:
Уравнение Пуассона в параметрах давление-объём:
47. Обратимые и не обратимые процессы. Основные понятия, которыми пользуется термодинамика.
47.1 Понятие равновесного и стационарного состояния.
Ответ: Равновесное состояние системы – это когда параметры системы, от которых это зависит, во всех её частях как угодно долго постоянны, за счет внтр. сил.
Стационарное состояние системы – это когда все параметры, во всех её частях, остаются постоянными. Оно может существовать как угодно долго, за счет внешних сил.
Время релаксации – время перехода из одного состояния в другое.
47.2 Понятие неравновесного и метастабильного состояния.
Ответ: Метастабильное состояние – состояние неустойчивости равновесия, в котором система может, находится длительное время, не переходя в более устойчивое.
Неравновесное состояние – состояние системы выведенного из термодинамического равновесия.
47.3 Понятие равновесного процесса.
Ответ: Равновесный процесс – процесс, при котором скорость нарушения состояния равновесия меньше скорости релаксации.
47.4 Понятие оборотного процесса.
Ответ: Оборотный процесс – если система может, вернутся в исходное положение через те же промежуточные состояния.
47.5 Понятие цикла.
Ответ: Цикл – система меняется, а потом возвращается в начало.
48. Цикл Карно и его КПД.
48.1 Цикл Карно в координат P – V.
Ответ: Цикл Карно – цикл, который состоит из двух изотерм и двух адиабат.
P
изотерма
 адиабат
адиабат
 V
V
48.2 Понятие КПД теплового двигателя.
Ответ: КПД теплового двигателя – отношение совершенной полезной работы двигателя, к энергии, полученной от нагревателя.
48.3 КПД теплового двигателя Карно. Ответ:

48.4 Теорема Карно. Ответ:
I часть: все обратимые тепловые машины, где используется цикл Карно имеют одинаковые КПД, независимо от рабочего тела, которое с ним работает, если они работают с общим нагревателем и общим холодильником.
II часть: Две машины Карно работают, одна обратимая, другая нет, то КПД необратимой машины меньше, чем КПД обратимой машины Карно, если температуры нагревателя и холодильника равны.
49. Второй закон термодинамики.
49.1 Формулировка Планка. (второго закона термодинамики)
Ответ: Невозможен такой периодический процесс, единым результатом которого было бы превращение теплоты в работу.
49.2 Формулировка Клаузиуса. (второго закона термодинамики)
Ответ: Невозможен процесс, при котором теплота самопроизвольно переходила бы от более холодного к более горячему.
49.3 Формулировка Томсона. (второго закона термодинамики)
Ответ: Невозможно построить тепловую машину, которая вырабатывала бы работу за счет внтр. энергии более холодного тела.
50. Понятие про энтропию. Примеры вычисления энтропии.
50.1 Понятие энтропии. |
|
|
Ответ: Энтропия – функция изменения которой равно ∫ |
из начального состояния в конечное. |
|
Обозначается: “S” |
P |
|
Для обратимых процессов: |
|
3 |
|
A |
1 |
|
2 |
B |
|
|
V |
|
|
1, 2, 3 – путь. |
50.2 Объединённая формулировка.
Ответ: Невозможно построить машину в которой КПД=100%. (вечный двигатель второго порядка невозможен)
( ) ∑ ( )
50.3 Изм. энтропии при плавлении.
Ответ: ; λ – удельная теплота плавления.
50.4 Изм. энтропии при нагревании.
Ответ: ; c – сре. значение удельной теплоемкости.

50.5Изм. энтропии при адиабатическом расширении. Ответ:
50.6Изм. энтропии при изотермическом расширении. Ответ:
51. Выражение второго закона термодинамики для необратимых процессов. Ответ:
Обобщенное выражение для обратимых и необратимых процессов.
52. Статистическое толкование второго закона термодинамики. Связь между энтропией и термодинамической вероятностью.
Ответ: В замкнутой изолированной системе все реальные процессы происходят с увеличением энтропии. Условием равновесия в замкнутой реальной сис. является максимум энтропии.
52.2 Загальна формула для обчислення числа мікророзподілів даного макророзподіла.
Ответ: |
|
; N – число частичек; n – число мал. объёмов. |
|
Наибольшая вероятность –равномерное распределение.
52.3 Уравнение Больцмана для энтропии.
Ответ: ; S – энтропия; W - термодинамическая вероятность; К – постоянная Больцмана.
53. Реальный газ. Уравнение Ван дер Вальса.
53.2 |
Уравнение Ван дер Вальса. |
||||||||||||
Ответ: ( |
|
) |
|
|
|
|
|
V – молярный объём; a, b – постоянные Ван дер Вальса. |
|||||
|
|||||||||||||
53.3 |
Уравнение Вукаловича-Новикова. Уравнение Боголюбова для реальных газов. |
||||||||||||
Ответ: Уравнение Вукаловича-Новикова: |
|||||||||||||
( |
|
|
) |
( |
|
|
|
|
|
) |
|||
|
|
|
|||||||||||
Уравнение Боголюбова: |
|
|
|
|
|
|
|||||||
|
( |
|
∑ |
|
|
|
) |
|
|
|
|
||
|
|
|
|
|
|
|
|
||||||
54. Применение уравнения Ван дер Вальса для фазового перехода жидкости – пар. Ответ:
56. Испарение и равновесие между паром, жидкостью и твердым телом. Фазовые переходы.
56.2 Понятие пресыщенного пара.
Ответ: Пересыщенный пар – пар, давление которого выше давления насыщенного пар, при тех же условиях.
Насыщенный пар – пар, находящийся в равновесии с жидкостью, того же химического состава. Сублимация – это процесс перехода вещества из газообразного состояния в твердое, меняя каждую фазу.
Фаза – однородная часть системы, которая отдалена от других частей границами, которая может механически удалена из системы без изменения свойств.
56.3Фазовые переходы по Эренфесту. Ответ:
I рода: Такие, где энтропия и объём меняются скачками..
II рода: Такие, где термодинамические коф. меняются скачками, а энтропия и объём меняются плавно.
56.49типов фазовых переходов.
Ответ: |
|
|
1) |
Испарения |
соединения |
2) |
Возлонка |
сублимация |
3) |
Кристаллизация плавление |
|
4)Полимафиф превращение
5)Упорядочение
6) |
Ферромагнетизм антиферромагнетизм |
7) |
Диэлектрик электрик |
8)Переход в сверхтекучее состояние
9)Переход в сверхпроводящее состояние
57. Поверхностное натяжение. Капиллярные силы.
57.1 Понятие силы поверхностного натяжения.
Ответ: Силы поверхностного натяжения – сила испытываемая молекулами жидкости на поверхности жидкости.
57.2 Формула Лапласа для мениска любой формы.
Ответ: Мениск – искривленная поверхность жидкости в месте её соприкосновения с поверхностью твердого тела.
;r – радиус кривизны поверхности.
57.4Дополнительное давление жидкости между двумя пластинами расположенных на малом расстоянии d.
Ответ: |
|
|
|
; |
p – давление под гладкой поверхностью; – давление под кривой |
||
|
|
||||||
поверхностью. |
|
|
|
|
|
||
57.5 Зависимость коф. поверхностного натяжения от температуры. |
|||||||
|
|
|
|
|
|||
Ответ: |
; |
– малярный объём; – коф. поверхностного натяжения; |
|||||
– критическая температура.
