
.Константа химического равновесия
Если все участники
реакции являются газообразными
веществами, то вместо равновесных
концентраций удобнее пользоваться
равновесными парциальными давлениямикомпонентовРА,РВ,РС и РD,
тогда закон действующих масс примет
вид: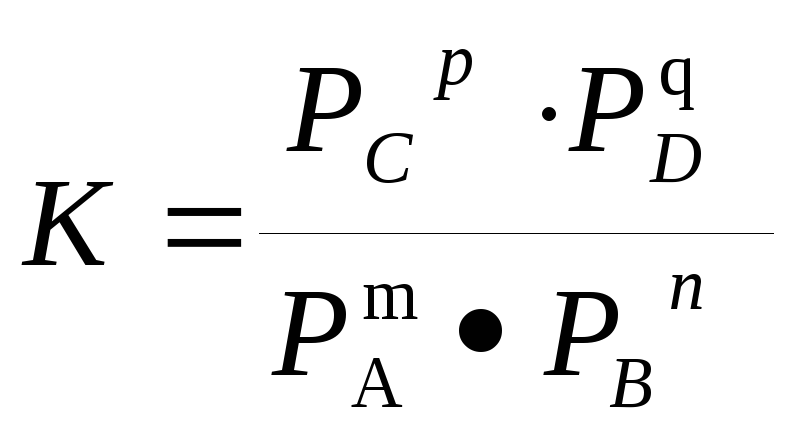
Обратите внимание. Для гетерогенных реакций закон действующих масс выполняется при условии, что вуравнения констант равновесия не входят равновесные концентрации (парциальные давления) твердых исходных веществ и продуктов реакции. Н-р, для гетерогенной реакции:
Сграфит+ 2Н2ОгазСО2+ 2Н2
константа равновесия К выражается уравнением:
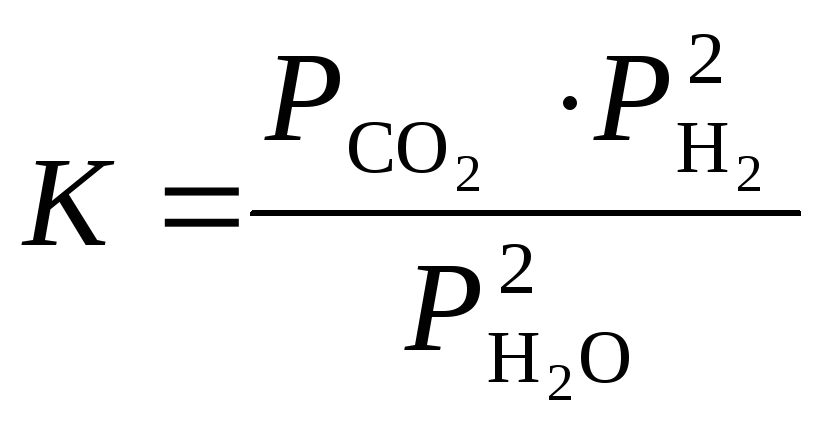 .
.
Д
 ля
реакции: 3Fe
+ 4H2Oпар
Fe3O4
+ 4H2
К =
ля
реакции: 3Fe
+ 4H2Oпар
Fe3O4
+ 4H2
К =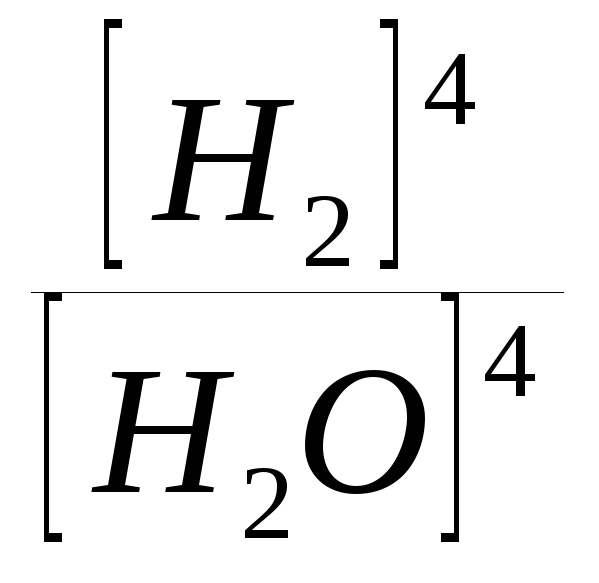 .
.
Константа равновесия
представляет собой отношение констант
скоростей прямой и обратной реакций К=
![]() .
Константа химического равновесия
зависит от природы реагирующих
веществ, от температуры и давления.
Влияние температуры наК
определяется знаком теплового эффекта
реакции. Связь между температурой и
константой равновесия реакции (при р
=const) отражает уравнениеизобары Вант-Гоффа:
.
Константа химического равновесия
зависит от природы реагирующих
веществ, от температуры и давления.
Влияние температуры наК
определяется знаком теплового эффекта
реакции. Связь между температурой и
константой равновесия реакции (при р
=const) отражает уравнениеизобары Вант-Гоффа:
![]() ,
(8)
,
(8)
где lnК – натуральный логарифм константы равновесия;Н– изменение энтальпии реакции;R – универсальная газовая постоянная;Т–абсолютная температура, К. Для эндотермической реакции (Q < 0,Н0) при повышении температуры константа равновесия увеличивается, и наоборот, для экзотермической реакции (Q > 0,Н0) при возрастании температурыКуменьшается. Из уравнения видно, что при увеличении абсолютного значения энтальпии реакции и уменьшении температуры чувствительностьКк изменению температуры повышается. Используя уравнение изобары Вант-Гоффа, можно вывести формулу для расчета среднего значенияНреакции, если известны значения константы равновесия при двух температурах (8а):
![]() (8а)
(8а)
где К1,К2– константы равновесия реакции при температурахТ1иТ2соответственно.
Стандартное изменение энергии Гиббса ΔG0реакции связано сКреакции уравнением (9):
ΔG0= -RTln К= - 2,303RTlg К, (9)
где R
- универсальная газовая постоянная
8,314![]() ;Т – абсолютная температура,К;К– значение константы равновесия.
;Т – абсолютная температура,К;К– значение константы равновесия.
Это уравнение (9) даёт возможность, зная ΔG0, вычислять константу равновесия, и, наоборот, по экспериментально найденному значениюКопределятьΔG0реакции.
Константа равновесия К не зависит от начальной концентрации реагирующих веществ. Чем больше К, тем больше концентрация конечных продуктов в момент равновесия. Она показывает, во сколько раз прямая реакция идет быстрее обратной при одинаковой температуре и концентрациях, равных единице.
Н-р, для реакции:
А
 + В С +D
+ В С +D
Если К равна 10-6, то это означает, что произведение равновесных концентраций продуктов реакции в 1 000 000 раз меньше произведения концентраций ис-ходных продуктов реакции. Следовательно, равновесие сдвинуто в левую сторону, т.е. указанная реакция протекает справа налево.
Если К равна 106, то это означает, что произведение концентраций конечных продуктов реакции в 1 000 000 раз больше произведения концентраций исходных продуктов реакции. Следовательно, равновесие в этом случае будет сдвинуто в правую сторону, т.е. указанная выше реакция протекает слева направо.
Закон действующих масс в применении к обратимым реакциям можно сформулировать следующим образом:
При постоянной температуре отношение произведения равновесных концентраций продуктов реакции в степенях, равных стехиометрическим коэффициентам, к произведению равновесных концентраций исходных веществ в степенях, равных стехиометрическим коэффициентам, является величиной постоянной.
Зная равновесные концентрации, легко вычислить константу равновесия и исходные концентрации реагирующих веществ.
