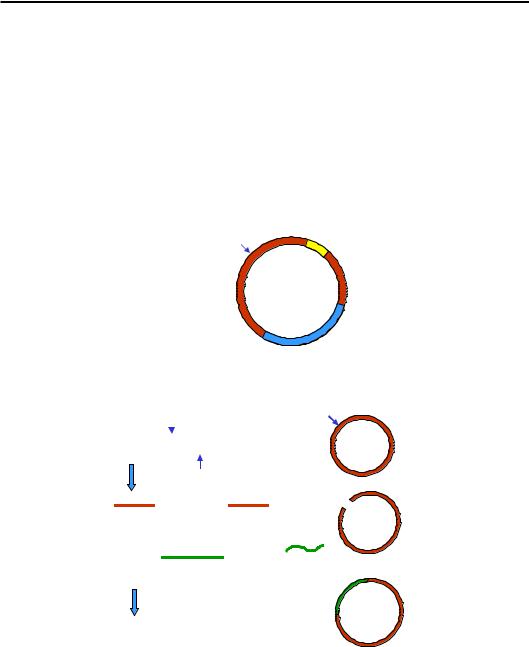MolBiol_sivolob
.pdf



Розділ 11
МЕТОДИ МОЛЕКУЛЯРНОЇ БІОЛОГІЇ
… блоха действительно была на все ноги подкована на настоящие подковы, а Левша доложил, что и это еще не всё удивительное.
Н. Лесков. Левша
Клонування, ампліфікація і секвенування ДНК
Клонування ДНК
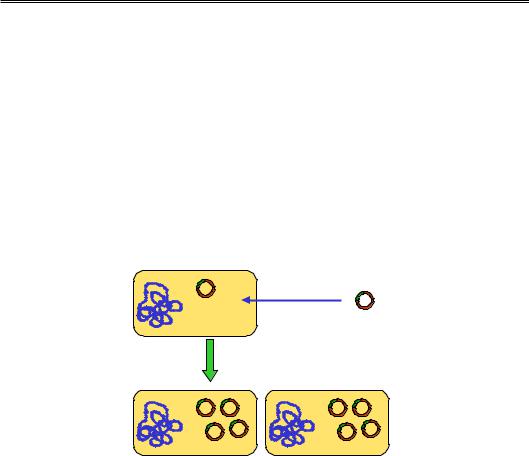
Перша проблема, котра постає перед дослідником, – це отримання в достатній кількості предмета свого дослідження. Ефективним підходом, що дозволяє розмножити будь-який конкретний фрагмент ДНК, є техніка клонування цієї ДНК у бактеріальних клітинах: фрагмент, що цікавить, вбудовується у ДНК-вектор з утворенням рекомбінантної молекули ДНК, яка вводиться у клітину (так звана трансформація). Далі залишається зачекати зростання бактеріальної культури – бактерія використовується як своєрідний біореактор.
Як вектор часто використовують бактеріальні плазміди – порівняно невеликі циркулярні молекули ДНК, що існують у клітині незалежно від бактеріальної хромосоми. Основними вимогами до плазміди як вектора є наявність у її складі ориджина реплікації, унікального (одного на плазміду) сайта, що впізнається певною рестриктазою, і гена стійкості до одного з антибіотиків (рис. 11.1).
Рестриктази – специфічні до невеликих елементів послідовності ендонуклеази, що здійснюють розрізання обох ланцюгів ДНК. Назви рестриктаз (існує кілька сотень таких ферментів) утворюють за таким принципом: перша велика літера позначає рід мікроорганізму, дві маленькі – вид, римські цифри та іноді великі літери – порядко-