шпоры
.docx|
1. классификация рекомбинаций. Рекомбинация (от лат.re-приставка, обозначающая повто-рение или возобновление действия, combinacio – соедине-ние) Генетическая рекомбинация – это появление новых сочетаний генов, ведущее к новым сочетаниям признаков в потомстве. Рекомбинация генов – универ-сальный механизм, свойствен-ный всему живому – от вирусов до человека. Рекомбинационные механизмы лежат в основе внутри-организменной измен-чивости, принимая участие в образовании антител, коммуникативных белков и т.д. Гомологичная – происходит между гомологичными последовательностями ДНК:реципрокн.нереципрокн.эктотипич.гомеологич.аллельн. Сайт-специфическая – затрагивает молекулы ДНК, характеризующиеся ограничен-ным структурным сходством, и наблюдается при интеграции генома фага в бактериальную хромосому. Незаконная – происходит во время транспозиции, не основан-ной на гомологии последователь-ностей ДНК.
6. Модель Холлидея. Общая модель кроссинговера опуб-ликована в 1964 году американским генетиком Р. Холлидеем. Формирование стр-ры Х. 1.После репликации ДНК и удвоения хромосом наблюдается попарное сближение сестринс-ких хроматид гомологичных хро-мосом с образованием бивален-тов (т.е. конъюгация) 2. В каждой молекуле ДНК на двух сближенных гомологичных участках несестринских хроматид фермент никаза делает симмет-ричные одноцепочечные разрезы. Разрывы происходят в цепях оди-наковой полярности. Первичные разрывы возникают в определен-ных сайтах ДНК 3. От точек первичных разрывов происходит обмен между дуплексами, который приводит 6. к образованию крестообразной структуры – полухиазма Холидея с гибридным районом, гетеродуплексом. Перемещение точки перекреста цепей в полу-хиазме вдоль рекомбинирующих дуплексов – «миграция ветвле-ния». От точки перекреста цепей про-исходит расплетание исходных дуплексов и высвобождающиеся цепи тут же ренатурируют с ком-плементарными цепями из гомо-логичных дуплексов. Это приво-дит к образованию и последую-щему удлинению гетеродуплекса - в этом биологический смысл миграции ветвления. Изомеризация - изменение струк-туры полухизм. Происходит за счет обычного теплового движе-ния. Еще одна изомеризация с пово-ротом одной из полухиазм вок-руг точки перекреста на 180° приводит к образованию второй изомерной формы структуры Холлидея. Для восстановления биспираль-ной структуры обеих молекул ДНК и завершения процесса их конъюгации, пересекающиеся цепи должны быть разрезаны. 3(9). Фламенко, орс Мобильные генетические элементы составляют значитель-ную часть генома эукариот. Среди них особый интерес пред-ставляют ретротранспозоны с длинными концевыми повторами (ДКП-ретротранспозоном), сход-ные по структуре с ретровируса-ми позвоночных. Элемент МДГ4 (gypsy) D.melanogaster является типичным ДКП-ретротранспозо-ном, содержащим три открытые рамки считывания (ОРС). Наличие функционально актив-ной ОРСЗ, а также способность МДГ4 к горизонтальному пере-носу, позволяют отнести его к ретровирусам. Перемещения мобильных элементов являются важным фактором индивидуаль-ной изменчивости. Однако неконтролируемые транспозиции приводят к негативным послед-ствиям для организма. Поэтому в клетке существуют механизмы, подавляющие транспозиции. У D.melanogaster транспозиции. МДГ4 контролирует ген flamenco. Получены и охаракте-ризованы линии D.melanogaster, мутантные по гену flamenco, ко-торые характеризуются высокой частотой транспозиций МДГ4. Показано, что транспозиции МГЭ Idefixи ZAM контролиру-ются локусом СОМ (центр орга-низации мобилизации), который картирован на генетической кар-те в том же районе, где и ген flamenco. МГЭ Idefix, ZAM, Tirant, Nomad, 297, 17.6, Tirant— ретротранспо-зоны, имеющие сходное строе-ние с МДГ4, что позволяет пред-положить наличие единого гене-тического контроля транспози-ции данных элементов. Была поставлена серия экспериментов по выявлению различий в рас-пределении этой группы элемен-тов в геноме D.melanogaster. С помощью обратной ПЦР произ-водилась амплификация окру-жения ретротранспозонов в ли-ниях D.melanogasterс фенотипом flamenco+ и flamenco". Полиморфизм длин фрагментов, полученных при амплификации ДНК из разных линий, свиде-тельствовал о различном окру-жении исследуемого МГЭ, раз-личном распределении его копий в геноме, и, следовательно, об его транспозиции. Для подтверж-дения данных ПЦР ставили Сау-зерн блот-гибридизацию. В ходе эксперимента были выявлены различия в распределении у разных линий ретротранспозонов Idefixи ZAM, что позволяет сде-лать вывод об участии гена fla-menco в генетическом контроле транспозиции этих элементов. 14. БЕЛОК РекА. На начальной стадии иссле-дований в лаборатории А. Клар-ка в США был выделен и изучен набор мутантов с нарушениями рекомбинации (у них была по-давлена способность давать ре-комбинантное потомство при конъюгации и трансдукции). Свойства: -Нарушена способность к реком-бинации в той или иной степени -У большинства нарушена спо-собность к репарации повреж-дений в ДНК -У некоторых мутантов снижает-ся жизнеспособность -Некоторые мутации приводят к увеличению частоты мутагенеза С помощью этих мутантов, названных rec, были установле-ны соответствующие гены, а за-тем выделены рекомбинацион-ные белки, инактивированные у мутантов. МУТАЦИЯ rec A E. coli. Первая мутация. Получена Клар-ком и Маргулис в 1965 г. Полностью подавлена рекомби-нация. Резко повышена чувстви-тельность к ДНК-повреждающим агентам. С помощью этих мутан-тов, названных rec, были уста-новлены соответствующие гены, а затем выделены рекомбина-ционные белки, инактивирован-ные у мутантов. В условиях in vitro для проявле-ния всех активностей белка RecA требуются в качестве ко-факто-ров АТФ и одноцепочечная ДНК в любой форме, например дуп-лексная ДНК с концевыми (хвос-ты) или внутренними (бреши) одноцепочечными участками. Основное назначение белка RecA — приводить во взаимодействие одноцепочечную ДНК с гомоло-гичным дуплексом. Белок Rec A. Имеет массу 37 973 D. Содержится в количестве от 1000 до 10000 молекул. Его кол-во возрастает в 50 раз после УФ-облучения. Обладает рядом ак-тивностей, которые необходимы для рекомбинации. Может связываться с он и днДНК, обра-зуя длинные филаменты. Это позволяет ему встраивать онДНК в гомологичный район днДНК, за-мещая и вытесняя одну нить из дуплексной молекулы. Связы-вание RecA белка идет предпоч-тительно в одном нап-равлении и носит кооперативный характер. Молекулы белка соби-раются на ДНК по принципу "ко-нец-в-конец", образуя вокруг ДНК правозакрученную белко-вую спираль. В результате возни-кает нитевидное образование — RecA-ДНК-филамент. Белок RecA имеет два сайта связывания с ДНК. Первый сайт использу-ется для первичного связывания с ДНК: в присутствии АТФ бе-лок всегда взаимодействует в этом сайте с одноце-ной ДНК. Второй необходим для обнару-жения комплементарности. Взаимодействие филамента с ДНК осуществляется за счет второго сайта связывания RecA. Филаменты могут вступать в ре-комбинацию только с "голой", не находящейся в филаменте ДНК. Два филамента не рекомбиниру-ют друг с другом. Связывание с ДНК во втором сайте слабое. Из-за этого между филаментом и ДНК возникают лишь кратковре-менные контакты (соударения). Эти контакты становятся проч-ными только после встречи гомо-логичных последовательностей.
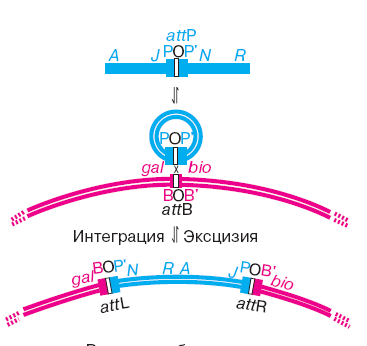
16,18. Атт сайты. Сайт специф мех. кросс attachment site att-сайт. Участок бактериальной хромосомы, в котором происходит интеграция ДНК профага; у E.coli Сайт присоединения к фагу лямбда расположен между оперонами gal и bio После инфекции в клетку Е. coli линейная вирионная двуцепочечная ДНК фага замыкается в кольцо за счет имеющихся на ее концах комплементарных одноцепочечных последовательностей. Интеграция происходит путем рекомбинации между особыми att сайтами: attP в хромосоме фага и attB в хромосоме бактерии. Профаг фланкирован рекомбинантными сайтами attL (левый) и attR (правый). Для катализа этой реакции необходимы четыре субъединицы интегразы, связанные в att-сайтах. Сайты attP. Размере около 270 п.н. он состоит из центральной части О и двух примыкающих к ней частей: Р и Р'. Внутри сайта attP располагаются участки связывания с интегразой и белками IHF и Xis. Сайт attB устроен проще. Его размер всего 23 п.н., гомология с attP ограничена центральной частью из 15 п.н., в которой имеются два сайта связывания с интегразой.
Вырезание (эксцизия) профага из хромосомы происходит в обратной последовательности событий. В интегративной рекомбинации участвуют сайты attP и attB, продукт фагового гена int (интеграза) и белок IHF (Integration Host Factor) E. coli. Для эксцизии необходимы сайты attL и attR, те же белки и еще продукт фагового гена xis. Интеграза; Делает разрыв в одной цепи каждого дуплекса, и в месте разрыва образуются З'-Р и 5'-ОН-концы ДНК. Фермент ковалентно связывается с З'-Р-концом, благодаря чему энергия разорванной фосфодиэфирной связи сохраняется, и для последующего замыкания разрыва, осуществляемого тем же ферментом, не требуется дополнительной энергии.Поэтому разрыв полинуклеотидной цепи, образуемый топоизомеразой, называют "временным" Интеграза является топоизомеразой типа I, но только сайт-специфической. Интеграза может осуществлять рекомбинацию между att-сайтами путем замыкания фосфодиэфирной связи с 5'-ОН-концом из другого дуплекса, то есть путем обменов 5'-ОН-концами. Интеграза производит обмен между двумя цепями одинаковой полярности. При этом разрыв и воссоединение цепей происходят между строго определенными нуклеотидами в центральной части att-сайтов Комплекс интегразы с attP-сайтом и белком IHF (Integration Host Factor) формирует сложно уложенную нуклеопротеидную структуру, которая захватывает сайт attB. В этой структуре att-сайты связываются за счет взаимодействий между субъединицами интегразы и затем подвергаются согласованному расщеплению. Интеграза делает разрыв в одной цепи каждого дуплекса, и в месте разрыва образуются З'-Р и 5'-ОН-концы ДНК.
|
2. Классификация типов гомологичной рекомбинации: аллельная, эктопическая и гомеологичная; реципрокная (кроссинговер) и нереципрокная (генная конверсия). 11. Клонирование фрагмента ОРС2 МДГ4, кодирующие интегразу Значительную часть генома эукариот составляют мобиль-ные генетические элементы (МГЭ). У Drosophila melanogaster на их долю приходится около 20% геном-ной ДНК. В последние годы ведутся активные исследования ретротран-спозонов D. melanogaster, относя-щиеся к группе gypsy. Эти ретро-транспозоны характеризуются нали-чием трех открытых рамок считы-вания (ОРС), гомологичных ретро-вирусным генам gag, pol и env. Отличие состоит лишь в том, что у ретротранспозонов неактивна ОРС3, продукт которой ответственен за проникновение ретровируса в клетку. Наиболее хорошо изученным представителем ретротранспозонов группы gypsy является МДГ4. Наличие у этого мобильного элемен-та ОРС3 и его способность прони-кать в интактные клетки, позволяет считать МДГ4 первым ретровиру-сом, обнаруженным у беспозвоноч-ных. Одним из ключевых ферментов, осуществляющих перемещение рет-ротранспозона, является интеграза, кодируемая ОРС2 на ряду с протеа-зой, обратной транскриптазой и РНКазой Н. В настоящей работе проведен струк-турно-функциональный анализ фраг-мента ОРС2 МДГ4, кодирующего интегразу. Фрагмент, кодирующий интегразу, был клонирован в клетках Escherichia coli. Клонирование проводили в экспрессионных векторах рЕТ. Для трансформации использовали штамм Rosetta, адаптированный для экспрессии эукариотических генов в клетках E.coli. В результате клонирования в векторе РЕТ32 был получен выделен белок в нерастворимой форме, что затрудняло дальнейшее исследова-ние его свойств. При повторном кло-нировании использовали плазмиду рЕТ30. В результате была получена растворимая форма белка интегразы. В настоящее время ведется исследо-вание ее активности.
8. Конверсия гена - нереципрокная гомологичая рекомбинация, основан-ная на коррекции неспаренных оснований в рекомбинационном гетеродуплексе. Первоначально термин "конверсия гена" применяли только к конкретному явлению — нарушению стандартного менделевского рас-щепления 2А:2а в тетрадах аскоспор у грибов-аскомицетов. Замечательной особенностью мейоза сумчатых грибов является то, что у них 4 продукта одного мейотичес-кого деления собраны вместе и рас-положены в определенном порядке. Упорядоченнное расположение га-мет в аске определяется тем, что оси веретен двух мейотических делений одинаково ориентированы, и поэто-му дочерние клетки располагаются рядом. У многих видов после двух мейотических делений каждая из га-мет делится еще и митотически, это приводит к тому, что общее число спор в аске возрастает до восьми. В результате 8 нитей ДНК, из которых состоял мейотический бивалент, оказываются расположенными в разных гаплоидных клетках, причем их расположение неслучайно. У грибов конверсия широко изучалась с помощью цветных мутаций, например окраски аскоспор у Ascobolus. Пример. У аскомицетного гриба A. immersus с неупорядоченными тетрадами при скрещивании светлых и темных аскоспор получали: расщепление не 1 к 1, а 3:1, т е в тетраде было 6 мугантных светлых 2 темные нормальные аскоспоры (ожидаемое менделевское расщепление должно быть 4 4 при скрещивании светлых и темных аскоспор. Еще более удивительным оказался вариант получения класса темных аскоспор при скрещивании светлых мугантных родитель. и два сайта локуса окраски аскоспор: если в норме гетерозиготная клетка а Ь /а Ь вступает в мейоз, среди продуктов мейоза оба аллеля гена будут представлены в соотношении, . 4 светлые 4 темные. Позже был предложен механизм конверсии генов: в ходе репликации ДНК происходит копирование с переменой матрицы. Оно и приведет к описанному выше расщеплению. Фактически происходит коррекция молекулярной гетерозиготы в результате нереципрок. Рекомбинац.
7.(9) Мобильные генетические элемен-ты. МДГ4 составляют существенную часть генома эукариот. На их долю у раз-личных организмов приходится от 10 до 90% всей геномной ДНК. У Dro-sophila melanogaster МГЭ занимают около 10% генома. Взаимодействия мобильных генетических элементов с геномом хозяина весьма сложны. Мобильные элементы могут встраи-ваться в кодирующие последователь-ности, нарушая их структурную це-лостность и, таким образом, функ-ционирование. Но этим влияние мо-бильных элементов не ограничивает-ся. Поскольку они содержат промо-торы и терминаторы транскрипции и трансляции, сайты полиаденилирова-ния, кэпирования и сплайсинга РНК, а также могут содержать разнообраз-ные регуляторные последовательности, такие как энхансеры, сайленсеры и инсуляторы, то даже если мобиль-ный элемент встроится не в экзон ге-на, а в интрон или даже вне рамки считывания гена, он все равно может сильно повлиять на его экспрессию. Считается, что в основном, в усло-виях стабильности среды обитания, перемещения мобильных элементов приводят к негативным последстви-ям. Однако, транспозиции мобиль-ных элементов полезны для популя-ции хозяина в условиях изменя-ющейся окружающей среды, так как они являются важным фактором эво-люции, участвуя в рекомбинацион-ных процессах. Мобильный элемент МДГ4 Drosophila melanogaster, из-вестный как gypsy, относится к клас-су ДКП-содержащих ретроэлемен-тов. Он использует РНК-интерме-диат для транспозиции, содержит три открытых рамки считывания, аналогичных ретровирусным генам gag, pol и env, и жизненный цикл его аналогичен ретровирусному. Недавно полученные данные о спо-собности МДГ4 образовывать вирус-ные частицы, а так же косвенные данные о его способности к горизон-тальному переносу, позволяют гово-рить об МДГ4 как об эндогенном ретровирусе беспозвоночных. Не-смотря на то, что ретровирусы и ретротранспозоны довольно давно являются объектом пристального внимания исследователей, взаимо-отношения на генетическом уровне между ретротранспозонами и рет-ровирусами и их хозяевами по-преж-нему являются загадкой. Поэтому обнаружение эндогенных ретровиру-сов, особенно так хорошо изученных как МДГ4, у дрозофилы, являющей-ся классическим модельным объек-том, открывает новые широкие гори-зонты для исследования генетичес-кого контроля со стороны хозяина за перемещением ретроэлементов. Спонтанные транспозиции мобиль-ных элементов происходят относи-тельно редко, с частотой, не превы-шающей 10"6, но в некоторых слу-чаях частота спонтанных переме-щений заметно выше. Повышение частоты перемещений может проис-7.(9) ходить у потомков от особых скре-щиваний (эффект получил название гибридного дисгенеза), либо в осо-бенных линиях, названных генети-чески нестабильными. При исследо-вании одной из таких линий (назва-ной MS, Mutator Strain) и стабильной линии SS (Stable Strain), из которой была получена линия MS, было об-наружено, что ретротранспозон МДГ4 имеет два четко различимых подсемейства, отличающихся транс-позиционной активностью в культу-ре клеток Drosophila hydei. Эти два варианта были условно названы «активным» и «неактивным». Активный» и «неактивный» вариан-ты МДГ4 различаются уже на уровне рестрикционных карт. «Активный» вариант содержит сайты рестрикции Hindlll (4483), МЫ (5335) и Clal (6939), не характерные для «неак-тивного» класса. Изучение распреде-ления двух подсемейств элемента в 21 линии дрозофилы показал, что «неактивный» вариант эволюционно более древний, поскольку он присут-ствует во всех исследованных лини-ях, в то время как «активный» вари-ант только в некоторых. Кроме того, по всей видимости, «активный» ва-риант получился из «неактивного» путем накопления точечных мута-ций. Так, рестрикционные сайты, от-личающие эти два варианта, накап-ливались в следующей последова-тельности: сначала сайт Mlul (5335), затем Clal (6939) и последним Hindlll (4483). Однако, в том же исследова-нии была обнаружена одна линия, которая содержала вариант МДГ4, несущий сайт рестрикции Hindlll, но не имевший сайтов Mlul и Clal(линия Г32). Исследование нетрадиционных копий МДГ4 в геноме линии Г32 представляет особый интерес, по-скольку возможно они образовались в результате рекомбинационных про-цессов и их исследование может про-лить свет на вопрос происхождения «активного» варианта МДГ4. 19. выделяются две больших подгруппы ретротранспозонов. Первой было дано название "истинные Gypsy". В нее входят шесть транспозонов: 17.6, 297, tom, TED и два Gypsy из D. melanogaster и D. virilis. Более того, эту подгруппу объединияет также общее строение генома, высокое сходство LTR и аминокислотных последовательностей всех трех ORF. При построении деревьев по всем доменам представители этой подгруппы кластеризуются вместе с относительно высоким сходством. Все это позволяет считать их подгруппой близко родственных последовательностей. хотя все хозяева транспозонов этой подгруппы относятся к насекомым, филогения "истинных Gypsy" транспозонов не совпадает с таксономией их хозяев. Вторая подгруппа представлена ретротранспозонами грибов и растений (del, IFG-7, ТуЗ-2, TF1-107, Cftl). Эта подгруппа заметно более гетерогенна и не обладает устойчивостью топологии внутри подгруппы для разных доменов, в отличие от "истинных Gypsy".Соответсвие транспозонов выделенных подгрупп определенным таксонам хозяев может бьпъ объяснено тремя способами: неполнотой данных (например, "истинные Gypsy" транспозоны грибов и растений существуют, но не секвенированы); синхронной эволюцией линий транспозонов и видов-хозяев (предки "истинных Gypsy" транспозонов отделились от предков Gypsy-транспозонов грибов и растений в составе геномов их хозяев в то же время, когда происходило разделение эукариот на царства); или существованием общих особенностей "молекулярной экологии" этих подгрупп транспозонов (полученных от общего предка подгруппы), обусловливающих ограничения потенциального спектра хозяев, заселяемых горизонтальным переносом.
|
4.Модели. Холлидея. Общая модель кроссинговера опуб-ликована в 1964 году американским генетиком Р. Холлидеем. Формирование стр-ры Х. 1.После репликации ДНК и удвоения хромосом наблюдается попарное сбли-жение сестринских хроматид гомоло-гичных хромосом с образованием бивалентов (т.е. конъюгация) 2. В каждой молекуле ДНК на двух сближенных гомологичных участках несестринских хроматид фермент ни-каза делает симметричные одноцепо-чечные разрезы. Разрывы происходят в цепях одинаковой полярности. Пер-вичные разрывы возникают в опреде-ленных сайтах ДНК 3. От точек первичных разрывов происходит обмен между дуплексами, который приводит к образованию крестообразной структуры – полухиаз-ма Холидея с гибридным районом, гетеродуплексом. Перемещение точки перекреста цепей в полухиазме вдоль рекомбинирующих дуплексов – «миг-рация ветвле-ния». От точки перекреста цепей происхо-дит расплетание исходных дуплексов и высвобождающиеся цепи тут же ренатурируют с комплемен-тарными цепями из гомологичных дуплексов. Это приводит к образованию и после-дующему удлинению гетеродуплекса - в этом биологический смысл миграции ветвления. Изомеризация - изменение структуры полухизм. Происходит за счет обыч-ного теплового движения. Еще одна изомеризация с поворотом одной из полухиазм вокруг точки перекреста на 180° приводит к образо-ванию второй изомерной формы структуры Холлидея. Для восстановления биспиральной структуры обеих молекул ДНК и за-вершения процесса их конъюгации, пересекающиеся цепи должны быть разрезаны. Модель Жостака (двухцепочечный разрыв-репарация) Этот промежуточный продукт разре-шается на конечные продукты реком-бинации под действием резольвазы, разрезающей полухиазмы либо в паре цепей, находящихся в точке перекреста, либо в интактной паре. Модель Мезельсона-Рэддинга. Всередине 70-х годов XX векаМ.Мезельсон и К. Рэддинг модифициро-вали модель Холлидея, предположив, что в начале рекомбинации гетеро-дуплексный участок образуется не на двух, а только на одной молекуле ДНК.
10. Опытами Мезельсона и Уэйгле (1961 г.) на бактериофаге лямбда было доказано, что рекомбинация связана с разрывом и последующим воссоединением молекул ДНК.
Мезельсон и Сталь показали, что если вырастить несколько поколений бактерий Escherichia coli в среде, богатой 15N или 14N, затем центрифугировать их ДНК в градиенте плотности хлористого цезия, то окажется, что более тяжёлая 15N-ДНК останавливается ближе ко дну центрифу-жной пробирки, чем 14N-ДНК. Для того чтобы установить механизм реп-ликации, E. coli, которые в течение нес-кольких поколений росли в 15N-содер-жащей среде (а значит их ДНК содержала только 15N) были перенесены в 14N-со-держащую среду, где им было позволено разделиться только один раз. Плотность выделенной из этих клеток ДНК оказалась больше плотности ДНК бактерий, выра-щенных в среде, богатой 14N, но меньше плотности ДНК бактерий, выращенных в 15N среде.Далее была проанализирована плотность ДНК второго поколения бакте-рий. Клетки второго поколения содержали примерно равные количества лёгких и гибридных ДНК. Этот факт позволил исключить гипотезу дисперсного меха-низма репликации 12. Гетеродуплексы, формирующиеся при гомеологичных обменах, содержат мно-жественные неспаренные основания, кото-рые служат мишенью для коррекционной системы. Действительно, в опыте in vitro было показано, что белки MutS и MutL E. coli связываются с рекомбинационным ге-теродуплексом, сформированным из цепей ДНК, дивергировавших на несколько про-центов их нуклеотидного состава, и пре-пятствуют рекомбинации путем подав-ления миграции ветвления. При скрещивании E. coli c сальмонеллой (дивергенция нуклеотидных последова-тельностей их ДНК составляет около 20%) частота генетических рекомбинантов сни-жается на четыре порядка по сравнению с внутривидовым скрещиванием. У мутантов с инактивацией белка MutS и/или MutL частота рекомбинантов воз-растает в 1—3 тыс. раз, что прямо указы-вает на снятие блока рекомбинации. Последний факт можно объяснить тем, что высокий уровень дивергенции сам по себе препятствует рекомбинации: для ре-комбинации необходимо, чтобы хотя бы в районе ее инициации имелся участок пол-ной гомологии, что является существен-ным ограничением. Создают искусственные гетеродуплексы, содержащие различные комбинации не-комплементарных оснований, вводят их в реципиентные клетки и прослеживают дальнейшую судьбу. Используя в качестве реципиентов клетки, несущие различные мутации по репарации и рекомбинации, выявляют (по неспособности к коррекции) гены, контролирующие исправление того или иного типа некомплементарных пар, и выясняют основные характеристики кон-версии. Например, Р. Фишель и др. (1988 год) вводили в клетки различных мутантов Е. coll искусственные гетеродуплексы, ко-торые содержали две группы неспаренных оснований, разделенные 1243 п.н. Кроме того, в их эксперименте цепи ДНК в гете-родуплексах были либо метилированы по аденину либо неметилированы. Оказалось, что независимо от метилированности цепей репарация происходила до репликации ДНК и при этом наблюдалась одновременная коррекция обеих неспаренных групп, то есть механизм репарации протяженных брешей был доминирующим. Если была метилирована одна из цепей, кокоррекции подвергалась неметилированная цепь. Процесс конт-ролировали все четыре гена системы MutHLSU. Если обе цепи были неметилированы, про-цесс также требовал продуктов всех четырех генов, но если обе цепи были ме-тилированы — только генов mutSw. mutU. Если гетерозиготная клетка А/а вступает в мейоз, то в норме среди про-дуктов мейоза оба аллеля гена А будут представлены в равном соотношении 2А : 2а. Однако если в районе хромосомы, где расположен ген А, произойдет кроссинго-вер, то сформи-руется гетеродуплекс А/а с локально не-спаренными основаниями, что может при-вести к конверсии гена А: ЗА: 1а или 1А: За. От исходных молекул в рекомбинацион-ный гетеродуплекс могут войти разные ал-лели, и тогда в нем возникнут неспарен-ные основания, которые локально нарушат структуру двойной спирали ДНК.Эти на-рушения узнаются специальными фер-ментными системами, работающими по типу эксцизионной репарации. Они прово-дят коррекцию неспаренных оснований в гетеродуплексе: удаляют неспаренное ос-нование в одной цепи ДНК и застраивают образующуюся брешь по матрице другого аллеля в комплементарной цепи, тем са-мым превращая (конвертируя) один ал-лель в другой.
5. .Классификация мобильных генетических элементов основана на различиях в их структуре и связанных с ней механизмах перемещения в геноме. представлены 3 классами. Класс I. ДНК-транспозоны или классические транспозоны К классу I относят МДГ, кодирующие фермент транспозазу, которая способна узнавать концы «своего» элемента и по этим концам вырезать его из хромосомы или встраивать в хромосомы генома хозяина. Такой механизм перемещения МГЭ получил название «ДНК–ДНКперемещение» . ДНК транспозоны первоначально были открыты у бактерий, но к настоящему времени обнаружены в геномах многих эукариот включая дрожжи, насекомых, червей, животных и человека. Транспозоны имеют небольшие размеры, ограничены с двух сторон короткими инвертированными повторами (ITR). Таким образом, ITR фланкируют открытую рамку считывания (ОRF), определяющую синтез транспозазы, которая необходима для перемещения элемента. ITR сближаются, узнаются транспозазой и точно отрезаются от соседних участков ДНК хозяина. Первичная структура ITR у разных семейств ДНК-транспозонов различна. Класс II. Ретротранспозоны. К этому классу относят элементы, которые в процессе своего перемещения сначала синтезируют цепь РНК, с которой затем с помощью фермента обратной транскриптазы синтезируется комплементарная цепь ДНК. После удвоения двуцепочечная ДНК способна встраиваться в различные районы хромосом хозяина. Такой способ встраивания получил название ДНК–РНК–ДНК механизма. Класс ретротранспозонов включает три подкласса: LTR-ретротранспозоны и ретровирусы, non-LTR-ретротранспозоны и ретроэлементы. Подкласс LTR-ретротранспозонов и ретровирусов. В подкласс LTR-ретротранспозонов Входят и ретровирусы, сходные снимипостроению. Центральные районы элементов этого подкласса с обоих концов фланкированы длинными терминальными повторами (LTR). Для каждого семейства характерны свои терминальные повторы. Они отличаются длиной, варьирующей в пределах от 250 до 500 п.о., и нуклеотидной последовательностью, которая обычно много консервативнее чем остальные части элемента. Основной чертой этих элементов является активная транскрипция РНК. Ретротранспозоны и ретровирусы содержат гены gag и pol, которые кодируют антигены групповой специфичности, обратную транскриптазу, рибонуклеазу и интегразу для обеспечения обратной транскрипции кДНК сРНК. Различия между семействами ретротранспозонов и ретровирусов связаны с геном env, который кодирует белок оболочки вирусов, давая вирусам возможность перемещаться между клетками. У ретротранспозонов с LTR имеются только остатки этого гена, что обусловливает их внедрение только в тот геном, из которого они были вырезаны. LTR-ретротранспозоны распространены в геномах практически всех эукариот: в ДНК растений, грибов, позвоночных и беспозвоночных животных. Подкласс non-LTR-ретротранспозонов или Ретропозонов относятся LINE-(long interspersed nuclear element) иSINE- (short interspersed nuclear element) элементы. Известно около 20 семейств элементов группы LINE, в частностиF, G, Doc, jockey, Helena, Het-A, TART у дрозофилы, L1 у млекопитающих, ingi у трипаносомыи cin4 у кукурузы и т. д. Длина полноразмерных ретропозонов составляет 3,5–8 т.п.н. Они обладают двумя рамками считывания (ORF), которые кодируют ферменты, необходимые для их перемещения. Основными продуктами ORF являются белок, а также эндонуклеаза и обратная транскриптаза. У ретропозонов в отличие от LTR ретротранспозонов процесс обратной транскрипции происходит на ядерной ДНК с использованием сайта-мишени в качестве праймера. Большинство ретропозонов не являются сайт-специфичными и могут мигрировать в очень большое число сайтов. Надсемейство ретроэлементов SINE включает короткие (около 300 п.н.). Они найдены в геномах человека, грызунов, рыб, лягушек, растений и насекомых. Для этого семейства характерно присутствие центрального района, повторяющего 3′-нетранслируемый участок элементов LINE. Подкласс ретроэлементов представляют собой необычный класс ретротранспозонов, которому присущи характеристики всех ретроэлементов. Они был впервые обнаружен в геноме Drosophila virilis как элемент, играющий основную роль в процессе гибридного дисгенеза. Как и у ретропозонов, у них часто прослеживается наличие усеченного 5′-конца и варьирующих по длине дупликаций сайтов-мишеней. С другой стороны, некоторые Из них имеют LTR либо в прямой, либо в инвертированной ориентации. Важным обстоятельством является то, что у всех элементов этого нового семейства найден классический интрон в гене, кодирующем обратную транскриптазу Класс III. Пассивные элементы типа fold-back К этому классу относят семейство элементов FB (fold-back). Размеры этих МГЭ варьируют от нескольких сотен до нескольких тысяч пар оснований. Длинные инвертированные повторы, расположенные наконцах FB-транспозонов, имеют достаточно сложную внутреннюю организацию из более мелких повторов, которые представляют собой тандемные копии простых последовательностей, разделенных длинными участками различающихся последовательностей.Такие элементы обнаружены у дрозофилы, растений. Было показано, что некоторые нестабильные мутации у дрозофилы были вызваны инсерциями FB
|