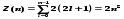- •1. Поступательное движение материальной точки. Скорость, ускорение (среднее, мгновенное). Уравнения движения при равноускоренном прямолинейном движении.
- •2. Вращательное движение (равномерное, неравномерное) материальной точки. Угловая скорость и ускорение. Связь между линейными и угловыми характеристиками движения
- •5. Момент силы, момент импульса материальной точки и системы материальных точек
- •6. Осевой момент инерции материальной точки и системы материальных точек. Теорема Штейнера
- •7. Основное уравнение динамики вращательного движения
- •8. Законы изменения и сохранения момента импульса
- •11. Гармонические колебания и их характеристики. Смещение, скорость и ускорение при гармоническом колебательном движении
- •12. Дифференциальное уравнение гармонических колебаний. Пружинный, математический и физический маятники
- •13. Энергия гармонических колебаний
- •14. Давление в неподвижной жидкости. Уравнение Бернулли
- •15. Идеальный газ. Основное уравнение молекулярно-кинетической теории газов
- •17. Круговые процессы. Кпд тепловой машины. Кпд теплового двигателя, работающего по обратимому циклу Карно
- •18. Второе начало термодинамики. Энтропия и II начало термодинамики
- •19. Взаимодействие электрических зарядов. Закон Кулона
- •20. Напряженность электрического поля. Принцип суперпозиции полей
- •22. Электрический диполь. Потенциал и напряженность поля диполя
- •24. Проводники в электростатическом иоле. Явление электростатической индукции
- •25. Электроемкость проводника. Конденсатор, его электроемкость
- •27. Обобщенный закон Ома в интегральной форме для участка цени и полной цепи
- •29. Магнитное поле электрического тока. Индукция и напряженность магнитного поля. Правило Ампера для расчета силы, действующей на проводник с током в магнитном поле
- •33. Явление электромагнитной индукции. Основной закон (Фарадея) электромагнитной индукции. Правило Ленца. Явления самоиндукции, взаимной индукции. Индуктивность
- •34. Трансформатор. Коэффициент трансформации
- •35. Генерация электромагнитных волн в пространстве
- •36. Электромагнитные колебания. Колебательный контур. Свободные электромагнитные колебания
- •37. Свободные затухающие колебания. Вынужденные электромагнитные колебания. Переменный ток
- •38. Уравнение световой волны. Когерентность и монохроматичность световых волн
- •39. Интерференция света. Интерференционная картина от двух когерентных источников
- •40. Явление дифракции света. Положения принципа Гюйгенса-Френеля. Дифракция Фраунгофера на щели и дифракционной решетке. Рентгеноструктурный анализ
- •41. Естественный и поляризованный свет. Виды поляризации. Двойное лучепреломление. Поляризация при отражении и преломлении света. Закон Брюстера
- •43. Единство волновых и корпускулярных свойств электромагнитного излучения. Гипотеза де-Бройля. Опытное обоснование корпускулярно-волнового дуализма веществ. Опыты Дэвиссона и Джермера
- •44. Волновая функция, ее статистический смысл. Соотношение неопределенностей Гейзенберга
- •45. Общее и стационарное уравнения Шредингера, их применение для решения физических задач
- •46. Резерфордовская модель строения атома. Модель Бора
- •47. Квантовомеханическое строение атома водорода. Энергетические уровни свободных атомов. Квантовые числа. Спин электрона. Принцип Паули
- •48. Энергетические зоны в кристаллах. Металлы, диэлектрики, полупроводники
- •49. Строение и основные характеристики атомных ядер. Ядерное взаимодействие. Дефект массы
- •50. Ядерные реакции. Деление ядер. Использование ядерной энергии
- •52. Фундаментальные взаимодействия. Элементарные частицы, их свойства
47. Квантовомеханическое строение атома водорода. Энергетические уровни свободных атомов. Квантовые числа. Спин электрона. Принцип Паули
Состояние
электрона в атоме водорода. Потенц/
энергия взаимодействия электрона с
ядром, обладающим зарядом Ze (для атома
водорода Z — 1),
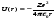 где г — расстояние между электроном и
ядром.
где г — расстояние между электроном и
ядром.
Стационарное
уравнение Шредингера для электрона в
атоме водорода
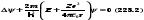 где m — масса электрона; Е — полная
энергия электрона в атоме. Энергия
электрона в атоме водорода
где m — масса электрона; Е — полная
энергия электрона в атоме. Энергия
электрона в атоме водорода
 Решения уравнения Шредингера непрерывны,
однозначны, и конечны в случаях: при
любых положительных значениях энергии
(соответствует свободному электрону)
Решения уравнения Шредингера непрерывны,
однозначны, и конечны в случаях: при
любых положительных значениях энергии
(соответствует свободному электрону)
при
дискретных отрицательных значениях
энергии (соответствует получаемых из
уравнения Шредингера собственным
значениям энергии) 2. Квантовые числа.
В квантовой механике доказывается, что
уравнению Шредингера (223.2) удовлетворяют
собственные функции
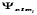 ,
опред. тремя квантовыми числами: главным
n,
орбитальным l
и магнитным
,
опред. тремя квантовыми числами: главным
n,
орбитальным l
и магнитным
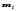 .
Главное квантовое число n, согласно
(223.3), опр. энергетические уровни электрона
в атоме и может принимать любые
целочисленные значения: n=1,2,3
.
Главное квантовое число n, согласно
(223.3), опр. энергетические уровни электрона
в атоме и может принимать любые
целочисленные значения: n=1,2,3
Орбитальное
квантовое число определяет, согласно
решению уравнения Шредингера, момент
импульса электрона в атоме.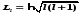 (223.4) где l—
орбитальное квантовое число, которое
при заданном п принимает значения
l=0,1,
. . . , ( n – 1), т.е. всего n значений. Магнитное
квантовое число n, опр., согласно решению
уравнения Шредингера, проекцию момента
импульса электрона на заданное
направление, причем вектор момента
импульса электрона в атоме может иметь
в пространстве
(223.4) где l—
орбитальное квантовое число, которое
при заданном п принимает значения
l=0,1,
. . . , ( n – 1), т.е. всего n значений. Магнитное
квантовое число n, опр., согласно решению
уравнения Шредингера, проекцию момента
импульса электрона на заданное
направление, причем вектор момента
импульса электрона в атоме может иметь
в пространстве
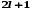 ориентации.
ориентации.
Спин
электрона. О.Штерн и В.Герлах, проводя
прямые измерения магнитных моментов,
обнаружили в 1922 г., что узкий пучок атомов
водорода, заведомо находящихся в
s-состоянии, в неоднородном магнитном
поле расщепляется на два пучка. В этом
состоянии момент импульса электрона
равен нулю. Магнитный момент атома,
связанный с орбитальным движением
электрона, пропорционален механическому
моменту, поэтому он равен нулю и магнитное
поле не должно оказывать влияния на
движение атомов водорода в основном
состоянии, т.е. расщепления быть не
должно. Однако в дальнейшем при применении
спектральных приборов с большой
разрешающей способностью было доказано,
что спектральные линии атома водорода
обнаруживают тонкую структуру (являются
дублетами) даже в отсутствие магнитного
поля. Для объяснения тонкой структуры
спектральных линий, а также ряда других
трудностей в атомной физике американские
физики Д. Уленбек (1900 —1974) и С. Гаудсмит
(1902 - 1979) предположили, что электрон
обладает собственным неуничтожимым
механическим моментом импульса, не
связанным с движением электрона в
пространстве, — спином. Спин электрона
(и всех других микрочастиц) — квантовая
величина, у нее нет классического
аналога; это внутреннее неотъемлемое
свойство электрона, подобное его заряду
и массе. Если электрону приписывается
собственный механический момент им
пульса (спин) Ls, то ему соответствует
собственный магнитный момент pms. Согласно
общим выводам квантовой механики, спин
квантуется по закону
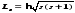 ,
где s — спиновое квантовое число. По
аналогии с орбитальным моментом импульса,
проекция Lsz спина квантуется так, что
вектор Ls может принимать 2s + 1 ориентации.
Принцип Паули. Распределение электронов
в атоме по состояниям
,
где s — спиновое квантовое число. По
аналогии с орбитальным моментом импульса,
проекция Lsz спина квантуется так, что
вектор Ls может принимать 2s + 1 ориентации.
Принцип Паули. Распределение электронов
в атоме по состояниям
Если
тождественные частицы имеют одинаковые
квантовые числа, то их волновая функция
симметрична относительно перестановки
частиц. Отсюда следует, что два одинаковых
фермиона, входящих в одну систему, не
могут находиться в одинаковых состояниях,
так как для фермионов волновая функция
должна быть антисимметричной. Обобщая
опытные данные, В. Паули сформулировал
принцип, согласно которому системы
фермионов встречаются в природе только
в состояниях, описываемых антисимметричными
волновыми функциями (квантово-механическая
формулировка принципа Паули). Из этого
положения вытекает более простая
формулировка принципа Паули, которая
и была введена им в квантовую теорию
(1925) еще до утверждения квантовой
механики: в системе одинаковых фермиоиов
любые два из них не могут одновременно
находиться в одном и том же состоянии.
Таким образом, принцип Паули утверждает,
что два электрона, связанные в одном и
том же атоме, различаются значениями
по крайней мере одного квантового числа.
Квантовое число ms может принимать лишь
два значения (±1/2). Поэтому максимальное
число электронов, находящихся в
состояниях, определяемых данным главным
квантовым числом, равно