
- •Лекция 7
- •7.1 Свойства растворов электролитов. Закон разведения Оствальда. Теория электролитической диссоциации Аррениуса.
- •7.2 Активность и коэффициент активности электролитов. Средняя ионная активность и средний ионный коэффициент активности
- •7.3. Понятие об электростатической теории сильных электролитов Дебая-Гюккеля. Правило ионной силы.
7.3. Понятие об электростатической теории сильных электролитов Дебая-Гюккеля. Правило ионной силы.
Средний
ионный коэффициент активности зависит
от концентрации раствора, эта зависимость
показана на рис. 3. В области предельно
разбавленных растворов электролитов
эта зависимость имеет линейный характер
в координатах ![]() .
.

Рис. 3. Зависимость среднего коэффициента активности ионов
от концентрации электролита
Присутствие в растворе
других солей изменяет коэффициент
активности данной соли и тем сильнее,
чем больше заряд добавляемых ионов.
Суммарное действие всех ионов в растворе
выражается через ионную
силу раствора
![]() ,
,
![]() , (24)
, (24)
где mi – концентрация i-ого иона; zi – заряд i-ого иона.
Зависимость среднего коэффициента активности ионов от ионной силы раствора имеет также аналогичный сложный характер и представлена на рис. 4.
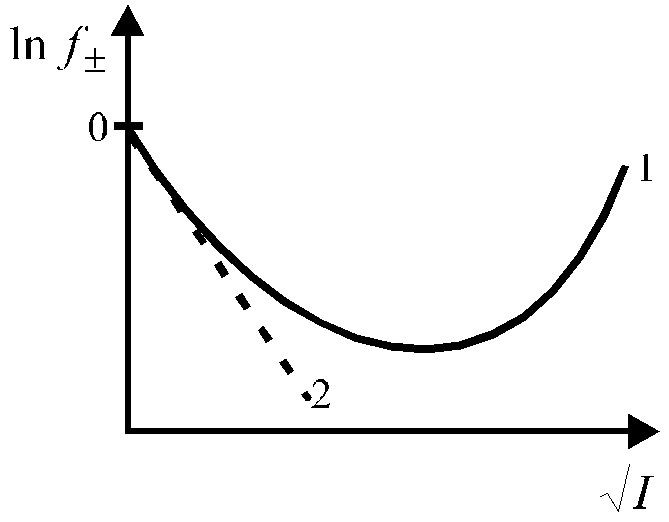
Рис. 4. Зависимость среднего коэффициента активности от ионной силы раствора.
Пример
2. Определить
ионную силу раствора, содержащего на
1000 г воды 0,01 моль
![]() и 0,1 моль
и 0,1 моль
![]() .
.
Решение. Ионная сила такого раствора равна
![]()
![]()
Пример
3. Определить
ионную силу раствора
![]() с
моляльностью m
= 0,5.
с
моляльностью m
= 0,5.
Решение. По уравнению (7.16) получаем
![]() .
.
Для растворов сильных электролитов выполняется правило ионной силы: в растворах с одинаковой ионной силой средние коэффициенты активности ионов равны.
Для теоретического расчета значений коэффициента активности f была предложена теория Дебая-Гюккеля. Она количественно учитывает ион-ионные взаимодействия и достаточно хорошо объясняет свойства разбавленных растворов сильных электролитов (=1).
В основе теории Дебая-Гюккеля лежат следующие предположения
электростатическое взаимодействие противоположно заряженных ионов приводит к тому, что вокруг положительных ионов вероятность нахождения отрицательных ионов будет больше, чем положительных.
между ионами имеет место кулоновское взаимодействие

вокруг каждого иона формируется ионная атмосфера из противоположно заряженных ионов. (Сфера, в которой преобладает заряд, противоположный по знаку центральному иону среды, и называется ионной атмосферой).
Теория сильных электролитов приводит к следующему соотношению, связывающему средние коэффициенты активности ионов с ионной силой раствора в области сильно разбавленных электролитов:
![]() , (25)
, (25)
где A = f (ε, T) – константа, зависящая от диэлектрической проницаемости растворителя () и температуры (T).
Уравнение (25) применимо лишь при очень больших разведениях (I ≤ 0,01, рис. 4), почему и получило название предельного закона Дебая-Гюккеля.
Кривая 1 (рис. 4) описывает экспериментальную зависимость коэффициента активности от ионной силы раствора, кривая 2 описывает эту зависимость в соответствии с предельным законом Дебая-Гюккеля.
Для водных растворов бинарных электролитов при 25С справедливо:
![]() . (26)
. (26)
