
- •Лекция 12
- •12.1 Поверхностные явления. Особенности коллоидного состояния вещества.
- •Свойства дисперсных систем разных типов
- •12.2 Граница раздела фаз. Поверхностное натяжение. Поверхностная энергия.
- •12.3 Явления смачивания и растекания, краевой угол.
- •12.5. Адсорбция. Поверхностно-активные и поверхностно-инактивные вещества. Уравнение адсорбции Гиббса.
12.5. Адсорбция. Поверхностно-активные и поверхностно-инактивные вещества. Уравнение адсорбции Гиббса.
Процессы поглощения газов или растворенных веществ твердыми материалами или жидкостями носят общее название сорбции.
Различают три основных вида сорбционных процессов: адсорбцию, абсорбцию, капиллярную конденсацию.
Абсорбцией называют поглощение газа или пара всем объемом твердого вещества или жидкости.
Капиллярная конденсация представляет собой процесс сжижения пара в порах твердого сорбента.
Если образующаяся жидкость хорошо смачивает стенки капилляров, т. е. поверхность твердого вещества, то в капиллярах образуется вогнутые мениски в результате слияния жидких адсорбционных слоев, возникающих на стенках капилляров. Над вогнутым мениском давление насыщенного пара понижено по сравнению с давлением насыщенного пара над плоской поверхностью при одной и той же температуре. Это явление приводит к тому, что в капиллярах пар начинает конденсироваться при более низком давлении, в то время как над плоской поверхностью конденсация еще не происходит.
Адсорбция – это самопроизвольное концентрирование вещества на твердой или жидкой поверхности раздела фаз.
Адсорбируемое вещество называется адсорбатом, а адсорбирующее – адсорбентом.
Наиболее применяемые адсорбенты – капиллярно-пористые тела, такие как цеолиты, активированные угли, силикагели, глины, торф.
Движущей силой адсорбции является избыточная поверхностная энергия на границе раздела фаз.
В зависимости от природы сил между адсорбентом и адсорбатом различают химическую и физическую адсорбцию. При химической адсорбции или хемосорбции образуются химические связи, а физическая адсорбция вызвана лишь ван-дер-ваальсовым взаимодействием. При повышении температуры физическая адсорбция понижается, так как при этом усиливается движение молекул в адсорбционном слое, нарушается ориентация адсорбированных молекул и усиливается десорбция. Нагревание повышает энергию адсорбирующихся молекул и соответственно усиливает химическую адсорбцию.
Рассмотрим системы жидкость-газ; жидкость-жидкость.
Для
характеристики адсорбции используют
полную
(абсолютную) адсорбцию
А,
которую выражают через количество
вещества, адсорбированного единицей
поверхности или массы адсорбента
(моль/см2,
г/см2,
моль/г, г/г), и удельную
(избыточную) или гиббсовскую
адсорбцию
Г,
которая характеризует избыток
адсорбированного компонента в
поверхностном слое по сравнению с его
количеством в объеме фазы, приходящийся
на единицу площади раздела фаз
![]() .
.
Изотермой адсорбции называется зависимость величины адсорбции от равновесного давления или концентрации адсорбата при постоянной температуре
![]() или
или
![]()
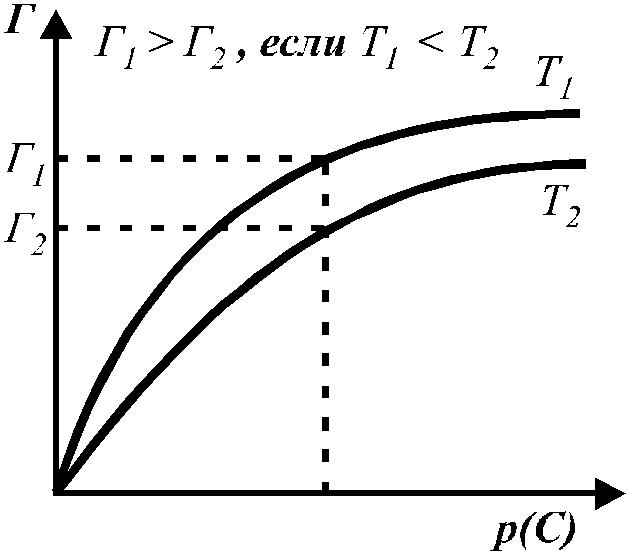
Рис. 3. Зависимость адсорбции Г от равновесного
давления (концентрации) и при различных температурах.
Следует отметить, что гиббсовская адсорбция Г бывает положительной и отрицательной.
В случае, если концентрация адсорбата в поверхностном слое больше его концентрации в объеме, то адсорбция положительна, а при концентрации адсорбата в поверхностном слое меньшей, чем концентрация в объеме, адсорбция отрицательна.
Прямых методов определения избытка растворенного вещества в адсорбционном слое пока не существует однако здесь можно точно измерить поверхностное натяжение. Поэтому очень важным в теории адсорбции является уравнение Гиббса, связывающее адсорбцию Г растворенного вещества с изменением поверхностного натяжения раствора:
d = Г d;
d – бесконечно малое изменение хим. потенциала адсорбируемого вещества.
= о + RT lna
d
= RT
dlna
= RT
![]()
![]()
При небольших значениях концентрации а с
![]() , (8)
, (8)
где С – равновесная концентрация вещества в растворе.
Область практического использования уравнения для определения величины адсорбции ограничена системами, для которых доступно экспериментальное измерение поверхностного натяжения, т. е. системами жидкость – газ и жидкость – жидкость.
Из уравнения Гиббса следует, что адсорбцию растворенного вещества можно определить по понижению поверхностного натяжения жидкости с ростом концентрации этого вещества в растворе.
Вещества,
понижающие поверхностное натяжение на
границе раздела фаз, называются
поверхностно – активными
(ПАВ),
для них![]() ,т. е. поверхностное
натяжение раствора по мере прибавления
ПАВ уменьшается и, следовательно,
адсорбция будет больше нуля. Это означает,
что концентрация ПАВ в поверхностном
слое больше, чем в объемной фазе. К ПАВ
относятся органические соединения с
несимметричным строением молекул,
состоящих из полярных и неполярных
групп. Полярная группа, имеет сродство
к полярной фазе. Полярными свойствами
обладают такие атомные группировки,
как –СООН, -ОН, -NН2,
-СНО, -SO2OH
и др. Все эти группы способны к гидратации
и являются гидрофильными. Неполярная
часть молекул ПАВ представляет собой
гидрофобную углеводородную цепь или
радикал.
,т. е. поверхностное
натяжение раствора по мере прибавления
ПАВ уменьшается и, следовательно,
адсорбция будет больше нуля. Это означает,
что концентрация ПАВ в поверхностном
слое больше, чем в объемной фазе. К ПАВ
относятся органические соединения с
несимметричным строением молекул,
состоящих из полярных и неполярных
групп. Полярная группа, имеет сродство
к полярной фазе. Полярными свойствами
обладают такие атомные группировки,
как –СООН, -ОН, -NН2,
-СНО, -SO2OH
и др. Все эти группы способны к гидратации
и являются гидрофильными. Неполярная
часть молекул ПАВ представляет собой
гидрофобную углеводородную цепь или
радикал.
Молекулы, в которых имеются гидрофильная и гидрофобная группировки называют дифильными.
Вещества, увеличивающие поверхностное натяжение на границе раздела фаз, называются поверхностно-инактивными (ПИВ).
Для них
![]() ,
,
т. е. поверхностное натяжение раствора по мере прибавления ПИВ увеличивается и, следовательно, адсорбция будет меньше нуля. Это означает, что такие вещества стремятся накапливаться в объемной фазе, а не на поверхности.
Если
![]() ,
то адсорбция будет равна нулю,
т. е.
концентрации растворенного вещества
на поверхности и в объеме равны.
,
то адсорбция будет равна нулю,
т. е.
концентрации растворенного вещества
на поверхности и в объеме равны.
Величина
![]() называетсяповерхностной
активностью
вещества.
называетсяповерхностной
активностью
вещества.
Она обозначается через G (в честь Гиббса).
![]()
Поверхностная активность – это мера способности вещества понижать поверхностное натяжение.
Для органических предельных спиртов и кислот в гомологических рядах соблюдается правило Дюкло – Траубе: увеличение цепи на одну СН2-группу увеличивает поверхностную активность гомолога в 3 – 3,5 раза в водном растворе.
Таким образом, для двух соседних гомологов можно записать
![]() . (9)
. (9)
Величину
![]() называюткоэффициентом
Траубе.
называюткоэффициентом
Траубе.
Зависимость поверхностного натяжения от концентрации водных растворов ПАВ хорошо описывается эмпирическим уравнением Шишковского
![]() , (10)
, (10)
где σ0 – поверхностное натяжение чистой воды, С – концентрация ПАВ, b и а – эмпирические постоянные, σ поверхностное натяжение раствора.
Для газов, растворов неэлектролитов и слабых электролитов адсорбция часто выражается эмпирическим уравнением Фрейндлиха:
![]() , (11)
, (11)
где С – равновесная концентрация, k и n – эмпирические константы.
