- •Содержание
- •Тема I. Строение атома
- •Тема II. Химическая связь
- •Тема III. Химическая термодинамика
- •Тема IV. Химическая кинетика и химическое
- •Тема V. Дисперсные системы
- •Тема VI. Основы электрохимии
- •6.2.1. Составьте схему гальванического элемента.
- •6.2.2. Запишите реакции, протекающие на катоде и аноде.
- •6.2.3. Рассчитайте эдс (ε0) гальванического элемента и δg0298 протекающей реакции.
- •6.3.1. Из раствора соли металла, при использовании растворимого анода.
- •6.3.2. Из раствора соли металла, при использовании нерастворимого анода.
- •6.3.3. Из расплава соли металла, при использовании растворимого анода.
- •Список литературы
Тема II. Химическая связь
Задание 2.1. Для двух, указанных по варианту молекул (табл. II.1), с позиций метода валентных связей показать образование молекул и ответить на следующие вопросы:
2.1.1. Каков тип гибридизации центрального атома в молекуле и валентный угол между связями?
2.1.2. Какова пространственная структура молекулы?
2.1.3. Сколько σ- и π-связей содержит молекула?
2.1.4. Определить полярность связей и полярность молекулы в целом.
Пример решения 2.1
Для ответа на вопросы задания рассмотрим молекулу CdI2.
2.1.1. Сначала определяем тип гибридизации центрального атома. Для этого выписываем валентные электроны центрального атома 48Cd.
5s
4d
4d![]()












З
5p


5s
4d









Таким образом, Cd предоставляет на связь два неспаренных электрона.
Далее выписываем валентные электроны йода.
5s
5p







У йода имеется один неспаренный электрон. Следовательно, согласно Льюису молекула CdI2 выглядит следующим образом:
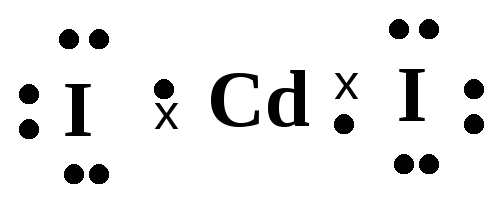 .
.
Далее изображаем молекулу CdI2 с использованием представлений о гибридизации орбиталей центрального атома.
Отмечаем, что у Cd имеются две внешние орбитали: s и р. Представим s- и р-орбитали на рис. 2.1.

Рис. 2.1
Таким образом, с одной р-орбиталью йода кадмий связывается с помощью s-орбитали, а с другой – с помощью р-орбитали. Так как связи отличаются по форме и энергии, то такая молекула не будет устойчивой. Для образования устойчивой молекулы в центральном атоме происходит процесс гибридизации валентных орбиталей, который показан на рис. 2.2.

Рис. 2.2
Гибридизация – процесс, в результате которого происходит перестройка валентных орбиталей центрального атома и образование смешанных гибридных орбиталей, одинаковых по форме и энергии.
Таким образом, при гибридизации s- и p-орбиталей образуются две равноценные sp-гибридные орбитали (s + p = 2sp). По аналогии: s + p + p = 3sp2, образуются три равноценные sp2-гибридные орбитали; s + p + p + p = 4sp3, образуются четыре равноценные sp3-гибридные орбитали.
Гибридные орбитали центрального атома располагаются под определенным углом (валентный угол), чтобы образовалась устойчивая молекула: при гибридизации типа sp валентный угол составляет 180 о; sp2 – 120 о; sp3 – 109 о. Расположение гибридных орбиталей под определенным углом показано в табл. 2.1.
Таблица 2.1
|
Тип гибридизации: |
sp |
sp2 |
sp3 |
|
Расположение гибридных орбиталей в простран-стве |
|
|
|
|
Теоретический валентный угол |
180 о |
120 о |
109 о |
В соответствии с данными табл. 2.1 в молекуле CdI2 реализуется sp-гибридизация, и валентный угол составляет 180 о.
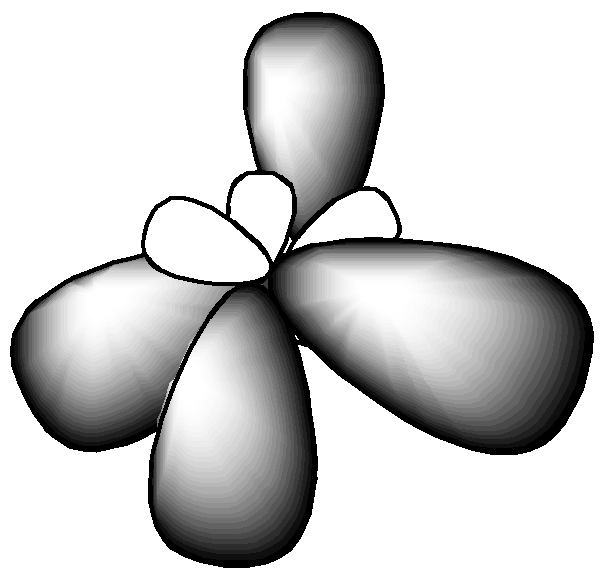
Чтобы изобразить молекулу в целом, остается показать перекрывание полученных гибридных орбиталей центрального атома с валентными орбиталями боковых атомов. В случае рассматриваемой молекулы CdI2 боковым атомом является 53I. Так как это р-элемент, то его валентные наружные электроны имеют орбиталь в виде гантели. В случае, если это будет s-элемент, то форма орбитали в виде шара.
"Подводя" валентные орбитали йода к гибридным орбиталям кадмия, получаем схему молекулы CdI2 (рис. 2.3).
I Cd I

Рис. 2.3
2.1.2. Разберем вопрос о пространственной структуре молекулы. Пространственная структура молекулы связана с типом гибридизации и расположением боковых атомов вокруг центрального атома (табл. 2.2).
Таблица 2.2
|
Тип гибри- дизации |
sp
|
sp2 |
sp3 |
sp3 |
sp3 |
|
Простран-ственная структура
|
|
|
|
|
|
|
Форма молекулы |
линейная |
треугольная |
тетраэдрическая |
пирамидальная |
угловая |
Как видно из табл. 2.2, при sp3 гибридизации может реализоваться тетраэдрическая форма, пирамидальная или угловая в зависимости от числа боковых атомов (4, 3, 2 – соответственно). В данном типе гибридизации могут оставаться неиспользованные орбитали, которые влияют на величину валентного угла.
Из рис. 2.3 следует, что рассматриваемая молекула CdI2 имеет линейную форму.
2.1.3. Теперь отметим наличие σ и π связей в молекуле. Если область перекрывания находится на оси связи, такая связь σ - типа (сигма тип), если область перекрывания расположена по обе стороны от оси связи – это π-тип (пи тип) ( рис. 2.4).




а) б) в)
σ - тип

π - тип
Рис. 2.4. Типы связей
Исходя из рисунка 2.3. делаем вывод, что в молекуле CdI2 две ковалентные связи σ-типа.
2.1.4. Определим полярность связи и молекулы в целом. Полярность связи обусловлена наличием диполя, образованного за счет оттягивания валентных электронов в сторону более электроотрицательного атома (Приложение 1). В связи Cd–I в молекуле CdI2 более электроотрицательным элементом является йод. Поэтому связь Cd–I является полярной.
Для определения полярности молекулы необходимо учитывать: а) полярность связи; б) пространственную структуру молекулы.
Молекула CdI2 неполярна, так как при наличии двух диполей оттягивание электронов идет в обе стороны одинаково, и дипольные моменты взаимно компенсируются.
Рассмотрим молекулу OF2.
Выписываем валентные электроны центрального атома – кислорода.
2р
2s





Далее надо перевести электроны в возбужденное состояние. Однако, на втором энергетическом уровне свободных орбиталей нет, поэтому распаривание электронов невозможно. Если в качестве центрального атома будет похожий элемент, но находящийся в третьем периоде, то для таких простых молекул, которые предлагаются в задании не следует при возбуждении переводить электроны с 3s и 3р на 3d, так как на это необходимы большие затраты энергии.
Так как у атома кислорода имеется два неспаренных электрона, то он может образовать две связи. Выписываем валентные электроны фтора: 2s22p5
2s
2p







У фтора имеется один неспаренный электрон. По представле-ниям Льюиса молекула OF2 может быть изображена следующим образом:
 .
.
Далее определяем тип гибридизации центрального атома – кислорода. Для этого производим "сложение": s + p + p + p = 4sp3. При этом не следует писать 2s или 2р, так как речь идет не об электронах (например, на 2s- подуровне), а их действительно 2, а об орбиталях, т.е. пространстве вероятного нахождения электронов. Рисуем четыре оси и гибридные облака. Подводим валентные орбитали F (это р-элемент). Получаем угловую молекулу с теоретическим валентным углом 109 о (рис. 2.5).
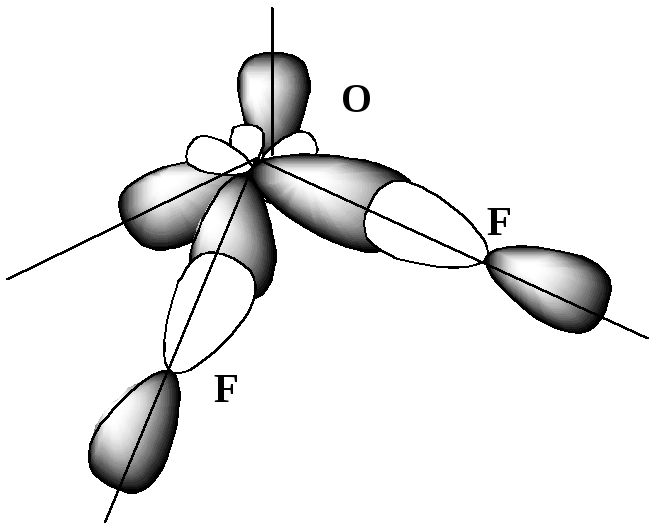
Рис. 2.5
Связи О–F – полярные, молекула в целом тоже полярна, так как в вершине угла заряд со знаком "+", а в противоположной стороне "-". Происходит оттягивание электронов в сторону F, т.е. образуется диполь. Две связи О–F – ковалентные, σ-типа.
Задание 2.2. Для двух приведенных комплексных соединений (табл. II. 3): определить степени окисления всех составляющих и указать комплексообразователь, лиганды, ионы внешней и внутренней сферы и координационное число.
Записать уравнение диссоциации комплексного соединения.
Пример решения 2.2
Решение данного задания рассмотрим на примере 2-х комплексных соединений: Na[Co(SCN)4(H2O)2] и [Fe(NH3)5(NO2)]Cl2.
Сначала проанализируем
состав комплексного соединения. В
комплексном соединении содержится
сложный комплексный ион, который показан
в квадратных скобках. Комплексный ион
состоит из комплексообразователя
и лигандов.
Комплексообразователь записывается
первым в квадратной скобке, а далее
следуют лиганды. Лигандами могут быть
как заряженные частицы: I![]() ,
Cl
,
Cl![]() ,
F
,
F![]() ,
NO
,
NO![]() ,
NO
,
NO![]() ,
OH
,
OH![]() ,
CN
,
CN![]() ,
SCN
,
SCN![]() ,
так и нейтральные молекулы: Н2О,
NH3.
Количество лигандов вокруг
комплексообразователя называется его
координационным
числом.
,
так и нейтральные молекулы: Н2О,
NH3.
Количество лигандов вокруг
комплексообразователя называется его
координационным
числом.
Комплексообразователь и лиганды связаны прочной ковалентной связью донорно-акцепторного типа. Комплексный ион является ионом внутренней сферы. Снаружи располагаются ионы внешней сферы. Ионы внешней и внутренней сферы связаны ионной связью.
Если сложный комплексный ион заряжен отрицательно, т.е. является анионом, то ион внешней сферы записывается слева, и комплекс называется анионным. Если комплексный ион заряжен положительно, т.е. представляет из себя катионный комплекс, то ион внешней сферы записывается справа. В некоторых соединениях ионы внешней сферы отсутствуют, тогда внутренняя сфера имеет нулевой заряд, такие комплексы называются нейтральными.
Учитывая степень
окисления комплексных ионов (в первом
соединении – [Co(SCN)4(H2O)2]1-,
а во втором – [Fe(NH3)5NO2]2+,
определяем, что первое соединение
содержит анионный, а второе – катионный
комплекс. Вокруг комплексообразователя
Со3+
расположены лиганды: (SCN)![]() и (Н2О)0,
их число равно 6, а вокруг Fe3+
– лиганды (NH3)0
и (NO2)–,
их число также равно 6. Ионами внешней
сферы в указанных соединениях являются
ионы Na+
и Cl
и (Н2О)0,
их число равно 6, а вокруг Fe3+
– лиганды (NH3)0
и (NO2)–,
их число также равно 6. Ионами внешней
сферы в указанных соединениях являются
ионы Na+
и Cl![]() соответственно. Исходя из вышесказанного
данные комплексные соединения могут
быть представлены следующими схемами
(рис. 2.6 а, 2.6 б):
соответственно. Исходя из вышесказанного
данные комплексные соединения могут
быть представлены следующими схемами
(рис. 2.6 а, 2.6 б):
Ион
внешней
сферы
Комплексо-образователь



 Лиганды
Лиганды
Ион внутренней
сферы (комплекс-
ный ион)
Лиганды










Рис. 2.6 а. Схема комплексного соединения Na[Co(SCN)4(H2O)2] –
– диаквотетрароданокобальтат (III) натрия
Лиганды
Комплексо-образователь












Ион
внешней сферы
Ион
внешней сферы
Ион внутрен-ней
сферы
(комплексный
ион)
Лиганды




Рис. 2.6 б. Схема комплексного соединения [Fe(NH3)5 NO2]Cl2 –
– дихлорид нитритопентаамминожелеза (III)
Так как между ионами внешней и внутренней сферы действует слабая ионная связь, то в растворе под действием молекул воды эта связь разрывается, т.е. происходит диссоциация молекулы комплексного соединения на ионы внешней и внутренней сферы:
Na[Co(SCN)4(H2O)2]
![]() Na+
+ [Co(SCN)4(H2O)2]
Na+
+ [Co(SCN)4(H2O)2]![]() ;
;
[Fe(NH3)5NO2]Cl2
![]() [Fe(NH3)5NO2]2+
+ 2Cl
[Fe(NH3)5NO2]2+
+ 2Cl![]() .
.
Однако комплексный ион при этом сохраняет свою целостность. Комплекс перестает существовать, если разрывается внутренняя связь между комплексообразователем и лигандами.
Используя данную информацию, представим в виде табл. 2.3 характеристики двух комплексных соединений. Следует иметь в виду, что необходимо указывать все степени окисления частиц, составляющих данное соединение.
Заряд комплексообразователя определяют исходя из зарядов ионов внешней сферы, лигандов, их количества и нейтральности молекулы в целом. Определим заряд комплексообразователя для рассматриваемых комплексных соединений.
Na+[Cox(SCN)![]() (H2O)
(H2O)![]() ]
[Fex(NH3)
]
[Fex(NH3)![]() (NO
(NO![]() )–]Cl
)–]Cl![]()
1+ х + 4(-1) + 2·0 = 0 х + 0·5 + (-1) + (-1)·2 = 0
х = +3 х = +3
Следовательно, комплексообразователем в 1-ом соединении является Со3+, а во втором – Fe3+.
Таблица 2.3
|
Характеристики комплексного |
Формула комплексного соединения | |
|
соединения |
Na[Co(SCN)4(H2O)2] |
[Fe(NH3)5NO2]Cl2 |
|
Комплексное соединение с ука-занием степеней окисления всех частиц |
Na+[Cox(SCN)
|
[Fex(NH3)
|
|
Комплксообра- зователь |
Со3+ |
Fe2+ |
|
Лиганды |
SCN |
NH |
|
Координационное число |
4 + 2 = 6 |
5 + 1 = 6 |
|
Ионы внутренней сферы |
[Co(SCN)4(H2O)2] |
[Fe(NH3)5NO2]2+ |
|
Ионы внешней сферы |
Na+ |
Cl |
|
Уравнение диссоциации комплексного соединения |
Na[Co(SCN)4(H2O)2]
|
[Fe(NH3)5(NO2)]Cl2
|
Таблица II.1.
|
Номер варианта |
Формулы молекул | |
|
1 |
CaCl2 |
NF3 |
|
2 |
CdF2 |
PH3 |
|
3 |
CuCl2 |
SbBr3 |
|
4 |
MgBr2 |
AsCl3 |
|
5 |
ZnI2 |
H2S |
|
6 |
BeH2 |
SCl2 |
|
7 |
HgCl2 |
OF2 |
|
8 |
SrBr2 |
H2Se |
|
9 |
BCl3 |
H2Te |
|
10 |
AlH3 |
SF2 |
|
11 |
GaBr3 |
SiH4 |
|
12 |
CuF2 |
CH4 |
|
13 |
SrBr2 |
Cl2 |
|
14 |
CoCl2 |
GeH4 |
|
15 |
MgBr2 |
CH3Cl |
|
16 |
HgF2 |
SiCl4 |
|
17 |
CaBr2 |
CH2Cl2 |
|
18 |
CdCl2 |
SiF4 |
|
19 |
ZnF2 |
PbBr4 |
|
20 |
BeI2 |
PBr3 |
|
21 |
ZnCl2 |
SbCl3 |
|
22 |
CdH2 |
AsBr3 |
|
23 |
MgH2 |
SbF3 |
|
24 |
CaH2 |
SnCl4 |
|
25 |
SrH2 |
CF4 |
|
26 |
ZnBr2 |
CHCl3 |
|
27 |
GaH3 |
CCl4 |
|
28 |
AlH3 |
SnBr4 |
|
29 |
InCl3 |
H2Te |
|
30 |
ZnH2 |
PbCl4 |
Таблица II.2
|
Номер варианта |
Формулы комплексных соединений | |
|
1 |
K 2 [PtCl6] |
[Co(NH3)5SO4]NO3 |
|
2 |
Na2[Cu(CN)4] |
[Co(H2O)2(NH3)4]Cl2 |
|
3 |
(NH4)3[RhCl6] |
[Cr(H2O)4Cl2]Br |
|
4 |
K3[CoF6] |
[Pd(NH3)3Cl]Cl |
|
5 |
Na[Ag(NO3)2] |
[Pt(NH3)3Cl]Br |
|
6 |
K2[Cd(CN)4] |
[Co(NH3)5Br]SO4 |
|
7 |
Na3[V(SCN)6] |
[Pd(H2O)(NH3)2Cl]Cl |
|
8 |
K[Ag(CN)2] |
[Co(NH3)5H2O]Cl3 |
|
9 |
K4[Mn(CN)6] |
[Ti(H2O)4Br2]Br |
|
10 |
K2[NiCl4] |
[Cu(H2O)3OH]Cl |
|
11 |
(NH4)3[Fe(CN)6] |
[Hg2(H2O)OH]Cl |
|
12 |
H[AuCl4] |
[Co(NH3)5Cl]Cl2 |
|
13 |
K3[Al(OH)6] |
[Be(H2O)3OH]Cl |
|
14 |
K2[Zn(CN)4] |
[Ni(H2O)6]SO4 |
|
15 |
Na3[Co(NO2)6] |
[Pt(NH3)2(H2O)(OH)]NO3 |
|
16 |
Ba[Cr(NH3)2(SCN)4]2 |
[Cu(NH3)4](NO3)2 |
|
17 |
(NH4)2[Pt(OH)2Cl4] |
[Al(H2O)6]Cl3 |
|
18 |
K2[Co(NH3)2(NO2)4] |
[Zn(NH3)4]Cl2 |
|
19 |
K2[Pt(OH)5Cl] |
[Ag(NH3)2]NO3 |
|
20 |
Na2[IrCl6] |
[Cr(H2O)5(OH)]Cl2 |
|
21 |
K2[Zn(OH)4] |
[Fe(H2O)5NO2]SO4 |
|
22 |
Na[Al(OH)4(H2O)2] |
[Co(NH3)6]Cl3 |
|
23 |
K2[HgI4] |
[Ti(H2O)4(OH)2]Cl2 |
|
24 |
K2[Ni(CN)4] |
[Cr(NH3)2(H2O)4](NO3)3 |
|
25 |
Na2[Be(OH)4] |
[Cr(NH3)4(SCN)Cl](NO3)2 |
|
26 |
K4[Cd(OH)6] |
[Pt(NH3)2(H2O)2Br2]Cl2 |
|
27 |
Na[Cr(H2O)4Cl2] |
[Ag(NH3)2]Br |
|
28 |
K2[Fe(H2O)Cl5] |
[Ni(NH3)6](NO3)2 |
|
29 |
Na2[PtBr4] |
[Zn(NH3)2Cl]Cl |
|
30 |
K[PtNH3Cl3] |
[Fe(H2O)6]Cl3 |