
Экспериментальная часть.
Опыт 1. Влияние среды на смещение химического равновесия.
Ход работы.
В пробирку внёс 5-6 капель раствора дихромата калия и прибавил столько же капель разбавленного раствора гидроксида натрия. Наблюдал изменение окраски - раствор стал желтого цвета. Затем к этому же раствору прибавлял раствор серной кислоты до тех пор, пока окраска раствора не стала прежней.
С начала при постепенном добавлении р-ра серной кислоты химическое равновесие смещается в сторону образования продуктов р-ции, т.к. концентрация хромата калия уменьшается.
Но при продолжительном добавлении кислоты хим. равновесие смещается в сторону исходн. веществ, т.к. понижается концентрация гидроксида натрия. Раствор меняет свой цвет на оранжевый, т.к. в нем повысилась концентрация дихромата натрия.
Но все это также объясняется тем, что при добавлении р-ра серной кислоты повышается концентрация ионов водородов, и поэтому хим. равновесие смещается в сторону исх. веществ.
0пыт 2. Влияние концентрации реагирующих веществ на смещение химического равновесия
Взаимодействие хлорида железа с роданидом калия или аммония
Ход работы.
В четыре пробирки по 5-7 капель внёс 0,2 н раствора хлорида железа (III) и роданида калия. Растворы размешал стеклянной палочкой и поставил в штатив. Одну пробирку с полученным раствором сохранил для сравнения результатов опыта. В остальные пробирки добавил следующие реактивы: в первую пробирку – 1 каплю насыщенного раствора хлорида железа (III), во вторую – 1 каплю насыщенного раствора роданида калия, в третью – несколько кристалликов хлорида калия. Сравнил интенсивность окраски полученных растворов с интенсивностью окраски эталона.
В исследуемом растворе при равновесии находятся р-ры хлорида железа (III), роданита калия, родонита железа (III) и хлорида калия.
Красную окраску раствору придает роданит железа (III).
При добавлении хлорида железа (III) раствор становится более темным и происходит смещение равновесия в сторону образования продуктов реакции. При добавлении роданита калия р-р тоже становится более темным и равновесие смещается в сторону образования продуктов реакции. При добавлении хлорида калия раствор светлеет и химическое равновесие смещается в сторону образования исходных продуктов.
Опыт 3. Влияние концентрации реагирующих веществ на скорость химической реакции
Взаимодействие иодата натрия с сульфитом натрия
Ход работы.
В двух сухих пробирках приготовил одинаковые объемы растворов иодата натрия различной концентрации. Для этого в первую пробирку внес 4 капли 0,02 н раствора иодата натрия и 12 капель дистиллированной воды. Во вторую пробирку - 8 капель этого же раствора и 8 капель воды. Таким образом концентрация иодата натрия во втором случае будет в 2 раза больше, чем в первом.
Приготовил восстановительную смесь, для чего 2 микрошпателя сульфата натрия внес в пробирку и растворил в 10 каплях воды. В раствор добавил 10 капель свежеприготовленного крахмала и 2 капли 1 н раствора серной кислоты. Смесь размешал стеклянной палочкой, включил секундомер, внес 2 капли восстановительной смеси в первую пробирку. По секундомеру измерил время от момента добавления восстановительной смеси до появления в растворе синей окраски.
Так же внес 2 капли восстановительной смеси в пробирку № 2, измеряя время по секундомеру. Сопоставил различие в концентрации иодата натрия с различием времени течения реакции (появление синей окраски в пробирках № 1 и № 2).

|
№ пробирки |
Число капель NaIO3 |
Число капель Н2О |
Число капель восста но-вителя |
Общий объем раст- вора |
Концен-трация NaIO3 |
Время тече ния реак- ции, сек |
Скорость реакции в у.е. |
|||
|
1 |
4 |
112 |
2 |
118 |
С |
4290 |
|
|||
|
2 |
8 |
18 |
2 |
118 |
2С |
480 |
|
|||
По таблице можно заметить, что скорость химической реакции в первой пробирке меньше чем во второй, т.к. концентрация йодата натрия в первой пробирке меньше, чем во второй.
Опыт 4. Влияние поверхности раздела реагирующих веществ на скорость реакции в гетерогенной системе.
Взаимодействие нитрата ртути (II) с иодитом калия
Ход работы.
Несколько кристалликов сухих солей нитрата ртути (II), иодита калия поместил в сухую пробирку, в другую пробирку насыпал приблизительное количество этих же веществ в виде мелкого порошка, энергично встряхнуть обе пробирки. Наблюдать появление окраски 6 следствие образования иодида ртути (II). Отметил различную скорость течения реакции.
Скорость химической реакции в данном случае зависит от площади поверхности реакции: при взаимодействии крупных кристаллов веществ реакция идет медленнее, чем при мелких кристаллах того же порошка.
Растворение карбоната кальция в хлороводородной кислоте
Ход работы.
Взял два небольших одинаковых кусочка мела. Один из них положил на фильтровальную бумагу и стеклянной палочкой измельчил его в порошок. Полученный порошок поместил в коническую пробирку. В обе пробирки одновременно добавил одинаковое количество (10-20 капель) хлороводородной кислоты (плотность 1,19 г/см3). Отметил время полного растворения мела в каждом случае.
Скорость растворения мела в данном случае зависит от площади поверхности реакции. Общая площадь поверхности измельченного порошка больше , чем площадь целого кусочка мела. Поэтому скорость реакции в пробирке с порошком больше, чем в пробирке с кусочком.
Опыт5. Влияние катализаторов на скорость реакции.
Каталитическое восстановление железа (III).
Ход работы.
В
две пробирки внес 10 капель 0,5 н раствора
роданида калия и по 1 капле 0,5
н раствора
хлорида железа (III). Наблюдал изменение
цвета р-ра. В одну пробирку добавил 1
каплю 1 н раствора нитрата меди. В обе
пробирки внес по 10 капель тиосульфата
натрия. Наблюдал различную скорость
обесцвечивания растворов, которое
происходит вследствие восстановления
железа (III) до железа (II) тиосульфатом
натрия (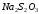 ).
).
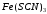 имеет красную
окраску.
имеет красную
окраску.
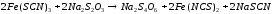
Добавление в одну из пробирок нитрата меди привело к увеличению скорости реакции. Значит, в данном случае нитрат меди сыграл роль катализатора в этой реакции.
Вывод: в результате проделанных опытов я научился влиять на смещение химического равновесия с помощью изменения среды, концентрации реагирующих веществ, влиять на скорость химической реакции с помощью изменения концентрации веществ, поверхности раздела реагирующих веществ и с помощью применения катализатора; а также экспериментально изучил принцип Ле-Шателье.
