
1-4 пример оформления(возможны ошибки в лабе) / labor4az
.docxМинистерство образования и науки Российской Федерации
Федеральное государственное бюджетное образовательное учреждение
высшего профессионального образования
«Уфимский государственный нефтяной технический университет»
Филиал ФГБОУ ВПО УГНТУ в г. Салавате
Общая и неорганическая химия
Отчет по лабораторной работе
«Скорость химических реакций. Химическое равновесие.»
ХТП - 240100.65 - 1.04.00 ЛР
Исполнитель:
студент гр. БТП-12-22 А. Ф. Фарвазов
Руководитель:
доцент Р. Р. Вахидов
Салават 2012
Цель работы: Определить, как изменяется химическое равновесие в зависимости от условий проведения опыта.
-
Экспериментальная часть.
Опыт 1: Влияние среды на смещение химического равновесия
В пробирку внесли 5-6 капель раствора дихромата калия (цвет оранжевый) и прибавили столько же капель разбавленного раствора гидроксида натрия. Наблюдали переход окраски из оранжевого в желтый цвет.
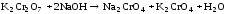
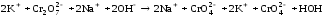
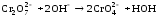
Затем к этому же раствору по каплям прибавляли раствор серной кислоты до тех пор, пока окраска раствора станет прежней.
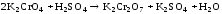
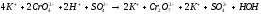
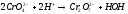
Вывод:
При добавлении разбавленного раствора гидроксида натрия концентрация ионов водорода снижается, следовательно, равновесие сместится в левую сторону(в сторону исходных веществ). При добавлении раствора серной кислоты, наоборот, концентрация ионов водорода повышается, следовательно, равновесие сместится в правую сторону(в сторону продуктов реакции).
Опыт 2: Влияние концентрации реагирующих веществ на смещение химического равновесия
В четыре пробирки по 5-7 капель внесли 0,2 n раствора хлорида железа (III) и роданида калия или аммония. Растворы размешали стеклянной палочкой и поставили в штатив. Одну пробирку с полученным раствором сохранили для сравнения результатов опыта. В остальные пробирки добавили следующие реактивы: в первую пробирку – 1 каплю насыщенного раствора хлорида железа (III), во вторую – 1 каплю насыщенного раствора роданида калия или аммония, в третью – несколько кристалликов хлорида калия. Сравнили интенсивность окраски полученных растворов с интенсивностью окраски эталона.
FeCl3 + 3KSCN ↔ Fe (SCN) 3 + 3KCl
Прозрачный Прозрачный Алый
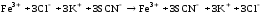
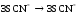
Роданид калия придает веществу красную окраску. При добавлении растворов в пробирки получились следующие окраски: в первой пробирке – темно-красная окраска, во второй – багровая окраска, в третьей – светло-красная окраска. Раствор в эталонной пробирке имеет красный цвет.
Вывод:
Повышение концентрации исходных веществ смещает реакцию в сторону продуктов реакции, причём повышение концентрации хлорида железа смещает реакцию вправо сильнее, чем повышение концентрации роданида калия, так как в молярном отношении они относятся как 1:3. Повышение концентрации продуктов реакции смещает равновесие в сторону обратной реакции.
Опыт 3. Влияние концентрации реагирующих веществ на скорость химической реакции
В двух сухих пробирках приготовить одинаковые объемы растворов иодата натрия различной концентрации. Для этого в первую пробирку внести 4 капли 0,02 н раствора иодата натрия и 12 капель дистиллированной воды. Во вторую пробирку 8 капель этого же раствора и 8 капель воды. Таким образом, концентрация иодата натрия во втором случае будет в 2 раза больше, чем в первом.
Приготовить восстановительную смесь, для чего 2 микрошпателя сульфита натрия внести в пробирку и растворить в 10 каплях воды. В раствор добавить 10 капель свежеприготовленного крахмала и 2 капли 1 н раствора серной кислоты. Смесь размешать стеклянной палочкой, включить секундомер, внести 2 капли восстановительной смеси в первую пробирку. По секундомеру измерить время от момента добавления восстановительной смеси до появления в растворе синей окраски.
Так же внести 2 капли восстановительной смеси в пробирку № 2, измеряя время по секундомеру. Сопоставить различие в концентрации иодата натрия с различием времени течения реакции (появление синей окраски в пробирках № 1 и 2).



|
Номер пробирки |
Число капель NaIO3 |
Число капель Н2О |
Число капель вос-ля |
Общий объем раствора |
Концен-- трация Na2SO3 |
Время течения реакции |
Скор-ь реак-и в у.е. |
1/τ, с |
|
1 |
4 |
12 |
2 |
18 |
С |
|
|
|
|
2 |
8 |
8 |
2 |
18 |
2С |
|
|
|
Вывод: С увеличением концентрации скорость реакции увеличилась, протекала быстрее. С понижением концентрации скорость реакции уменьшилась, протекала медленнее, чем там, где увеличили концентрацию. Протекает быстрее, потому что больше катализаторов.
Опыт 4: Влияние поверхности раздела реагирующих веществ на скорость химической реакции в гетерогенной системе.
Взаимодействие нитрата ртути с иодитом калия.
Несколько кристалликов сухих солей нитрата ртути (II), иодита калия поместить в сухую пробирку, в другую пробирку насыпать приблизительное количество этих же веществ в виде мелкого порошка, энергично встряхнуть обе пробирки. Наблюдать появление окраски вследствие образования иодида ртути (II). Отметить различную скорость течения реакции.
Hg(NО3)2+2KI=HgI2+2KNО3
Вывод: Образуется раствор красного цвета. Где кристаллики были покрупнее, реакция шла медленно. Причина в том, что реакция между нитратом ртути(II) и иодитом калия идет только на поверхности контакта кристалликов с раствором(граница раздела фаз),а общая поверхность у нескольких мелких гранул(порошка) больше, чем у одной крупной гранулы той же массы.
Растворение карбоната кальция в хлороводородной кислоте.
Взяли два небольших, по возможности, одинаковых кусочка мела. Один из них положили на фильтровальную бумагу и стеклянной палочкой измельчили его в порошок. Полученный порошок поместили в коническую пробирку. В обе пробирки одновременно добавили одинаковое количество (10-20 капель) хлороводородной кислоты (плотность 1,19 г/см3).
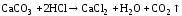
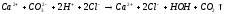
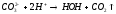
Целый кусочек мела растворился за 8 мин, а порошок за 4 мин.
Вывод:
Скорость растворения мела в двух пробирках различная, потому что площади соприкосновения реагирующих веществ различны (у порошка площадь соприкосновения во много раз больше, поэтому реакция проходит быстрее и активнее).
Опыт 5: Влияние катализаторов на скорость реакции.
Каталитическое восстановление железа(3).
В две пробирки внесли 10 капель 0,5 n раствора роданида калия или аммония и по 1 капле 0,5 n раствора хлорида железа (III). Наблюдали окраску раствора в красный цвет.
FeCl3 + 3KSСN → Fe (SCN) 3 + 3KCl
Прозрачный Прозрачный Красный
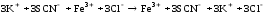

Раствор станет красным.
В одну пробирку добавили 1 каплю 1 n раствора сульфата меди. В обе пробирки внесли по 10 капель тиосульфата натрия. Наблюдать различную скорость обесцвечивания растворов, которое происходит вследствие восстановления железа (III) до железа (II) тиосульфатом натрия.
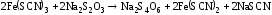
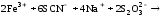
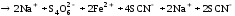
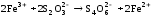
Вывод:
Пробирка с сульфатом меди сразу обесцветилась, а без него только через некоторое время, так как сульфат меди сыграл роль катализатора.
Вопросы и задачи:
Задание 1
а)
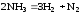
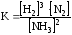
Влево(в сторону исход.вещ.)
б)
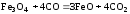
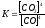
Не изменится
в)
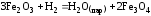
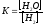
Не изменится
г)

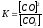
Влево(в сторону исход.вещ.)
Задание 2
а)
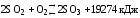
При понижение температуры – Вправо(в сторону прод. реак.). При понижении давления – Влево(в сторону исход.вещ.).
б)
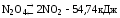
При понижении температуры - Влево(в сторону прод. реак.). При понижении давления – Вправо(в сторону исход.вещ.).
Задание 3
а)

Сместится вправо при повышении температуры и понижении давления.
б)
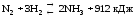
Сместится вправо при понижении температуры и увеличения давления.
Задание 4
Обратимые реакции:
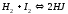
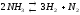
Необратимые реакции:
CaCO3 + 2HCl → CaCl2 + H2O + CO2↑
BaCl2 + H2SO4 → BaSO4↓ + 2HCl
Задание 5
Химическое равновесие называют динамическим, потому что в обратимых процессах прямая и обратная реакции не прекращаются.
Задание 6
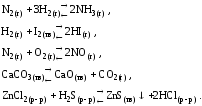
1)
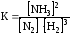
уменьшение концентрации аммиака, увеличение концентрации водорода или азота, увеличение давления
2)
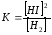
увеличение концентрации водорода или йода, уменьшение концентрации HJ, уменьшение давления
3)

увеличение концентрации азота или кислорода, уменьшение концентрации NO
4)

увеличение концентрации карбоната кальция, уменьшение концентрации CaO или CO2
5)
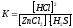
увеличение концентрации хлорида цинка или сероводорода, уменьшение концентрации ZnS или HCl
