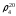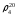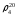ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ.
Опыт 1. Приготовление раствора заданной концентрации из навески.
Этот способ применяется главным образом для приготовления растворов солей.
Ход работы.
1. Рассчитал количество вещества, необходимое для приготовления раствора заданной концентрации.
Взвесил его на технических весах.
3. Рассчитал необходимое количество воды (исходя из массы соли и концентрации соли).
4. Взял плоскодонную колбу и через воронку осторожно перенес в нее навеску соли. Воду,
необходимую для приготовления раствора, вылил через воронку в колбу небольшими порциями так, чтобы всю соль с воронки смыть в колбу. Перелил полученный раствор в мерный цилиндр.
5. Измерил плотность полученного раствора ареометром. Затем вынул ареометр и промыл его под водопроводной водой.
Вывод: в результате проделанной работы я научился приготавливать раствор заданной концентрации из навески, пользоваться ареометром и вычислять с помощью него приблизительную плотность раствора.
Опыт 2. Определение процентной (масс) концентрации раствора и пересчет её на молярную и процентную концентрацию.
Ход работы.
1. В стеклянный цилиндр с раствором соли (NH4Cl) плавно опустил ареометр так, чтобы он не касался стенок сосуда. Определил примерную плотность.
2. По таблице 2. нашел процентную концентрацию по уравнению
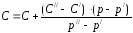
где
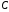 – процентная концентрация,
– процентная концентрация,
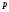 – плотность
раствора,
– плотность
раствора,
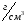
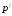 – ближайшее
меньшее значение плотности в таблице,
– ближайшее
меньшее значение плотности в таблице,
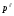 – ближайшее
большее значение плотности в таблице,
– ближайшее
большее значение плотности в таблице,
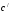 – %
– концентрация раствора с плотностью,
– %
– концентрация раствора с плотностью,
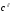 – %
– концентрация раствора с плотностью.
– %
– концентрация раствора с плотностью.
3. По рассчитанной процентной концентрации определил молярность и нормальность раствора.

где
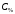 – рассчитанная процентная концентрация
соли,
– рассчитанная процентная концентрация
соли,
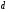 – соответствующая
плотность,
– соответствующая
плотность,
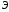 – значение
эквивалента соли,
– значение
эквивалента соли,
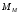 – молярная
масса соли.
– молярная
масса соли.
Таблица 2.
|
NaCl |
KCl |
NH4Cl |
CuSO4 |
NaNO3 |
|||||||||
|
1 |
2 |
3 |
4 |
5 |
|||||||||
|
|
% масс |
|
% масс |
|
% масс |
|
% масс |
|
% масс |
||||
|
1,0053 1,0125 1,0268 1,0413 1,0559 1,0707 1,0857 1,1009 1,1162 1,1319 1,1478 |
1 2 4 6 8 10 12 14 16 18 20 |
1,0045 1,0108 1,0239 1,0369 1,0500 1,0633 1,0768 1,0905 1,1043 1,1185 1,1323
|
1 2 4 6 8 10 12 14 16 18 20 |
1,0013 1,0045 1,0107 1,0168 1,0227 1,0286 1,0344 1,0401 1,0457 1,0512 1,0567
|
1 2 4 6 8 10 12 14 16 18 20 |
1,009 1,019 1,040 1,062 1,084 1,107 1,131 1,155 1,180 1,206 – |
1 2 4 6 8 10 12 14 16 18 20 |
1,0049 1,0117 1,0254 1,0392 1,0532 1,0674 1,0819 1,0967 1,1118 1,1272 1,1426 |
1 2 4 6 8 10 12 14 16 18 20 |
||||
Вывод: в результате проделанной работы я научился высчитывать процентную концентрацию раствора и определять молярность и нормальность раствора, используя показания ареометра и некоторые табличные данные.