
1-4 пример оформления(возможны ошибки в лабе) / lab_rab_1
.docxЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Определение молекулярной массы кислорода проводится на приборе, изображённом на рисунке:
5

1 4
6 3
2
1-колба с водой; 2-химический стакан; 3-сифон; 4-зажим; 5- стеклянная трубка; 6-тугоплавкая пробирка.
Собрать прибор по рисунку. Колбу 1 залить водопроводной водой. В стакан 2 налить 50 мл воды. Заполнить сифон водой. Для этого через трубку 5 вдувать воздух в прибор при открытом зажиме 4, и, когда сифон заполнится водой, закрыть зажим 4.
В сухую пробирку 6 насыпать около 1г перманганата калия. Пробирку с содержимым взвесить на весах с точностью до 0,01 г. Проверить герметичность. Опустить конец сифона в стакан 2.
Открыв зажим 4, начать разложение соли, нагревая пробирку 6 слабым пламенем газовой горелки. Нагревание следует проводить весьма осторожно, периодически приближая и удаляя горелку от пробирки. При этом реакция разложения должна протекать не слишком интенсивно.
Когда в стакан 2 перекачается примерно 100-150 мл воды, прекратить нагревание, дать прибору охладится до комнатной температуры, после чего снова взвесить пробирку.
Измерить объём вытесненной воды в стакане (из измеренного количества вычесть ранее добавленные 50 мл воды ). Объём воды будет равен объёму полученного кислорода при температуре опыта.
Определить вес полученного кислорода по разности веса пробирки до и после опыта.
расчётная часть
1. Масса пробирки с содержимым до нагревания (г). m1=22,22г
2. Масса пробирки с содержимым после нагревания (г). m2=22г
3. Масса выделившегося кислорода (разность 1. и 2.) (г). m3=0,22г
4. Объём воды в стакане после опыта (мл ). V3=150 мл
5. Объём воды в стакане до опыта (мл ). V2=50 мл
6. Объём вытесненной воды, равный объёму выделившегося кислорода в условиях опыта ( разность 4. и 5.) (мл). V1=150 мл-50 мл=100 мл
7. Объём кислорода приведённый к нормальным условиям (мл).
 *22,4=0.154
мл
*22,4=0.154
мл
8.
Температура воздуха в лаборатории (0С)
t=21,5 +273K=294,5K
+273K=294,5K
9. Атмосферное давление (кПа). p1=97,4 кПа
10. Давление водяных паров при температуре опыта (кПа ) таблица 1. рв=2,565 кПа
11. Давление кислорода в колбе (разность 9. и 10.) (кПа). Объём кислорода, выделившегося во время опыта, определяется по формуле: p=97.4-2.565=94.835
V= ;
;

Молекулярную массу определяем по формуле Клайперона-Менделеева.
PV=
nRT;
так как n= ;
;
Подставив в искомое уравнение получим :
PV= RT;
отсюда M=
RT;
отсюда M= ;
;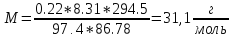
Вычислим
процент ошибки по формуле: %=
%=
где Дт - теоретические данные газа, Д - опытные данные газа.
Таблица 1.
Давление насыщенного пара воды при различной температуре
|
Темп-ра °С |
PВ, кПа |
темп-ра °С |
PВ, кПа |
|
15 16 17 18 19 20 |
1,70 1,81 1,93 2,06 2,20 2,34 |
21 22 23 24 25 100 |
2,49 2,64 2,81 2,99 3,17 101,325 |
Вопросы и задачи
-
Закон Авогадро, устанавливающий, что при нормальных условиях
( t=0°C, Р=101,31 кПа ), молекула любого вещества содержит одно и тоже число структурных единиц равных 6,02*1023 моль 1, а молекула газообразного вещества занимает объём равный 22,4 л.
Отношение массы определённого объёма газа к массе такого же объёма водорода, представляет собой плотность этого газа по-водороду, т.е.
Mr = 2Д(H2).
Молярную массу газа иногда вычисляют исходя из его плотности по воздуху, по формуле:
Mr = 29Двозд , где 29 - средняя молярная масса газов воздуха, определяемая из плотности воздуха по водороду.
Если же условия отличаются от нормальных, то расчёт относительных молекулярных масс, производят по уравнению Клапейрона-Менделеева.
-
Дано: Решение:
m=1г

T=273К

p=101,3кПа
M(H2)=2

R=8,31Дж/моль*K
M(CH4)=
16

V-?
M(NO2)=46

M(NO)=30

M(NH3)=17
M(O3)=48







Ответ:


 ;
;

-
Дано: Решение:
V=1м3

Vm=22.4


m-?
M(N2O)=44
M(SiF4)=104

M(SO2)=64

 =1964.28г
=1964.28г 2
кг
2
кг
 =4642.85г
=4642.85г
 5
кг
5
кг
 =2857г
=2857г 3кг
3кг
Ответ: 2
кг
2
кг

 5
кг
5
кг
 3кг
3кг
-
Дано: СИ Решение:
V=200
мг 2*10-4м3
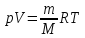
m=0,232
г

T=273
K

p=101,3кПа
M-?
Ответ:

5. Дано: СИ Решение:
V=20
л 0,02м3

T=25 298
K
298
K 
p=80
атм 8106000Па  ;
;

m(N2)-?

M(N2)=28
n=

Ответ: m(N2)=1,83кг
-
Дано: СИ Решение:
m=0,24
г 24*10-4кг

T=62 335
K
335
K

p=758 мм.рт.ст 101,325Па
V= 87мл 8,7*10-4м3
M-? 
M=
Ответ:
M=
-
Дано: СИ Решение:
V(возд)=1м3
 ;
;

V(CO2)=1м3

T(возд)=
290 К
 =
=
P(возд)=624
мм.рт.ст. 83,2 Па M(возд)=29

T(CO2)=300К m(возд)=n*M=0,03*29=1г
P(CO2)=1атм 101,32
Па
n(CO2)=
m(CO2)-?
M(СО2)=44
m(возд)-? 
m(СО2)=0,04*44=1,76г
Ответ: m(возд) =1г ; m(СО2)=1,76г
-
Дано: Решение:
T=290K 
p=101,3
Па M(возд)=29

m=1кг 
Ответ: V(возд)=0,8 л
-
Дано: СИ Решение:
V=20
мл 2*10-5
м3 
m=0,0268
г 2,68*10-5кг 
p=101, 3 Па
M-?
Ответ:
M=
M(NO2)=46
 ;
;

M(СO)=28
 ;
;

M(Сl2)=72
 ;
;

M(NO)=60
 ;
;

M(F2)=38
 ;
;

Ответ:
(NO2)
в
 ;
;
(СO)
в ;
;
(Сl2)
в
 ;
;
(NO)
в
 ;
;
(F2)
 .
.
Вывод: Я познакомилась с одним из методов определения молекулярной массы газа, рассчитала молекулярную массу кислорода. Сравнив, полученную молекулярную массу и теоретическую, я заметила небольшое различие, что связано с небольшой погрешностью в измерении. Процент в ошибки 2,8%.

