
- •1. Что такое катализ?
- •2. Каково значение каталитических процессов в химической промышленности?
- •3. Что происходит при каталитическом взаимодействии?
- •4. Какие факторы влияют на скорость каталитической реакции?
- •5 . Какие стадии составляют процесс гетерогенно-каталитического взаимодействия? Основные стадии гетерогенного каталитического процесса
- •6. Классификация процессов и реакторов по режиму протекания процесса.
- •7. Реакторы с неподвижным слоем катализатора.
- •8. Реакторы с кипящим слоем катализатора. Р еакторы с псевдоожиженным (кипящим) или восходящим слоем катализатора (рис. 1.5).
- •9. Классификация и химия катализаторов. Классификация катализаторов
- •10. Природа носителей для катализаторов.
- •11. Показатели качества гетерогенных катализаторов.
- •12. Технологические процессы по подготовке сырья и его переработке.
- •13. Технологические решения по управлению процессом для получения катализаторов. (кто придумал этот вопрос?)
- •14. Анализ качества катализаторов. (кто придумал этот вопрос?)
- •15. Методы анализа катализаторов. (кто придумал этот вопрос?)
- •16. Методы получения катализаторов с заданными свойствами. (кто придумал этот вопрос?)
- •17. Решение вопросов экологической безопасности при производстве катализаторов. (кто придумал этот вопрос?)
- •18. Каковы основные технические характеристики катализаторов?
- •19. Из каких основных компонентов состоят твердые катализаторы? Состав и пористая структура твердых катализаторов
- •20. Каковы основные характеристики пористой структуры контактных масс?
- •21. Как можно охарактеризовать материалы с губчатой, корпускулярной и смешанной структурой?
- •1. В чем различие монодисперсной и полидисперсной структур?
- •2. Какие процессы протекают при взаимодействии катализатора с реакционной средой?
- •Спекание
- •3. Какие факторы влияют на устойчивость катализатора во время работы?
- •5. Какие основные этапы включает производство контактных масс?
- •6. На какие группы можно разделить катализаторы по методам синтеза и приготовления?
- •7. Каковы особенности формования носителей и катализаторов?
- •8. В чем заключаются основные стадии производства осажденных контактных масс?
- •9. На чем основано получение катализаторов методом пропитки?
- •10. Каковы особенности метода пропитки?
- •1 1. Каковы основные принципы синтеза смешанных катализаторов?
- •1 2. В чем состоит сущность механохимической активации?
- •13. Каковы особенности получения плавленых и скелетных контактных масс?
- •14. Как получают катализаторы на основе цеолитов?
- •15. С какой целью производят исследования катализаторов?
- •16. Каковы основные принципы исследования состава катализаторов?
- •17. Какими методами определяют активность контактных масс?
- •18. В чем суть основных способов исследования пористой структуры катализаторов?
- •19. Как определяют истинную и кажущуюся плотности?
- •20. Какие исследования проводят для определения механической прочности катализаторов?
- •21. В чем заключается метод тпв?
- •1. Катализ и каталитические процессы в химической промышленности.
- •2. Сущность каталитического действия.
- •3. Классификация катализаторов по методам получения.
- •4. Формование носителей и катализаторов.
- •5. Основные факторы, влияющие на скорость каталитической реакции.
- •6. Основные стадии производства осажденных контактных масс.
- •7. Основные стадии процесса гетерогенно-каталитического взаимодействия. Основные стадии гетерогенного каталитического процесса
- •8. Получение катализаторов методом пропитки.
- •9. Влияние температуры на выход продукта в каталитических процессах.
- •1 0. Получение смешанных катализаторов.
- •11. Реакторы с неподвижным слоем катализатора.
- •1 2. Сущность механохимической активации.
- •1 3. Реакторы с кипящим слоем катализатора.
- •14. Получение плавленых и скелетных контактных масс.
- •15. Основные технические характеристики катализаторов.
- •16. Производство катализаторов на основе цеолитов.
- •17. Основные компоненты твердых катализаторов. Состав и пористая структура твердых катализаторов
- •18. Основные цели и задачи исследования катализаторов.
- •19. Пористая структура контактных масс.
- •20. Основные методы исследования состава катализаторов.
- •21. Материалы с губчатой, корпускулярной и смешанной структурой.
- •22. Методы определения активности контактных масс.
- •23. Монодисперные, бидисперсные и полидисперсные структуры.
- •24. Основные способы исследования пористой структуры катализаторов.
- •25. Взаимодействие катализатора с реакционной средой.
- •Спекание
- •26. Основные факторы, влияющие на устойчивость катализатора.
- •27. Определение механической прочности катализаторов.
- •28. Основные этапы производства контактных масс.
- •29. Метод термопрограммированного восстановления катализаторов.
- •30. Классификация катализаторов по методам получения.
- •31. Сущность каталитического действия.
- •32. Определение механической прочности катализаторов.
- •33. Основные этапы производства контактных масс.
- •34. Определение истинной и кажущейся плотности.
- •35. Основные стадии гетерогенного каталитического процесса. Основные стадии гетерогенного каталитического процесса
- •36. Каталитические реакторы для экзотермических каталитических реакций.
- •37. Определение удельной поверхности катализаторов методом бэт.
Контрольные вопросы к первой аттестации.
1. Что такое катализ?
Катализ - физическое явление изменения скорости химической реакции под влиянием веществ, нагреваемых катализатором.
2. Каково значение каталитических процессов в химической промышленности?
Катализ играет исключительную роль в осуществлении химических превращений в природе и в промышленности. В настоящее время в производстве более 30% продукции всей промышленности применяют катализаторы. Более 70 % важнейших химических продуктов получают с использованием каталитических процессов на той или иной технологической стадии.
Особенно велико и разнообразно применение катализа в технологии органических веществ, прежде всего в органическом синтезе - в процессах окисления, гидрирования, дегидрирования, гидратации, дегидратации и др. При помощи катализаторов получают основные полупродукты для синтеза высокополимеров. Непосредственное получение высокомолекулярных соединений полимеризацией и поликонденсацией мономеров также осуществляется с участием катализаторов. На применении катализаторов основаны многие методы переработки нефтепродуктов: каталитический крекинг, риформинг, изомеризация, ароматизация и алкилирование углеводородов. Жидкое моторное топливо из твердого (ожижение твердого топлива) получают при помощи катализаторов.
Большое количество катализаторов применяют при проведении процессов очистки отходящих газов промышленности и транспорта, загрязненных вредными примесями, для снижения негативного воздействия на окружающую природную среду.
3. Что происходит при каталитическом взаимодействии?
Катализатор вступает в реакцию с исходными веществами и направляет хим. реакцию по другому реакционному пути (механизму).
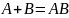

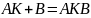
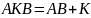
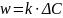 , где
, где
 – уравнение
Аррениуса;
– уравнение
Аррениуса;
 – константа скорости (увеличивается
при снижении
– константа скорости (увеличивается
при снижении
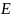 );
– энергия активации хим. реакции,
кДж/моль;
);
– энергия активации хим. реакции,
кДж/моль;
 – предэкспоненциальный множитель
(отражает количество соударений между
частицами);
– предэкспоненциальный множитель
(отражает количество соударений между
частицами);
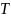 – температура, К;
– температура, К;
 .
.
КАТАЛИЗАТОР ПОНИЖАЕТ ЭНЕРГИЮ АКТИВАЦИИ.
4. Какие факторы влияют на скорость каталитической реакции?
 – движущая сила
процесса;
– движущая сила
процесса;
– константа скорости (увеличивается при снижении );
– энергия активации хим. реакции, кДж/моль;
– предэкспоненциальный множитель (отражает количество соударений между частицами);
– температура, К;
.
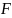 – поверхность
контакта
(площадь, на кот. происходит вся
гетерогенная реакция). В случае
каталитической реакции эта поверхность
постоянна.
– поверхность
контакта
(площадь, на кот. происходит вся
гетерогенная реакция). В случае
каталитической реакции эта поверхность
постоянна.
Чем больше поверхность, тем выше скорость реакции.
Скорость
гетерогенной реакции:
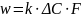
5 . Какие стадии составляют процесс гетерогенно-каталитического взаимодействия? Основные стадии гетерогенного каталитического процесса
Гетерогенно-каталитический процесс включает в себя ряд физических и химических стадий:
1) Диффузия частиц реагирующих веществ к внешней поверхности зёрен (гранул) катализатора (внешняя диффузия);
2) Диффузия частиц реагирующих веществ внутри пор к внутренней поверхности катализатора;
3) Активированная (химическая) адсорбция одного или нескольких реагентов на внутренней поверхности катализатора;
4) Перегруппировка атомов с образованием поверхностных соединений (комплекса) продукт-катализатор (химическая реакция с образованием продукта реакции, адсорбированного на поверхности);
5) Десорбция частиц продукта реакции с внутренней поверхности катализатора;
6) Диффузия частиц продукта реакции внутри пор катализатора и внешней поверхности частиц;
7) Диффузия частиц продукта реакции от внешних поверхностей катализатора в ядро потока.
Каждая из стадий протекает со своей скоростью, не равной скорости других стадий. Общая скорость всего процесса определяется (равна) скорости наиболее медленной стадии процесса. Сама эта стадия наз. лимитирующей.
