
- •5) Почему давление насыщенного пара зависит от формы поверхности жидкости?
- •6) Почему в случае смачивания капилляров жидкость в нем поднимается, а при не смачивании, наоборот, опускается?
- •7) Какие параметры используют для количественной характеристики адгезии и смачивания?
- •13) Что понимается под адсорбцией, абсорбцией, адсорбентом, адсорбатом, адсорбтивом?
- •14) В чём принципиальное отличие адсорбции на твёрдых поверхностях от адсорбции на поверхности жидкости?
- •15) Какие величины используют для количественного описания адсорбции? Дайте определение этих величин и покажите как их можно вычислить в общем виде?
- •16) Как можно рассчитать гиббсовскую адсорбцию по изотерме поверхностного натяжения.
- •17) Как можно определить параметры молекул пав ( и ).
- •18) У какой горячей или холодной воды на границе с воздухом больше поверхностное натяжение, и почему?
- •19) Какая жидкость лучше смачивает гидрофобную поверхность вода или бензол? Ответ аргументировать.
- •20) Почему процесс диспергирования твердых веществ легче происходит в присутствии пав?
- •21) Какие самопроизвольные процессы, протекающие в поверхностном слое, обусловлены уменьшением площади поверхности раздела фаз? Перечислите их и дайте характеристику.
- •22) Охарактеризуйте самопроизвольные процессы, протекающие в поверхностном слое, которые приводят к уменьшению поверхностного натяжения на границе раздела фаз?
- •2 9) Изобразите основные типы изотерм полимолекулярной адсорбции и опишите взаимодействие адсорбент-адсорбат для разных типов изотерм бэт.
- •30) Что понимается под поверхностной активностью? Как ее можно определить?
- •31) Каким процессом является адсорбция, экзотермическим или эндотермическим? Как на ее величину будет влиять повышение температуры и почему?
- •32) Назовите основные виды зависимости адсорбционного равновесия. Что понимается под состоянием адсорбционного равновесия?
- •3 4) Как осуществляется расчёт удельной поверхности адсорбента методом бэт?
- •35) В чем принципиальное отличие адсорбции из растворов электролитов от молекулярной адсорбции?
- •36) Как влияет собственный радиус иона на его способность к адсорбции?
- •37) Какие адсорбенты называют ионитами?
- •38) Дайте определение и назовите объекты исследования коллоидной химии.
- •39) Охарактеризуйте значение коллоидной химии для развития промышленности и охраны окружающей среды.
- •40) Основные признаки дисперсных систем – гетерофазность и дисперсность, какой из них является более универсальным? Почему?
- •41) Какие количественные характеристики дисперсности Вы знаете? Дайте их характеристику.
- •42) Перечислите основные признаки, положенные в основу классификации дисперсных систем.
- •43) Как будут ориентированы молекулы пав на границах раздела фаз: масло – вода и вода – воздух?
- •44) Почему в эмпирическом уравнении Шишковского константа «в» одинакова для всех соединений одного гомологического ряда?
- •45) Если из водного раствора нужно адсорбировать органические вещества, то какой следует выбрать адсорбент полярный или неполярный?
- •46) Для получения абсолютного спирта, то есть извлечения из спирта примесей воды какой следует выбрать адсорбент (полярный или неполярный)?
- •47) Изобразите каплю воды на гидрофобной поверхности и укажите краевой угол смачивания?
- •48) Каким определением поверхностного натяжения пользуются при выводе уравнения Лапласа?
- •49) Приведите вывод уравнения Лапласа и дайте его анализ.
- •50) В чем выражаются особенности адсорбции пав на твердой поверхности?
- •51) Какая поверхность будет лучше смачиваться водой: стекла или фторопласта?
- •52) Изобразите рисунки, которые необходимы для вывода уравнений для расчета работы когезии и адгезии. Каким определением поверхностного натяжения при этом нужно пользоваться?
- •53) Чем обусловлено броуновское движение частиц дисперсной фазы в жидкой или газообразной среде?
- •54) От каких факторов зависит интенсивность движения частиц дисперсной фазы в дисперсионной среде?
- •56) Что понимается под диффузией и от каких факторов зависит скорость диффузии? Каков физический смысл коэффициента диффузии?
- •58) Как можно увеличить скорость седиментации коллоидных частиц?
- •59) Что понимается под седиментационно-диффузионным равновесием? Каков физический смысл гипсометрической высоты (h)?
- •60) Какой заряд (положительный или отрицательный) в соответствии с правилом Кена приобретает поверхность волокон смоченной водой фильтровальной бумаги?
- •61) Составьте задачу, для решения которой нужно использовать правило Панета-Фаянса.
- •67) Почему электрофорез и электроосмос называют электрокинетическими явлениями 1-го рода, а потенциал протекания и потенциал седиментации явление 2-го рода?
- •68) Почему лиофильные системы обладают агрегативной устойчивостью и как можно разрушить лиофильную систему?
- •69) Почему лиофобные дисперсные системы являются термодинамически неустойчивыми? Перечислите факторы, которые обеспечивают агрегативную устойчивость лиофобных систем.
- •72) Какие закономерности наблюдаются при коагуляции золей смесью электролитов?
- •73) Какова природа сил притяжения в соответствии с теорией длфо? Изобразите график, иллюстрирующий зависимость этих сил от расстояния между частицами.
- •79) Как влияют на величину электрокинетического потенциала индифферентные электролиты? Какое состояние системы называется изоэлектрическим?
- •80) Что представляет собой релаксационный эффект, электрофоретическое торможение и поверхностная проводимость? Когда их нужно учитывать при расчете величины электрокинетического потенциала?
- •81) Что понимается под устойчивостью дисперсной системы? Назовите виды устойчивости и дайте их характеристику.
- •82) Что такое расклинивающее давление и каковы причины его возникновения? Назовите составляющие расклинивающего давления.
- •83) Что такое осмос? Каковы особенности осмотического давления в коллоидных растворах?
- •84) Чем обусловлено светорассеяние в дисперсных системах и истинных растворах? Какими параметрами количественно характеризуют рассеяние света в системе?
- •85) Что называется оптической плотностью и что она характеризует?
- •86) Каковы особенности рассеяния света для малых и больших частиц дисперсной фазы?
- •87) Что выражают диаграммы Ми?
- •88) Какую зависимость выражает закону Бугера-Ламберта-Бера?
- •89) Особенности адсорбции поверхностно-активных веществ и в чем заключается различие между гиббсовскими и ленгмюровскими адсорбционными слоями.
- •90) К каким системам молекулярно-дисперсным, гомогенным, коллоидно-дисперсным или лиофильным применимы понятия фаза и гетерогенность?
- •91) Как называются дисперсные системы при наличии или отсутствии в них взаимодействия между частицами дисперсной фазы?
- •92) Что представляет собой работа, затрачиваемая на обратимый разрыв тела и отнесенная к единице площади сечения?
- •94) В чем заключается инверсия смачивания и какое практическое значение она имеет?
- •95) Что такое обменная адсорбция? в чем заключается ее практическое значение? Объясните на примерах действие катионитов и анионитов.
- •96) Где находится практическое применение коллоидные поверхностно-активные вещества? в чем заключается механизм их моющего действия?
- •97) Чем отличаются коллоидные пав от истинно растворимых? Что называется критической концентрацией мицеллообразования ккм?
- •98) Какие существуют методы определения ккм? в чем заключается суть этих методов? Что общего между ними?
- •99) Что понимают под явлением солюбилизации? Чем оно обусловлено и каково практическое значение этого явления?
- •100) Можно ли очистить раствор коллоидного пав от ионов электролита с помощью диализа?
1) Что понимается под поверхностным натяжением и как оно зависит от природы веществ, образующих поверхность раздела фаз?
Есть два определения поверхностного натяжения
Термодинамическое - избыточная энергия на поверхности раздела двух фаз по сравнению с объемной фазой
Силовое - сила, которую нужно приложить над жидкостью, чтобы увеличить поверхность на единицу.
Зависит от полярности фаз, чем больше их различие, тем больше пов натяжение
2) Как и почему поверхностное натяжение зависит от температуры?
от T-уменьшение
межмолекулярных взаимодействий, т.к.
увеличивается расстояние можду молекулами
в результате возрастания теплового
движения молекул жидкости.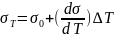 .линейно
убывает с ростом T
.линейно
убывает с ростом T
3) Каким образом
можно рассчитать полную ( )
поверхностную энергию?
)
поверхностную энергию?
Полная-работа,
затраченная на преодоление межмолекулярных
взаимодействий при переходе молекул
из объмной ф. в поверхность и теплотой
образование новой поверхности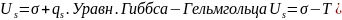 .
.
4) Что такое капиллярное давление? Каковы причины его возникновения?
Разность внутренних давлений по обе стороны искривленной поверхности раздела фаз (жидкость – пар или двух жидкостей) и есть капиллярное давление ΔР.
При изменении кривизны поверхности раздела фаз поверхностное натяжение вызывает изменение внутреннего давления в телах и создает добавочное давление. При равновесии системы, состоящей из фазы 1(жидкость) и 2 (газ), которые разделены искривленной границей раздела, внутренние давления в фазах неодинаковы по сравнению с плоской границей раздела фаз. Разность этих давлений называется капиллярным давлением.
5) Почему давление насыщенного пара зависит от формы поверхности жидкости?
Уравнение справедливо при r < 10-9м , так как только тогда не зависит от величины кривизны поверхности. Уравнение Кельвина (Томсона) выражает условия равновесия жидкости и пара при наличии между ними искривленной поверхности.
Таким образом, в призводственных условиях с увеличением дисперсности происходит увеличение площади реакционной поверхности, что не только благоприятно сказывается на производительности, но и позволяет снизить температуру процесса и удельный расход энергии. Существует оптимальное значение дисперсности порошков, когда взаимодействия происходят с наибольшей интенсивностью. С целью установления оптимальной дисперсности определяют величину удельной поверхности порошков.
Условия равновесной формы тела Равновесной формой тела, в соответствии с правилом Гиббса – Кюри, является та форма тела, которая обладает наименьшей поверхностной энергией Гиббса: ΔG = Σ σi ·Si = min при (V = const), где σi и Si – соответственно удельные поверхностные энергии и площади отдельных частей поверхности тела.
Следствия из уравнения Кельвина (Томсона):
● при положительной
кривизне отношение давления насыщенного
пара над искривленной поверхностью
(над каплей жидкости) больше, чем над
плоской поверхностью и тем больше, чем
меньше радиус капли, то есть больше
кривизна поверхности: ln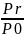 > 0 и Рr
> Р0;
> 0 и Рr
> Р0;
● при отрицательной кривизне отношение давления насыщенного пара над искривленной поверхностью (над каплей жидкости) меньше, чем над плоской поверхностью и тем меньше, чем больше радиус капли, то есть меньше кривизна поверхности: ln < 0 и Рr < Р0;
● если жидкость смачивает капилляр (кривизна отрицательная), то давление насыщенного пара в капилляре меньше, чем над плоской поверхностью, то есть конденсация паров происходит при меньшем давлении. Это явление называется капиллярной конденсацией, а уравнение Кельвина (Томсона) – это основное уравнение капиллярной конденсации.
Значение уравнения Кельвина (Томсона)
Зависимость давления насыщенного пара от кривизны поверхности жидкости играет важную роль в стабильности аэрозолей (туманов). В туманах всегда содержатся капли жидкости различных размеров. Давление насыщенного пара над мелкими и крупными каплями будет различно. Согласно закону Кельвина оно будет больше над мелкими каплями, по сравнению с давлением над крупными каплями. Разность давлений приводит к переносу молекул пара к крупным каплям с последующей конденсацией перенесенной массы. Этот процесс называют изотермической перегонкой. Кроме того уравнение Кельвина составляет основу фактически всех способов расчета распределения пор по размерам на основе изотерм адсорбции для адсорбентов с переходными порами с петлей капиллярно конденсационного гистерезиса.
6) Почему в случае смачивания капилляров жидкость в нем поднимается, а при не смачивании, наоборот, опускается?
Наиболее распространенный пример капиллярных явлений – это подъем или опускание жидкостей в узких трубках (капиллярах) и в пористых средах. Стенки капилляра смачиваются водой, кривизна мениска жидкости в капилляре отрицательная.
Капиллярные явления вызываются добавочным – капиллярным давлением. Рs – давление у искривленной поверхности жидкости; Ро - давление у плоской поверхности жидкости; r – радиус капилляра; R – радиус кривизны мениска жидкости в капилляре. Рs< Ро и ΔР = Ро - Рs > 0 – капиллярное давление направлено к центру кривизны. Это создает выталкивающую силу, стремящуюся поднять жидкость в капилляре, в результате чего она поднимается на некоторую высоту h.
ΔPгидр = gh·(ρж - ρг). Стенки капилляра не смачиваются жидкостью, кривизна мениска жидкости положительная.
Рs > Р0 и ∆Р = Р0 - Рs < 0, cosθ < 0, θ > 900 , но θ может быть и равен 1800 . Жидкость опускается в капилляре на величину h и тогда уравнение Жюрена записывается в виде: “-“ h = (2 sж - г ·соs θ)/ (rg (ρж - ρг ))
